В качестве катода можно выбрать любой металл с  >
>  .
.
Выбираем медь  = + 0,34 В. В паре Sn–Cu олово будет являться анодом ГЭ, медь – катодом. Составляем схему ГЭ:
= + 0,34 В. В паре Sn–Cu олово будет являться анодом ГЭ, медь – катодом. Составляем схему ГЭ:
А(-) Sn │ Sn2+ ││ Cu2+ │ Cu(+)K
Или
А(-) Sn │ SnSO4 ││ CuSO4 │ Cu(+)K.
Уравнения электродных процессов:
НОК ДМ
На A(-) Sn – 2ē = Sn2+ 1 – окисление
На К(+) Cu2+ + 2ē = Cu 1 – восстановление
Sn + Cu2+ = Sn2+ + Cu – суммарное ионно-молекулярное уравнение токообразующей реакции;
Sn + CuSO4 = SnSO4 + Cu – суммарное молекулярное уравнение токообразующей реакции.
Рассчитываем стандартное напряжение ГЭ:
 =
=  –
–  = +0,34 – (–0,14) = 0,48 В.
= +0,34 – (–0,14) = 0,48 В.
Б) Олово является катодом ГЭ.
В качестве анода ГЭ можно выбрать любой металл с  <
<  , кроме щелочных и щелочноземельных металлов, так как они реагируют с водой.
, кроме щелочных и щелочноземельных металлов, так как они реагируют с водой.
Выбираем магний 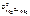 = –2,37 В.
= –2,37 В.
В паре Mg–Sn магний является анодом, олово – катодом.
Составляем схему ГЭ:
А(-) Mg │ Mg2+ ││ Sn2+ │ Sn(+)K
Или
А(-) Mg │ MgSO4 ││ SnSO4 │ Sn(+)K.
3. Составить схему коррозионного гальванического элемента, возникающего при контакте железа с цинком:
а) в атмосферных условиях (Н2О + О2);
б) кислой среде (Н2SO4);
в) кислой среде в присутствии кислорода (HCl + O2).
Написать уравнения электродных процессов и суммарной реакции процесса коррозии.
Решение
По табл. 11.1 находим значение стандартных электродных потенциалов железа (II) и цинка:
 = – 0,44В,
= – 0,44В,  = – 0,76В.
= – 0,76В.
Так как  <
<  , то анодом коррозионного гальванического элемента будет являться цинк, катодом – железо.
, то анодом коррозионного гальванического элемента будет являться цинк, катодом – железо.
а) Коррозия в атмосферных условиях (H2O + O2).
Составляем схему коррозионного ГЭ:
А(-)Zn H2O + O2 Fe(+)K
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:
НОК ДМ
На A(-) Zn – 2ē = Zn2+ 2
На К(+) 2H2O + O2 + 4ē = 4OH- 1
2Zn + 2H2O + O2 = 2Zn(OH)2 – суммарное молекулярное уравнение процесса коррозии.
б) Коррозия в кислой среде (H2SO4).
Составляем схему коррозионного ГЭ:
А(-)Zn │ H2SO4 │ Fe(+)K
Или
А(-)Zn │ H+ │ Fe(+)K
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:
НОК ДМ
На A(-) Zn – 2ē = Zn2+ 1
На К(+) 2H+ + 2ē = H2 1
Zn + 2H+ = Zn2+ + H2 – суммарное ионно-молекулярное уравнение процесса коррозии.
Zn + H2SO4 = ZnSO4 + H2 – суммарное молекулярное уравнение процесса коррозии.
в) Коррозия в кислой среде в присутствии кислорода (HCl + O2).
Составляем схему коррозионного ГЭ:
А(-)Zn │ HCl + O2 │ Fe(+)K
Или
А(-)Zn │ H+ + O2 │ Fe(+)K
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:
НОК ДМ
На A(-) Zn – 2ē = Zn2+ 2
На К(+) 4H+ + O2 + 4ē = 2H2O 1
2Zn + 4H+ + O2 = 2Zn2+ + 2H2O – суммарное ионно-молекулярное уравнение процесса коррозии.
2Zn + 4HCl + O2 = 2ZnCl2 + 2H2O – суммарное молекулярное уравнение процесса коррозии.
Во всех случаях коррозионному разрушению будет подвергаться более активный металл – цинк.
ЭЛЕКТРОЛИЗ РАСТВОРОВ
УРОВЕНЬ В
1. Составить схемы электролиза и написать уравнения электродных процессов водных растворов солей (анод инертный): а) хлорида меди (II); б) гидроксида натрия.
Какие продукты выделяются на катоде и аноде?
| Дано: а) CuCl2, б) NaОН. Анод инертный | Решение а) CuCl2 = Cu2+ + 2Cl-. Схему электролиза составляем в соответствии с табл. 11.1 и 11.2: K(-) A(+) инертный Cu2+ + 2ē = Cu 2Cl- – 2ē = Cl2 H2O H2O |
| 1. Схема электролиза –? 2. Продукты электролиза –? |
На катоде выделяется Cu, на аноде – Cl2.
б) NaОН = Na+ + ОН-.
K(-) A(+) инертный
Na+ 4ОН  – 4ē = О2 + 2H2О
– 4ē = О2 + 2H2О
2H2O + 2ē = H2 + 2OH-
На катоде выделяется Н2, на аноде – О2.
2. Составить схемы электролиза и написать уравнения электродных процессов водного раствора сульфата никеля (II), если: а) анод инертный; б) анод никелевый. Какие продукты выделяются на катоде и аноде?
| Дано: NiSO4 а) анод инертный б) анод никелевый | Решение
а) анод – инертный
NiSO4 = Ni2+ +  .
Схему электролиза составляем в соответствии с табл. 11.1. и 11.2: .
Схему электролиза составляем в соответствии с табл. 11.1. и 11.2:
|
| 1. Схема электролиза –? 2. Продукты электролиза –? |
K(-) A(+) инертный
Ni2+ + 2ē = Ni 
2H2O + 2ē = H2 + 2OH- 2H2O – 4ē = О2 + 4H+.
На катоде выделяется Ni и H2, на аноде выделяется О2.
б) анод – никелевый:
NiSO4 = Ni2+ + 
K(-) A(+) (Ni)
Ni2+ + 2ē = Ni  , Н2О
, Н2О
2H2O + 2ē = H2 + 2OH- Ni – 2ē = Ni2+.
На катоде выделяется Ni и H2, на аноде растворяется Ni.
При электролизе растворов а) нитрата кальция, б) нитрата серебра на аноде выделяется 560 мл газа (н.у.). Составить схему электролиза и написать уравнения электродных процессов. Определить, какое вещество и в каком количестве выделилось на катоде. Анод инертный.
Дано:
Электролиты:
а) Ca(NO3)2
б) AgNO3
 анод = 560 см3
Анод инертный анод = 560 см3
Анод инертный
| Решение
а) Ca(NO3)2 = Ca2+ + 2  .
Схема электролиза:
K(-) A(+) инертный
Ca2+ .
Схема электролиза:
K(-) A(+) инертный
Ca2+  2H2O + 2ē = H2O – 4ē =
= H2 + 2OH- =О2 + 4H+
На катоде выделяется Н2, на аноде выделяется О2.
По закону эквивалентов:
n эк (В1)(анод) = n эк (В2)(катод)
2H2O + 2ē = H2O – 4ē =
= H2 + 2OH- =О2 + 4H+
На катоде выделяется Н2, на аноде выделяется О2.
По закону эквивалентов:
n эк (В1)(анод) = n эк (В2)(катод)
|
1. Схема электролиза
2.  –?
3. –?
3.  –?
4. –?
4.  –? –?
|






