ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
УРОВЕНЬ B
1. а) Назвать следующие химические соединения и определить степень окисления всех элементов соединений: СО, Mn(OH)2, H2SO4, KHS, Na2CO3, FeOH(NO3)2.
б) Написать формулы следующих химических соединений: оксид свинца (IV), сульфат лития, хлорид гидроксоцинка, дигидроортофосфат алюминия
Ответ:
а) С+2О-2 – оксид углерода (II),
Mn+2 (O-2H+1)2 – гидроксид марганца (II),
Н+12S+4O-23 – сернистая кислота,
К+1Н+1S-2 – гидросульфид калия,
Na2+1С+4О-23 – карбонат натрия,
Fe+3O-2H+1(N+5O-23)2 – нитрат гидроксожелеза (III).
б) оксид свинца (IV) – PbO2,
сульфат лития – Li2SO4,
хлорид гидроксоцинка – ZnOHCl;
дигидроортофосфат алюминия – Al(H2PO4)3.
2. ЭКВИВАЛЕНТ. ЗАКОН ЭКВИВАЛЕНТОВ
УРОВЕНЬ В
1. Трехвалентный элемент образует оксид, содержащий 68,90 % мас. кислорода. Вычислить молярную массу эквивалента элемента и назвать элемент.
Дано:
 68,90 % мас.
В = 3 68,90 % мас.
В = 3
| Решение Чтобы назвать элемент, необходимо вычислить молярную массу атома элемента (М э). М э = М эк(Э)·В, |
| М эк(Э) –? Э –? |
где Мэк(Э)·– молярная масса эквивалента элемента;
В – валентность элемента.
По закону эквивалентов n эк(Э) = n эк(О), т.е.
 ,
,
откуда Мэк (Э) =  .
.
М эк(О) = 8 г/моль.
m окс = m э +  ;
;  = 68,9 г.
= 68,9 г.
m э = 100 –  = 100 – 68,9 = 31,1 г.
= 100 – 68,9 = 31,1 г.
М эк(Э) =  = 3,61 г/моль
= 3,61 г/моль
М эк(Э) =  ,
,
М э = М эк(Э) ∙ В = 3,61∙3 = 10,83 г/моль, что соответствует молекулярной массе атома бора.
Ответ: М эк(Э) = 3,61 г/моль; элемент – В.
2. На восстановление 7,2 г оксида потребовалось 2,24 л водорода, измеренного при н.у. Рассчитать молярные массы эквивалентов оксида и металла.
Дано:
m окс. = 7,2 г
 2,24 л 2,24 л
| Решение
По закону эквивалентов
nэк(окс) = nэк(H2),
  , ,
|
| М эк(окс.) –? М эк(Ме) –? |
где  = 11,2 л/моль.
= 11,2 л/моль.
М эк(окс) =  =
=  = 36 г/моль;
= 36 г/моль;
М эк(окс) = М эк(Ме) + М эк(О);
М эк(Ме) = М эк(окс) – М эк(О) = 36 – 8 = 28 г/моль.
Ответ: М эк(окс) = 36 г/моль;
М эк(Ме) = 28 г/моль.
3. Хлорид некоторого металла (MeClх) массой 0,493 г обработали избытком раствора AgNO3. При этом образовалось 0,86 г AgCl. Вычислить молярную массу эквивалента металла.
Дано:
 = 0,493 г = 0,493 г
 = 0,86 г = 0,86 г
| Решение
По закону эквивалентов nэк(МеCl х) = = nэк(AgCl) т.е.
 = =  ; ;
|
| M эк(Me) –? |
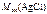 =
=  143,5 г/моль.
143,5 г/моль.
где 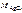 – молярная масса AgCl;
– молярная масса AgCl;
В – валентность серебра;
n – число атомов серебра в молекуле соли.
 =
=  ,
,
откуда 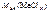 =
= 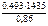 = 82,3 г/моль.
= 82,3 г/моль.
 =
=  +
+  ;
;

 г/моль.
г/моль.
 =
=  –
–  ,
,
 = 82,3 –35,5 = 46,8 г/моль.
= 82,3 –35,5 = 46,8 г/моль.
Ответ:  = 46,8 г/моль.
= 46,8 г/моль.
СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРОВ
УРОВЕНЬ В
1. Сколько граммов хлорида железа (III) содержится в 500 см3 0,1 н раствора?
| Дано: с эк(FeCl3) = 0,1 моль/л (0,1 н) V р-ра = 500 cм3 | Решение Молярную концентрацию эквивалентов FeCl3 определяем по формуле |

|
 .
.
откуда  ,
,

где  – молярная масса эквивалента хлорида железа (III).
– молярная масса эквивалента хлорида железа (III).
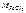 – молярная масса хлорида железа (III), г/моль:
– молярная масса хлорида железа (III), г/моль:
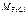 = 56 + 3∙35,5 = 162,5 г/моль,
= 56 + 3∙35,5 = 162,5 г/моль,
В = 3 – валентность железа,
n = 1 – число атомов железа в молекуле соли.
Тогда 
где  =
=  54,17 г/моль;
54,17 г/моль;
10-3 – пересчет кубических сантиметров в литры.
Ответ: 
2. Сколько граммов хлорида магния потребуется для приготовления 800 см3 25 %-го раствора плотностью 1,2 г/см3?
Дано:
 = 800 cм3 = 800 cм3
 25 % мас. 25 % мас.
 = 1,2 г/см3 = 1,2 г/см3
| Решение
Массовая доля MgCl2 равна
 откуда
откуда 
|
 ? ?
|
m р-ра = V р-ра·ρр-ра = 800·1,2 = 960 г.
Откуда

Ответ: 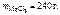
3. Определить молярную концентрацию вещества в растворе, содержащем 40 г сульфата меди (II) в 800 см3 раствора.
Дано:
V р-ра = 800 мл
 = 40 г = 40 г
| Решение
Молярную концентрацию СuSO4 определяем по формуле
 моль/л, моль/л,
|

|
где  молярная масса сульфата меди (II), г/моль.
молярная масса сульфата меди (II), г/моль.
 = 64 + 32 + 64 = 160 г/моль.
= 64 + 32 + 64 = 160 г/моль.
Тогда

где 10-3 – пересчет кубических сантиметров в литры.
Ответ:  = 0,31 моль/л.
= 0,31 моль/л.
Определить моляльность вещества в растворе, если в 100 г раствора содержится 5,3 г карбоната натрия.
Дано:
m р-ра = 100 г

| Решение
Моляльность Na2CO3 в растворе определяем по формуле
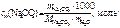 . .
|

|






