«а певних умов проведенн€ анал≥з≥в кат≥они сум≥ш≥ четвертоњ, пТ€тоњ та шостоњ анал≥тичних груп можна ви€вити дробним методом.
ат≥они Fe2+ можна ви€вити в окрем≥й проб≥ досл≥джуваного розчину д≥ючи розчином K3[Fe(CN)6] у кислому середовищ≥ Ц утворенн€ Fe3[Fe(CN)6]2 синього забарвленн€ або д≥ючи розчином α,α'-дип≥ридилом. «а другим вар≥антом на смужку ф≥льтрувального паперу нанос€ть 1-2 крапл≥ досл≥джуваного розчину, 1-2 крапл≥ розчину хлоридноњ кислоти (с(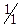 HCl)=0,1моль/дм3) та 1-2 крапл≥ розчину α,α'-дип≥ридилу. «а на€вност≥ кат≥он≥в Fe2+ пап≥р набуваЇ червоного забарвленн€.
HCl)=0,1моль/дм3) та 1-2 крапл≥ розчину α,α'-дип≥ридилу. «а на€вност≥ кат≥он≥в Fe2+ пап≥р набуваЇ червоного забарвленн€.
ат≥они Fe3+ можна ви€вити з окремоњ проби досл≥джуваного розчину д≥Їю розчином K4[Fe(CN)6] Ц утворенн€ Fe4[Fe(CN)6]3 синього забарвленн€.
ƒл€ ви€вленн€ кат≥он≥в Al3+ можна застосувати розчини ал≥зарину або алюм≥нону.
1. Ќа смужку ф≥льтрувального паперу нанос€ть1-2 крапл≥ розчину 3[Fe(CN)6], п≥дсушують над полумТ€м газового пальника, пот≥м нанос€ть 1-2 крапл≥ досл≥джуваного розчину. ѕ≥сл€ цього нанос€ть 1-2 крапл≥ спиртового розчину ал≥зарину (w=0,1%) ≥ тримають пап≥р над шийкою посудини з розчином амон≥аку. ѕл€ма на папер≥ забарвлюЇтьс€ у ф≥олетовий кол≥р. ѓњ змочують краплею розчину оцтовоњ кислоти (с(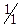 —H3CќќЌ)=1,0моль/дм3) та висушують. «а на€вност≥ кат≥он≥в Al3+ зТ€вл€Їтьс€ червоне к≥льце.
—H3CќќЌ)=1,0моль/дм3) та висушують. «а на€вност≥ кат≥он≥в Al3+ зТ€вл€Їтьс€ червоне к≥льце.
2. ” проб≥рку внос€ть 3-4 крапл≥ досл≥джуваного розчину, додають 3-4 крапл≥ розчину оцтовоњ кислоти (с(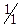 —H3CќќЌ)=2,0моль/дм3) та 2-4 крапл≥ розчину алюм≥нону (w=0,1%). ѕроб≥рку нагр≥вають, вм≥ст добре перем≥шують ≥ додають краплинами розчин амон≥аку (с(
—H3CќќЌ)=2,0моль/дм3) та 2-4 крапл≥ розчину алюм≥нону (w=0,1%). ѕроб≥рку нагр≥вають, вм≥ст добре перем≥шують ≥ додають краплинами розчин амон≥аку (с(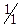 NH3ЈЌ2ќ)=2,0моль/дм3), а пот≥м внос€ть 2-3 крапл≥ розчину амон≥й карбонату (с(
NH3ЈЌ2ќ)=2,0моль/дм3), а пот≥м внос€ть 2-3 крапл≥ розчину амон≥й карбонату (с(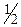 (NH4)2—ќ3)=2,0моль/дм3). «а на€вност≥ у розчин≥ кат≥он≥в Al3+ розчин забарвлюЇтьс€ у червоний кол≥р або зТ€вл€Їтьс€ осад.
(NH4)2—ќ3)=2,0моль/дм3). «а на€вност≥ у розчин≥ кат≥он≥в Al3+ розчин забарвлюЇтьс€ у червоний кол≥р або зТ€вл€Їтьс€ осад.
ат≥они Cr3+ ви€вл€ють окисненн€м њх до надхромових кислот. ” проб≥рку внос€ть 3-4 крапл≥ досл≥джуваного розчину додають вдв≥ч≥ б≥льше розчину ќЌ з с(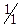 ќЌ)=2,0моль/дм3 та 3-4 крапл≥ розчину Ќ2ќ2 (w=3%) ≥ нагр≥вають до тих п≥р, доки зелене забарвленн€ не перейде у жовте.
ќЌ)=2,0моль/дм3 та 3-4 крапл≥ розчину Ќ2ќ2 (w=3%) ≥ нагр≥вають до тих п≥р, доки зелене забарвленн€ не перейде у жовте.
ѕоловину отриманого жовтого розчину перенос€ть в ≥ншу проб≥рку, охолоджують, додають розчин н≥тратноњ кислоти (с(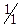 HNќ3)=2,0моль/дм3) до кислоњ реакц≥њ середовища, пот≥м додають 2 крапл≥ розчину Ќ2ќ2, дек≥лька крапель ≥зоам≥лового спирту та енерг≥йно струшують проб≥рку. «а на€вност≥ Cr3+ п≥сл€ розшаруванн€ фаз верхн€ орган≥чна фаза набуваЇ синього забарвленн€ за рахунок утворених надхромових кислот
HNќ3)=2,0моль/дм3) до кислоњ реакц≥њ середовища, пот≥м додають 2 крапл≥ розчину Ќ2ќ2, дек≥лька крапель ≥зоам≥лового спирту та енерг≥йно струшують проб≥рку. «а на€вност≥ Cr3+ п≥сл€ розшаруванн€ фаз верхн€ орган≥чна фаза набуваЇ синього забарвленн€ за рахунок утворених надхромових кислот
(H2CrO6 зокрема).
ат≥они Zn2+ краще ви€вити за допомогою д≥т≥зону. ” порцел€нову чашку внос€ть дек≥лька крапель досл≥джуваного розчину, 0,5см3 розчину оцтовоњ кислоти (с(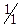 —H3CќќЌ)=2,0моль/дм3), 0,5см3 розчину натр≥й ацетату (с(
—H3CќќЌ)=2,0моль/дм3), 0,5см3 розчину натр≥й ацетату (с(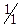 —H3CќќNa)=2,0моль/дм3), 4-5 крапель розчину Na2S2O3 (с(
—H3CќќNa)=2,0моль/дм3), 4-5 крапель розчину Na2S2O3 (с(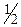 Na2S2O3)=1,0моль/дм3), додають близько 1cм3 розчину д≥т≥зону у хлороформ≥ або CCl4, перем≥шують. «а на€вност≥ кат≥он≥в Zn2+ утворюЇтьс€ червоне забарвленн€ комплексу цинк д≥т≥зонату.
Na2S2O3)=1,0моль/дм3), додають близько 1cм3 розчину д≥т≥зону у хлороформ≥ або CCl4, перем≥шують. «а на€вност≥ кат≥он≥в Zn2+ утворюЇтьс€ червоне забарвленн€ комплексу цинк д≥т≥зонату.
«а в≥дсутност≥ у досл≥джуваному розчин≥ кат≥он≥в Cu2+, Co2+, Mn2+ ви€вл€ти кат≥они Zn2+ можна за реакц≥Їю з амон≥й тетрародано(≤≤) меркуратом ≥з загального розчину у присутност≥ вс≥х ≥нших кат≥он≥в.
|
|
|
ат≥они Mn2+ визначають з окремоњ проби окисненн€м њх до ан≥она MnO4− за участ≥ окисник≥в PbO2 або (NH4)2S2O8. –озчин набуваЇ слабкого ф≥олетового забарвленн€.
ат≥они Mg2+ можна ви€вити за участ≥
n-н≥тробензолазорезорцину або n-н≥тробензолазо-α-нафтолу. Ќа предметне скло м≥кроскопа нанос€ть 2-3 крапл≥ досл≥джуваного розчину та 1 краплю лужного розчину реактиву. «а на€вност≥ кат≥он≥в Mg2+ зТ€вл€Їтьс€ синЇ забарвленн€ розчину або син≥й осад. якщо досл≥джуваний розчин маЇ сильно кислу реакц≥ю, то зТ€вл€Їтьс€ жовте забарвленн€. “од≥ сл≥д додати ще 2-3 крапл≥ розчину NaOH до переходу забарвленн€ в синЇ. ат≥они Mg2+ можна ви€вити також м≥крокристалоскоп≥чною реакц≥Їю з Na2HPO4 у присутност≥ амон≥аку та NH4Cl. ”творюЇтьс€ характерний кристал≥чний осад MgNH4PO4.
ѕопередньо кат≥они Sb3+, Sb5+, Sn2+, Sn4+, Bi3+ можна ви€вити за властивост€ми њх солей г≥дрол≥зуватись. ƒо 0,5-1,0см3 досл≥джуваного розчину приливають 3-5-кратний обТЇм води. ”творенн€ при цьому б≥лого осаду або помутн≥нн€ розчину вказуЇ на на€вн≥сть у розчин≥ цих кат≥он≥в кожного окремо, або вс≥х разом. ат≥они Sn2+ ви€вл€ють за реакц≥€ми в≥дновленн€ йон≥в Bi3+ або Hg2+ у лужному середовищ≥ при в≥дсутност≥ у розчин≥ кат≥он≥в Sb3+ або за реакц≥Їю з мол≥бденовою р≥диною; за на€вност≥ у розчин≥ кат≥он≥в Sb3+ йони Sn2+ ви€вл€ютьс€ цими ж реакц≥€ми крапельним методом.
ƒл€ цього на смужку ф≥льтрувального паперу нанос€ть по краплин≥ розчин≥в Bi(NO3)3 або HgCl2, висушують, пот≥м на суху пл€му нанос€ть краплю не кислого досл≥джуваного розчину та краплю ан≥л≥ну. «а на€вност≥ у розчин≥ йон≥в Sn2+ через де€кий час п≥д краплею розчину зТ€вл€Їтьс€ темна пл€ма Ц вид≥л€Їтьс€ метал≥чний б≥смут або ртуть.
ат≥они Sb3+ ви€вл€ють з окремоњ проби досл≥джуваного розчину разом ≥з осадом. ƒо суспенз≥њ додають розчин HNO3, кипТ€т€ть ≥ розвод€ть в 3-4 рази водою. ¬≥дбуваЇтьс€ г≥дрол≥з солей —тиб≥ю, випадаЇ б≥лий осад. ƒо цього осаду додають розчин H2S. ”творюЇтьс€ Sb2S3, що маЇ характерне оранжево-червоне забарвленн€.
ат≥они Bi3+ та Hg2+ за в≥дсутност≥ у досл≥джуваному розчин≥ кат≥он≥в Sb3+ можна ви€вити наступним способом: на добре в≥дпол≥ровану алюм≥н≥Їву, цинкову або зал≥зну пластинку нанос€ть краплю розчину HCl ≥ на нењ Ц краплю досл≥джуваного розчину; на€вн≥сть п≥д краплею чорноњ або темно-с≥роњ пл€ми св≥дчить про на€вн≥сть у розчин≥ йон≥в Bi3+ та Hg2+ або обох разом.
якщо у розчин≥ Ї кат≥они Sb3+, њх видал€ють шл€хом г≥дрол≥зу сол≥ —тиб≥ю. ƒл€ цього н≥тратнокислу пробу досл≥джуваного розчину розвод€ть у 2-3 рази водою. ѕри цьому в≥дбуваЇтьс€ г≥дрол≥з сол≥ —тиб≥ю з утворенн€м стиб≥л хлориду:
SbCl3 + H2O 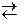 SbOCl↓ +2HCl.
SbOCl↓ +2HCl.
ат≥они Hg2+ ви€вл€ють у присутност≥ вс≥х кат≥он≥в крапельним методом за допомогою KI чи за допомогою Sn2+ у присутност≥ ан≥л≥ну. ат≥они Hg2+ можна досить легко видалити з досл≥джуваного розчину. ƒл€ цього до окремоњ проби розчину додають такий же обТЇм розчину сульфатноњ кислоти (с(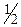 H2Sќ4)=2,0моль/дм3), внос€ть дек≥лька кристалик≥в Na2S2O3 ≥ 2-3хв. кипТ€т€ть. ќтриманий при цьому осад сульф≥д≥в ћеркур≥ю, упруму, —тануму, јрсену, —тиб≥ю та Ѕ≥смуту в≥дф≥льтровують або центрифугують, промивають, додають розведений гар€чий розчин HNO3. ” розчин переход€ть Bi3+ та Cu2+.
H2Sќ4)=2,0моль/дм3), внос€ть дек≥лька кристалик≥в Na2S2O3 ≥ 2-3хв. кипТ€т€ть. ќтриманий при цьому осад сульф≥д≥в ћеркур≥ю, упруму, —тануму, јрсену, —тиб≥ю та Ѕ≥смуту в≥дф≥льтровують або центрифугують, промивають, додають розведений гар€чий розчин HNO3. ” розчин переход€ть Bi3+ та Cu2+.
„астину осаду, €ка не розчинилась, у €к≥й м≥ститьс€ HgS, розчин€ють у концентрован≥й н≥тратн≥й кислот≥, упарюють, розвод€ть водою, ф≥льтрують ≥ у ф≥льтрат≥ ви€вл€ють йони Hg2+ або за реакц≥Їю в≥дновленн€ Hg2+ до метал≥чноњ ртут≥, або за реакц≥Їю ≥з KI, або за реакц≥Їю з H2S.
|
|
|
ат≥они Ni2+ можна ви€вити за реакц≥Їю з диметилгл≥оксимом без видаленн€ з розчину вс≥х кат≥он≥в, окр≥м Fe2+ та Cu2+, €кщо вони присутн≥ у великих концентрац≥€х, оск≥льки йони Fe2+ взаЇмод≥ють з диметилгл≥оксимом €к ≥ кат≥они Ni2+, а йони Cu2+ у амон≥ачному розчин≥ маскують ≥нтенсивним забарвленн€м [Cu(NH3)4]2+ забарвленн€ н≥кол диметилгл≥оксимату. ƒл€ видаленн€ з розчину йон≥в Fe2+ њх окиснюють додаванн€м до розчину H2O2, а йони Cu2+ осаджують у вигл€д≥ CuS або CuO.
ат≥они Bi3+ за в≥дсутност≥ у досл≥джуваному розчин≥ йон≥в Sb3+ та Hg2+ можна легко ви€вити за реакц≥Їю њх в≥дновленн€ до метал≥чного б≥смуту йонами SnO22Ц у лужному середовищ≥. «а на€вност≥ у розчин≥ йон≥в Sb3+ та Hg2+ кат≥они Bi3+ можна ви€вити наступним способом: у проб≥рку внос€ть 5-6 крапель досл≥джуваного розчину, додають ст≥льки ж розчину сульфатноњ кислоти (с(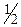 H2Sќ4)=2,0моль/дм3), внос€ть 2-3 кристалика натр≥й т≥осульфату, нагр≥вають майже до кип≥нн€ прот€гом близько 5 хв. ƒо утвореного осаду додають близько 10 крапель розведеноњ н≥тратноњ кислоти, перем≥шують, центрифугують. ” центрифугат≥ ви€вл€ють кат≥они Bi3+ за будь-€кою реакц≥Їю на ц≥ йони.
H2Sќ4)=2,0моль/дм3), внос€ть 2-3 кристалика натр≥й т≥осульфату, нагр≥вають майже до кип≥нн€ прот€гом близько 5 хв. ƒо утвореного осаду додають близько 10 крапель розведеноњ н≥тратноњ кислоти, перем≥шують, центрифугують. ” центрифугат≥ ви€вл€ють кат≥они Bi3+ за будь-€кою реакц≥Їю на ц≥ йони.
ат≥они —о2+ легко ви€вл€ютьс€ крапельним методом на ф≥льтрувальному папер≥ концентрованим розчином NH4SCN.
ƒл€ ви€вленн€ кат≥он≥в Cd2+ у проб≥рку внос€ть 2-3 крапл≥ досл≥джуваного розчину, додають 3-4 крапл≥ розчину сульфатноњ кислоти (с(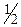 H2Sќ4)=2,0моль/дм3), два кристалика Na2S2O3, нагр≥вають прот€гом близько 5хв. на кипл€ч≥й вод€н≥й бан≥, центрифугують. Ќа смужку ф≥льтрувального паперу нанос€ть
H2Sќ4)=2,0моль/дм3), два кристалика Na2S2O3, нагр≥вають прот€гом близько 5хв. на кипл€ч≥й вод€н≥й бан≥, центрифугують. Ќа смужку ф≥льтрувального паперу нанос€ть
2-3 крапл≥ центрифугату ≥ тримають над скл€нкою з розчином H2S. ѕо€ва жовтого забарвленн€ пл€ми св≥дчить про утворенн€ CdS.
ќсад, що утворивс€ при д≥њ на досл≥джуваний розчин розчином сульфатноњ кислоти ≥ Na2S2O3 при нагр≥ванн≥, €вл€Ї собою сум≥ш HgS, Cu2S, As2S3, Sb2S3, Bi2S3. ƒо нього додають розведений розчин HNO3, довод€ть до кип≥нн€. ќтриманий розчин в≥дд≥л€ють в≥д осаду центрифугуванн€м. ƒо центрифугату, що м≥стить кат≥они Cu2+, додають розчин амон≥аку або 3[Fe(CN)6]. ” першому випадку утворюЇтьс€ лазурно-синЇ забарвленн€ розчину за рахунок [Cu(NH3)4]2+ або коричневий осад Cu2[Fe(CN)6] у другому випадку.
ат≥они Cu2+ ви€вл€ють ≥з загального розчину у присутност≥ вс≥х кат≥он≥в в≥дновленн€м њх до метал≥чноњ м≥д≥ на цинков≥й, алюм≥н≥Їв≥й або зал≥зн≥й пластинках. ”творюЇтьс€ пл€ма червоно-бурого кольору.
ƒл€ ви€вленн€ йон≥в As3+ та Asv до невеликоњ проби досл≥джуваного розчину додають розчин Na2CO3, утворений осад в≥дд≥л€ють ф≥льтруванн€м або центрифугуванн€м, ф≥льтрат або центрифугат нейтрал≥зують розчином хлоридноњ кислоти ≥ кипТ€т€ть дл€ видаленн€ —ќ2. « нейтрал≥зованого розчину, що м≥стить т≥льки AsO33Ц або AsO43Ц, ви€вл€ють јрсен за реакц≥Їю з магнез≥альною сум≥шшю (ви€вленн€ AsO43Ц або з мол≥бденовою р≥диною у присутност≥ невеликоњ к≥лькост≥ SnCl2 (ви€вленн€ AsO43Ц), або з H2S у розчин≥ хлоридноњ кислоти (ви€вленн€ AsO33Ц або AsO43Ц у вигл€д≥ As2S3 або As2O5), або з розчином ≤ у розчин≥ хлоридноњ кислоти (ви€вленн€ AsO43Ц), або йоду (ви€вленн€ AsO33Ц).






