ƒо пТ€тоњ анал≥тичноњ групи в≥днос€ть кат≥они Fe2+, Fe3+, Mg2+, Mn2+, Bi3+, Sb3+, SbV.
≈лектронна будова кат≥он≥в пТ€тоњ анал≥тичноњ групи:
Fe2+ − [Ar] 3d6; Fe3+ − [Ar] 3d5; Mg2+ − [Ne]; Mn2+ − [Ar] 3d5; Bi3+ − [Xe]
4f145d106p2; Sb3+ − [Kr] 4d105p2.
÷≥ елементи, за вин€тком Bi та Mg, про€вл€ють у сполуках зм≥нну ступ≥нь окисненн€ та схильн≥ до комплексоутворенн€.
√≥дроксиди кат≥он≥в ц≥Їњ анал≥тичноњ групи, окр≥м Sb(OH)3, не мають амфотерних властивостей та не утворюють розчинних ам≥нокомплекс≥в.
ѕри д≥њ надлишку групового реагенту Ц розчину лугу NaOH або ќЌ на кат≥они пТ€тоњ анал≥тичноњ групи утворюютьс€ дуже малорозчинн≥ в≥дпов≥дн≥ г≥дроксиди:
ƒ–(Fe(OH)2)=7,2Ј10Ц16; ƒ–(Fe(OH)3)=3,2Ј10Ц40;
ƒ–(Mg(OH)2)=6,0Ј10Ц10; ƒ–(Bi(OH)3)=4,3Ј10Ц31;
ƒ–(Mn(OH)2)=1,9Ј10Ц13.
Ќерозчинн≥сть г≥дроксид≥в кат≥он≥в пТ€тоњ анал≥тичноњ групи (окр≥м Sb(OH)3) у розчин≥ луг≥в та розчин≥ амон≥аку Ї характерною особлив≥стю ц≥Їњ групи кат≥он≥в. јле ц≥ г≥дроксиди легко розчин€ютьс€ у розчинах хлоридноњ, сульфатноњ, н≥тратноњ кислот.
¬с≥ сол≥ —тиб≥ю та Ѕ≥смуту легко г≥дрол≥зуютьс€ з утворенн€м в≥дпов≥дних основних солей:
SbCl3 + H2O 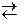 SbOCl↓ + 2HCl;
SbOCl↓ + 2HCl;
SbCl5 + 2H2O 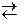 SbO2Cl↓ + 4HCl.
SbO2Cl↓ + 4HCl.
ќсобливо легко г≥дрол≥зуютьс€ н≥трати —тиб≥ю, що даЇ можлив≥сть в≥дд≥лити —тиб≥й в≥д ≥нших кат≥он≥в пТ€тоњ анал≥тичноњ групи.
BiCl3 + 2H2O 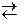 Bi(OH)2Cl↓ + 2HCl;
Bi(OH)2Cl↓ + 2HCl;
Bi(OH)2Cl 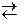 BiOCl↓ + H2ќ.
BiOCl↓ + H2ќ.
” дещо менш≥й м≥р≥, але аналог≥чно, г≥дрол≥зуЇтьс€ ≥ б≥смут н≥трат з утворенн€м б≥смутит н≥трату BiONO3. ƒл€ попередженн€ г≥дрол≥зу до водних розчин≥в солей —тиб≥ю та Ѕ≥смуту завжди додаЇтьс€ в≥дпов≥дна кислота, внасл≥док чого розчини мають кислу реакц≥ю. ¬иход€чи з цього, €кщо досл≥джуваний на кат≥они пТ€тоњ анал≥тичноњ групи розчин маЇ нейтральну реакц≥ю ≥ при цьому не маЇ осаду, то це може бути ознакою, що в такому розчин≥ в≥дсутн≥ кат≥они Sb3+, Sb5+, Bi3+. якщо ж досл≥джуваний розчин мутний або маЇ б≥лий осад ≥ разом ≥з тим маЇ нейтральну або слабкокислу реакц≥ю, то в цьому розчин≥ можуть бути кат≥они —тиб≥ю або Ѕ≥смуту, або ж обидва разом.
¬ дуже незначн≥й м≥р≥ г≥дрол≥зуютьс€ також сол≥ Fe3+. ѕри нагр≥ванн≥ розчин≥в г≥дрол≥з цих солей п≥дсилюЇтьс€.
—тиб≥й(≤≤≤) г≥дроксид Sb(OH)3, або метастиб≥йна кислота HSbO2, б≥лого кольору пор≥вн€но легко розчин€Їтьс€ €к у кислотах, так ≥ в розчинах луг≥в:
HSbO2 + 3Ќ+ → Sb3+ + 2H2O;
HSbO2 + OЌ− → SbO2− + H2O.
ѕ≥д д≥Їю н≥тратноњ кислоти метастиб≥йна кислота окиснюЇтьс€ до стиб≥йноњ H3SbO4, €ку можна виразити також €к nSb2O5ЈmH2O. ¬она розчин€Їтьс€ т≥льки в концентрованих розчинах луг≥в ≥ хлоридноњ кислоти.
–озчинн≥ карбонати з ус≥ма кат≥онами пТ€тоњ анал≥тичноњ групи утворюють осади: з кат≥онами Mn2+ та Fe2+ Ц MnCO3 та FeCO3; з кат≥онами Mg2+, Fe3+, Bi3+ Ц основних карбонат≥в Mg2(OH)2CO3, Fe(OH)CO3, Bi(OH)CO3; з кат≥онами Sb3+ та SbV Ц Sb(OH)3 i nSb2O5ЈmH2O. ¬с≥ осади, за вин€тком Fe(OH)CO3, б≥лого кольору. Fe(OH)CO3 маЇ буре забарвленн€. ‘ерум(≤≤) карбонат FeCO3 на пов≥тр≥ легко окиснюЇтьс€ до Fe(OH)CO3, внасл≥док чого забарвленн€ його вже в момент утворенн€ набуваЇ бурого кольору.
|
|
|
¬с≥ ц≥ карбонати легко розчин€ютьс€ в м≥неральних кислотах, а основний магн≥й карбонат, кр≥м того, легко розчин€Їтьс€ у розчинах амон≥йних солей:
Mg2(OH)2CO3 + 4NH4Cl → 2MgCl2 + 2NH3ЈH2ќ + (NH4)2CO3.
јмон≥й карбонат повн≥стю г≥дрол≥зуЇтьс€:
(NH4)2CO3 + H2O 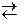 2NH3ЈH2O + CO2.
2NH3ЈH2O + CO2.
«агальне р≥вн€нн€ реакц≥њ набуваЇ вигл€ду:
Mg2(OH)2CO3 + 4NH4Cl + H2O → 2MgCl2 + 4NH3ЈH2O + CO2.
÷€ властив≥сть Mg2(OH)2CO3 використовуЇтьс€ дл€ в≥дд≥ленн€ кат≥он≥в Mg2+ в≥д ≥нших кат≥он≥в пТ€тоњ анал≥тичноњ групи.
√≥дрофосфат-≥они з ус≥ма кат≥онами пТ€тоњ анал≥тичноњ групи утворюють б≥л≥ аморфн≥ осади: з кат≥онами Fe2+, Fe3+, Mn2+, Bi3+ утворюють середн≥ фосфати Fe3(PO4)2, FePO4, Mn3(PO4)2 та BiPO4; з кат≥онами Mg2+ Ц магн≥й г≥дрофосфату MgHPO4; з кат≥онами —тиб≥ю Ц в≥дпов≥дн≥ г≥дроксиди внасл≥док г≥дрол≥зу фосфатних солей —тиб≥ю.
Ќа в≥дм≥ну в≥д ≥нших кат≥он≥в пТ€тоњ анал≥тичноњ групи, кат≥они Mg2+ при взаЇмод≥њ з г≥дрофосфат-≥онами у присутност≥ амон≥аку та йон≥в амон≥ю утворюють характерний др≥бнокристал≥чний осад подв≥йноњ сол≥ магн≥й-амон≥й фосфату:
Mg2+ + NH4OH + HPO42Ц → NH4MgPO4↓ + H2O.
÷€ реакц≥€, зазвичай, ≥ застосовуЇтьс€ дл€ ви€вленн€ кат≥он≥в Mg2+ у розчинах.
ѕри взаЇмод≥њ сульф≥д-≥он≥в у розчин≥ хлоридноњ кислоти з кат≥онами Sb3+, Sb5+, Bi3+ утворюютьс€ осади в≥дпов≥дних сульф≥д≥в: Bi2S3 Ц чорного кольору; Sb2S3 та Sb2S5 Ц €скраво-оранжевого кольору. —ульф≥ди ≥нших кат≥он≥в пТ€тоњ анал≥тичноњ групи у хлоридн≥й кислот≥ розчинн≥. “ому з H2S у кислому середовищ≥ вони осад≥в не утворюють.
ќтже, €кщо через окрему пробу досл≥джуваного розчину, п≥дкисненого хлоридною кислотою, пропустити г≥дроген сульф≥д, то утворенн€ чорного осаду буде св≥дчити про на€вн≥сть у цьому розчин≥ кат≥он≥в Bi3+. якщо ж при в≥дсутност≥ у розчин≥ йон≥в Bi3+ при пропусканн≥ через цей розчин H2S утворюЇтьс€ оранжевий осад Ц то це вказуЇ на на€вн≥сть у розчин≥ кат≥он≥в Sb3+ або Sb5+, а кат≥они Bi3+ в≥дсутн≥. ÷€ реакц≥€ часто застосовуЇтьс€ дл€ ви€вленн€ кат≥он≥в Sb3+ та Sb5+ у розчинах, оск≥льки забарвленн€ Sb2S3 та Sb2S5 Ї дуже характерним ≥ в≥др≥зн€Їтьс€ в≥д забарвленн€ сульф≥д≥в ≥нших метал≥в.
” присутност≥ солей амон≥ю о -оксих≥нол≥н з ус≥ма кат≥онами пТ€тоњ анал≥тичноњ групи утворюЇ осади, серед €ких осад внутр≥шньокомплексноњ сол≥ магн≥й оксих≥нол≥нату €вл€Ї собою характерн≥ зеленувато-жовт≥ кристали:
4.6.1. –еакц≥њ ви€вленн€ кат≥он≥в Fe2+
ƒосл≥д 1. ѕри д≥њ на розчин, що м≥стить кат≥они Fe2+, розчинами луг≥в NaOH, KOH в осад випадаЇ ферум(≤≤) г≥дроксид б≥лого кольору:
Fe2+ + 2OH− → Fe(OH)2↓.
Fe2+ Ї досить сильним в≥дновником. ≈ºFe2+/Fe3+ = Ц0,77¬, тому йон Fe2+ у розчин≥ або 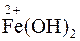 в осад≥ легко окиснюЇтьс€ нав≥ть киснем пов≥тр€ до Fe3+. √≥дратований йон Fe2+ маЇ зеленувате забарвленн€. ѕри окисненн≥ утворюЇтьс€ йон Fe3+, €кий маЇ коричнево-буре забарвленн€. Ќа пов≥тр≥ б≥лий осад Fe(OH)2 досить швидко набуваЇ с≥ро-зеленого забарвленн€, а пот≥м бурого.
в осад≥ легко окиснюЇтьс€ нав≥ть киснем пов≥тр€ до Fe3+. √≥дратований йон Fe2+ маЇ зеленувате забарвленн€. ѕри окисненн≥ утворюЇтьс€ йон Fe3+, €кий маЇ коричнево-буре забарвленн€. Ќа пов≥тр≥ б≥лий осад Fe(OH)2 досить швидко набуваЇ с≥ро-зеленого забарвленн€, а пот≥м бурого.
ƒосл≥д 2. ѕри взаЇмод≥њ кат≥он≥в Fe2+ з водним розчином амон≥аку теж утворюЇтьс€ осад ферум(≤≤) г≥дроксиду:
2NH3ЈH2O + Fe2+ → Fe(OH)2↓ + 2NH4+.
÷ю реакц≥ю треба проводити у сильнолужному середовищ≥ при рЌ=12-13. Ќа€вн≥сть йон≥в амон≥ю перешкоджаЇ випад≥нню осаду оск≥льки вони зм≥щують р≥вновагу у б≥к утворенн€ йон≥в Fe2+ у розчин≥.
|
|
|
ƒосл≥д 3. ал≥й гексац≥ано(≤≤≤) ферат взаЇмод≥Ї з кат≥онами Fe2+ з утворенн€м синього осаду турнбулевоњ син≥ Ц ферум(≤≤) гексац≥ано(≤≤≤) ферату:
2[Fe(—N)6]3Ц + 3Fe2+ → Fe3[Fe(—N)6]2↓
÷ей осад нерозчинний у кислотах. ƒоц≥льно цю реакц≥ю проводити в сильнокислому середовищ≥ при рЌ=3. ѕри д≥њ луг≥в NaOH або ќЌ на осад турнбулевоњ син≥ вона розкладаЇтьс€.
ат≥они Fe3+ та ≥нш≥ кат≥они пТ€тоњ анал≥тичноњ групи не заважають переб≥гу даноњ реакц≥њ.
ƒосл≥д 4. ѕри взаЇмод≥њ кат≥он≥в Fe2+ з диметилгл≥оксимом (реактив „угаЇва) утворюЇтьс€ хелатний комплекс карм≥ново-червоного кольору, в≥дм≥нного за забарвленн€ в≥дпов≥дного комплексу з Ќ≥колом:
ƒана реакц≥€ проводитьс€ у амон≥ачному середовищ≥ при рЌ≈9. ѕереб≥гу ц≥Їњ реакц≥њ заважають кат≥они Mn2+, Ni2+, €к≥ утворюють з реактивом „угаЇва в≥дпов≥дн≥ забарвлен≥ комплекси, а кат≥они —о2+ при високих концентрац≥€х утворюють осад бурого кольору.
ƒосл≥д 5. ат≥они Fe2+ у кислих розчинах утворюють хелатн≥ комплекси червоного кольору також з α,α'-дип≥ридилом:
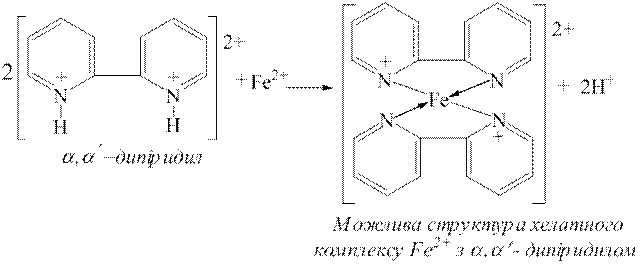
| |
ƒл€ проведенн€ ц≥Їњ реакц≥њ до дек≥лькох крапель досл≥джуваного на кат≥они Fe2+ розчину додають дек≥лька крапель розчину хлоридноњ кислоти (с( ЌCl)=0,1моль/дм3) ≥ краплю розчину α,α'-дип≥ридил г≥дрохлориду. «а на€вност≥ йон≥в Fe2+ виникаЇ червоне забарвленн€.
ЌCl)=0,1моль/дм3) ≥ краплю розчину α,α'-дип≥ридил г≥дрохлориду. «а на€вност≥ йон≥в Fe2+ виникаЇ червоне забарвленн€.
ѕереб≥гу ц≥Їњ реакц≥њ йони Fe3+ не заважають.
ƒосл≥д 6. ќкисненн€ кат≥она Fe2+ у Fe3+.
ƒл€ проведенн€ ц≥Їњ реакц≥њ беруть дек≥лька крапель розчину, що м≥стить йони Fe2+, додають 2-3 крапл≥ розчину сульфатноњ кислоти (с( Ќ2SO4)=2,0моль/дм3) та 2-3 крапл≥ розчину н≥тратноњ кислоти (w=30%), сум≥ш нагр≥вають. –еакц≥ю провод€ть у вит€жн≥й шаф≥:
Ќ2SO4)=2,0моль/дм3) та 2-3 крапл≥ розчину н≥тратноњ кислоти (w=30%), сум≥ш нагр≥вають. –еакц≥ю провод€ть у вит€жн≥й шаф≥:
3Fe2+ + 4Ќ+ + NO3− → 3Fe3+ + NO↑ + 2H2O.
«еленувате забарвленн€ розчину зм≥нюЇтьс€ на коричнево-буре.
ƒосл≥д 7. ¬и€вленн€ Fe2+-≥он≥в за реакц≥Їю з 1,10-фенантрол≥ном.
Fe2+-≥они утворюють з 1,10-фенантрол≥ном при рЌ 2Ц9 ≥нтенсивно забарвлену у червоно-оранжевий кол≥р комплексну сполуку:
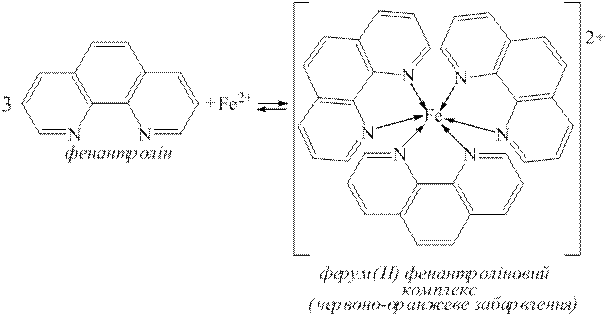
ƒо дек≥лькох крапель розведеного водою досл≥джуваного на на€вн≥сть Fe2+-≥он≥в розчину з рЌ 3-4 додають дек≥лька крапель водного розчину 1,10-фенантрол≥ну (w=0,3%). «Т€вл€Їтьс€ червоно-оранжеве забарвленн€. омплексна сполука ст≥йка прот€гом тривалого часу. Fe3+-≥они не заважають ви€вленню Fe2+-≥он≥в за цим методом. ÷≥Їю реакц≥Їю можна ви€вити 0,05 мг/дм3 йон≥в Fe2+.
4.6.2. –еакц≥њ ви€вленн€ кат≥он≥в Fe3+
√≥дратован≥ йони Fe3+ мають у розведених розчинах жовто-оранжеве забарвленн€, а у концентрованих Ц червоно-буре.
ƒосл≥д 1. ат≥они Fe3+ з розчинами луг≥в або амон≥аку утворюють практично нерозчинний у вод≥ ферум(≤≤≤) г≥дроксид Fe(OH)3 червоно-бурого кольору.
ƒ–(Fe(OH)3)=3,2Ј10Ц40.
‘ерум(≤≤≤) г≥дроксид не маЇ амфотерних властивостей ≥ не розчин€Їтьс€ у надлишку лугу, а також не розчин€Їтьс€ у розчинах солей амон≥ю.
” розчинах кислот Fe(OH)3 розчин€Їтьс€ добре:
Fe(OH)3 + 3ЌCl → FeCl3 + 3H2O;
Fe(OH)3 + 3Ќ+ → Fe3+ + 3H2O.
ƒосл≥д 2. ѕоказовою реакц≥Їю на кат≥они Fe3+ Ї реакц≥€ з кал≥й гексац≥ано(≤≤) фератом K4[Fe(CN)6]. ѕри взаЇмод≥њ йон≥в Fe3+ з цим реагентом утворюЇтьс€ темно-син≥й осад берл≥нськоњ лазур≥ Ц ферум(≤≤≤) гексац≥ано(≤≤) ферату Fe4[Fe(CN)6]3. ÷€ реакц≥€ краще проходить у слабкокислому середовищ≥.
ƒл€ проведенн€ ц≥Їњ реакц≥њ у проб≥рку внос€ть дек≥лька крапель досл≥джуваного на на€вн≥сть Fe3+-≥он≥в розчину, додають дек≥лька крапель дистильованоњ води, 1-2 крапл≥ розчину хлоридноњ кислоти та 2 крапл≥ розчину K4[Fe(CN)6]. ”творюЇтьс€ син≥й осад або синЇ забарвленн€. ÷€ реакц≥€ дуже чутлива. ат≥они Fe2+ та ≥нш≥ не заважають ви€вленню йон≥в Fe3+ за ц≥Їю реакц≥Їю. –озчини луг≥в розкладають берл≥нську лазур. ѕри додаванн≥ надлишку K4[Fe(CN)6] може утворитис€ розчинна форма берл≥нськоњ лазур≥.
ƒосл≥д 3. Ќадзвичайно чутливою ≥ специф≥чною реакц≥Їю на кат≥они Fe3+ Ї њх взаЇмод≥€ з родан≥д-≥онами SCN−:
|
|
|
Fe3+ + 3SCN− → [Fe(SCN)3] або [FeSCN]2+; [Fe(SCN)2]+; [Fe(SCN)6]3Ц.
ѕри цьому утворюютьс€ р≥зн≥ форми ферум(≤≤≤) родан≥д≥в криваво-червоного забарвленн€. –еакц≥ю доц≥льно проводити при рЌ<3 ≥ застосовувати концентрован≥ розчини реагент≥в NH4SCN чи KSCN. ат≥они Fe2+ не заважають переб≥гу даноњ реакц≥њ.
ƒосл≥д 4. —ульфосал≥цилова кислота з кат≥онами Fe3+ утворюЇ розчинну внутр≥шньокомплексну с≥ль, €ка маЇ ф≥олетове забарвленн€:
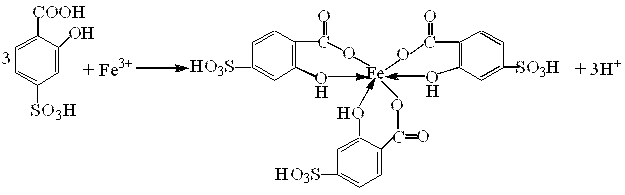 .
.
∆оден з кат≥он≥в вс≥х анал≥тичних груп не заважаЇ ви€вленню йон≥в Fe3+ за ц≥Їю реакц≥Їю. јн≥они F−, –ќ43Ц, лимонноњ, винноњ кислот заважають переб≥гу ц≥Їњ реакц≥њ, руйнують утворений комплекс включаючи ‘ерум або в осад, або в малодисоц≥йовану сполуку, або в ≥нший комплекс.
–еакц≥€ дуже чутлива, дозвол€Ї ви€вл€ти близько 2,5мг/дм3 йон≥в Fe3+.
4.6.3. –еакц≥њ ви€вленн€ кат≥он≥в Mn2+
√≥дратован≥ кат≥они Mn2+ мають бл≥до-рожеве забарвленн€, а в розведених розчинах таке забарвленн€ не спостер≥гаЇтьс€.
ƒосл≥д 1. ѕри взаЇмод≥њ з лугами кат≥они Mn2+ утворюють малорозчинний Mn(OH)2 б≥лого кольору. ƒ–(Mn(OH)2)=4Ј10Ц14. ћанган г≥дроксид не маЇ амфотерних властивостей ≥ в надлишку розчину лугу не розчин€Їтьс€, а в розчинах кислот розчин€Їтьс€ добре:
Mn(OH)2 + 2H+ → Mn2+ + 2H2O.
’≥м≥чний елемент ћанган у сполуках може мати р≥зн≥ ступен≥ окисненн€: 7+, 6+, 4+, 3+, 2+.
ат≥он Mn2+ Ї досить сильним в≥дновником, а тому легко окиснюЇтьс€ переход€чи у б≥льш висок≥ ступен≥ окисненн€.
–≥зн≥ форми ћангану забарвлен≥ у р≥зн≥ кольори:
MnO4Ц та MnO42Ц мають ф≥олетове забарвленн€; MnO2 Ц коричневе.
Ќа пов≥тр≥ б≥лий осад Mn(OH)2 швидко зм≥нюЇ забарвленн€ на жовто-буре, а пот≥м на коричневе за рахунок окисненн€ ћангану з≥ ступенем окисненн€ 2+ у ћанган з≥ ступенем окисненн€ ћангану 4+ у форм≥ MnO(OH)2↓ або H2MnO3.
–еакц≥€ Mn2+ + 2OH− → Mn(OH)2 проводитьс€ при рЌ=9-10.
ƒосл≥д 2. ѕри додаванн≥ до розчину, що м≥стить йони Mn2+, розчину амон≥аку теж випадаЇ б≥лий осад Mn(OH)2. ” присутност≥ сол≥ амон≥ю осадженн€ не в≥дбуваЇтьс€. Mn(OH)2 на в≥дм≥ну в≥д MnO(OH)2 розчин€Їтьс€ у розведен≥й сульфатн≥й кислот≥, а також в надлишку розчину амон≥аку особливо за на€вност≥ солей амон≥ю.
–еакц≥€ проводитьс€ при рЌ=9-10.
Mn2+ + 2NH3ЈH2O → Mn(OH)2 + 2NH4+.
” присутност≥ солей амон≥ю в≥дбуваЇтьс€ пригн≥ченн€ дисоц≥ац≥њ NH3ЈH2O 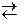 NH4++ќЌ− внасл≥док чого концентрац≥€ ќЌ−-≥он≥в наст≥льки знижуЇтьс€, що фактичний добуток р≥вноважних концентрац≥й йон≥в ќЌ− та Mn2+ не може перевищити ƒ–(Mn(OH)2). « часом з амон≥ачного розчину, що м≥стить кат≥они Mn2+ та NH4+, внасл≥док окисненн€ Mn2+ випадаЇ осад H2MnO3.
NH4++ќЌ− внасл≥док чого концентрац≥€ ќЌ−-≥он≥в наст≥льки знижуЇтьс€, що фактичний добуток р≥вноважних концентрац≥й йон≥в ќЌ− та Mn2+ не може перевищити ƒ–(Mn(OH)2). « часом з амон≥ачного розчину, що м≥стить кат≥они Mn2+ та NH4+, внасл≥док окисненн€ Mn2+ випадаЇ осад H2MnO3.
ƒосл≥д 3. —пециф≥чною реакц≥Їю на кат≥они Mn2+, що дозвол€Ї ви€вити цей кат≥он у присутност≥ кат≥он≥в вс≥х анал≥тичних груп, Ї реакц≥€ окисненн€ Mn2+ в ан≥он MnO4−.
як окисник у ц≥й реакц≥њ можна застосувати плюмбум диоксид PbO2, амон≥й персульфат (NH4)2S2O8 та ≥нш≥ окисники з≥ значенн€ми величин окисно-в≥дновних потенц≥ал≥в б≥льше +1,52¬, оск≥льки
≈ºMnO4Ц/Mn2+ = +1,52¬.
≈ºPbO2/Pb2+ = +1,68¬; ≈ºS2O82−/2SO42Ц = +2,01¬.
ƒл€ проведенн€ реакц≥њ окисненн€ Mn2+ за участ≥ PbO2 у проб≥рку внос€ть невелику к≥льк≥сть порошку PbO2, додають дек≥лька крапель розчину н≥тратноњ кислоти, нагр≥вають. якщо розчин п≥сл€ цього не набуде забарвленн€, то тод≥ до нього додають краплю розведеного приблизно в дес€ть раз≥в досл≥джуваного на кат≥они Mn2+ розчину та розм≥шують його. «а на€вност≥ у розчин≥ кат≥он≥в Mn2+ зТ€вл€Їтьс€ рожеве забарвленн€ за рахунок MnO4−:
Mn2+ + 3PbO2 + 4H+ → MnO4− + 3Pb2+ + 2H2O.
÷€ реакц≥€ повинна проводитись при рЌ<2. ƒл€ досл≥дженн€ не можна брати с≥ль MnCl2, оск≥льки за даних умов будуть окиснюватись йони Cl− до в≥льного хлору:
|
|
|
2Cl− + PbO2 + 4H+ → Cl2 + Pb2+ + 2H2O.
јн≥они-в≥дновники, €кщо вони Ї в досл≥джуваному розчин≥, будуть заважати окисненню Mn2+ у MnO4−, тому њх попередньо сл≥д видалити з розчину. –еакц≥ю краще проводити при пом≥рному нагр≥ванн≥.
” ≥нш≥й реакц≥њ окисненн€ Mn2+ до MnO4− можна застосувати окисник амон≥й персульфат у присутност≥ €к катал≥затора AgNO3:
2Mn2+ + 5S2O82Ц + 8H2O → 2MnO4− + 10SO42Ц + 16H+.
ƒл€ проведенн€ ц≥Їњ реакц≥њ у проб≥рку внос€ть трохи кристал≥чного амон≥й персульфату, додають близько 10 крапель розчину н≥тратноњ кислоти (с(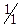 HNO3)=2,0моль/дм3), 2 крапл≥ розчину AgNO3 та нагр≥вають. ” нагр≥ту сум≥ш занурюють скл€ну паличку, змочену досл≥джуваним на кат≥они Mn2+ розчином та перем≥шують. якщо забарвленн€, що виникло, слабке, то можна ще додати досл≥джуваного розчину. якщо ж, навпаки, випадаЇ бурий осад MnO(OH)2, то концентрац≥€ кат≥он≥в Mn2+ була великою. ат≥он Mn2+ при цьому окиснюЇтьс€ до MnO4− рожевого забарвленн€ у вигл€д≥ мангановоњ кислоти HMnO4.
HNO3)=2,0моль/дм3), 2 крапл≥ розчину AgNO3 та нагр≥вають. ” нагр≥ту сум≥ш занурюють скл€ну паличку, змочену досл≥джуваним на кат≥они Mn2+ розчином та перем≥шують. якщо забарвленн€, що виникло, слабке, то можна ще додати досл≥джуваного розчину. якщо ж, навпаки, випадаЇ бурий осад MnO(OH)2, то концентрац≥€ кат≥он≥в Mn2+ була великою. ат≥он Mn2+ при цьому окиснюЇтьс€ до MnO4− рожевого забарвленн€ у вигл€д≥ мангановоњ кислоти HMnO4.
÷ю реакц≥ю сл≥д проводити у сильнокислому середовищ≥ при рЌ<2. онцентрац≥€ йон≥в Mn2+ у досл≥джуваному розчин≥ повинна бути м≥н≥мальною. ¬≥дновники Cl−, Br−, I− та ≥нш≥ заважають переб≥гу ц≥Їњ реакц≥њ.
ƒосл≥д 4. ћенш характерною реакц≥Їю ви€вленн€ кат≥он≥в Mn2+ Ї њх окисненн€ до MnO2 у лужному середовищ≥.
ƒо окремоњ проби досл≥джуваного розчину додають розчин лугу. ѕри цьому вс≥ кат≥они пТ€тоњ анал≥тичноњ групи випадають в осад у вигл€д≥ г≥дроксид≥в, €к≥ мають б≥лий кол≥р − (Bi(OH)3, Mg(OH)2, Sb(OH)3) або ж буре забарвленн€ − (Fe(OH)3). якщо до отриманого осаду г≥дроксид≥в додати дек≥лька крапель розчин≥в H2O2, KClO3, бромноњ або хлорноњ води ≥ нагр≥ти до кип≥нн€, то за на€вност≥ Mn(OH)2 осад набуде майже чорного забарвленн€ внасл≥док окисненн€ Mn(OH)2 до MnO2. ¬и€вленню кат≥он≥в Mn2+ за ц≥Їю реакц≥Їю серед кат≥он≥в пТ€тоњ анал≥тичноњ групи заважають т≥льки кат≥они Fe2+ та Fe3+. « кат≥он≥в ≥нших анал≥тичних груп заважають такому ви€вленню йон≥в Mn2+ кат≥они Cu2+, Co2+, Ni2+, Hg2+, Hg22+, Ag+, €к≥ утворюють у лужному середовищ≥ чорн≥ або кольоров≥ осади.
ƒосл≥д 5. …они гексац≥ано(≤≤) ферату [Fe(CN)6]4Ц з кат≥онами Mn2+ утворюють б≥лий малорозчинний у розведених кислотах осад манган гексац≥ано(≤≤) ферату:
2Mn2+ + [Fe(CN)6]4Ц → Mn2[Fe(CN)6]↓.
÷ей осад п≥д д≥Їю лугу розкладаЇтьс€ з утворенн€м Mn(OH)2:
Mn2[Fe(CN)6]↓ + 4ќЌ− → 2Mn(OH)2 + [Fe(CN)6]4Ц.
”творений Mn(OH)2 окиснюЇтьс€ киснем пов≥тр€ до кислоти H2MnO3.
ƒосл≥д 6. ат≥они Mn2+ можна ви€вити механох≥м≥чним способом.
” заглибленн€ порцел€новоњ пластинки вм≥щують крупинку сол≥ ћангану, додають 1-2 кристали AgNO3 ≥ сум≥ш розтирають маленьким товкачиком. ѕот≥м додають краплю розведеного розчину амон≥аку. ¬≥дбуваЇтьс€ миттЇве почорн≥нн€ реакц≥йноњ сум≥ш≥ внасл≥док в≥дновленн€ йон≥в Ag+ до метал≥чного ср≥бла ≥ окисненн€ йон≥в Mn2+ до H2MnO3:
Mn2+ + 2Ag+ + 4NH4OH → 2Ag↓ + H2MnO3↓ + 4NH4+ + H2O
Mn(OH)2 також реагуЇ з AgNO3:
Mn(OH)2↓ + 2AgNO3 +2NH4OH → H2MnO3 + 2Ag↓ + 2NH4NO3 + H2O.
ƒосл≥д 7. ѕри взаЇмод≥њ йон≥в Mn2+ з йонами [Fe(CN)6]3Ц утворюЇтьс€ бурий осад:
3Mn2+ + 2[Fe(CN)6]3Ц → Mn3[Fe(CN)6]2↓.
ƒосл≥д 8. « карбонат-≥онами йони Mn2+ утворюють б≥лий осад манган карбонату:
Mn2+ + CO32− → MnCO3.
4.6.4. –еакц≥њ ви€вленн€ кат≥он≥в Bi3+
ƒосл≥д 1. —ол≥ Ѕ≥смуту сильно г≥дрол≥зуютьс€ за кат≥оном Bi3+ з утворенн€м малорозчинних основних солей:
BiCl3 + 2H2O 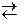 Bi(OH)2Cl↓ + 2HCl.
Bi(OH)2Cl↓ + 2HCl.
”творений б≥смут диг≥дроксохлорид Bi(OH)2Cl не ст≥йкий, втрачаЇ молекулу води, перетворюючись на б≥смутил хлорид:
Bi(OH)2Cl → BiOCl↓ + Ќ2ќ.
¬насл≥док таких властивостей солей Ѕ≥смуту у розчинах завжди Ї б≥лий осад б≥смутил≥в. « них BiOCl менш розчинний, н≥ж BiONO3.
ѕеред досл≥дженн€м розчин≥в на вм≥ст кат≥он≥в ¬≥3+ до б≥лоњ суспенз≥њ б≥смутит≥в сл≥д додати концентрован≥ розчини хлоридноњ чи н≥тратноњ кислоти до повного розчиненн€ осаду:
BiOCl + 3HNO3 → Bi(NO3)3 + HCl + H2O;
BiOCl + 2H+ → Bi3+ + Cl− + H2O;
—ол≥ —тиб≥ю заважають проведенню реакц≥й г≥дрол≥зу солей Ѕ≥смуту, оск≥льки теж утворюють малорозчинн≥ стиб≥ли (наприклад SbOCl). ѕроте, стиб≥л хлорид SbOCl розчинний у винн≥й кислот≥, а BiOCl Ц нерозчинний.
ƒосл≥д 2. ѕри д≥њ на розчин, що м≥стить кат≥они Bi3+, розчинами луг≥в NaOH або KOH утворюЇтьс€ б≥лий осад б≥смут г≥дроксиду:
Bi3+ + 3OH− → Bi(OH)3↓,
€кий розчинний у кислотах, але нерозчинний у розчинах луг≥в, оск≥льки Bi(OH)3 амфотерних властивостей не маЇ. ѕри нагр≥ванн≥ Bi(OH)3 переходить у нерозчинний б≥смутил г≥дроксид BiOOH.
|
|
|
ƒосл≥д 3. як кат≥они Sn2+ можна ви€вити у лужному середовищ≥ за участ≥ кат≥он≥в Bi3+, так ≥, навпаки, йони Bi3+ можна ви€вити шл€хом њх в≥дновленн€ до метал≥чного б≥смуту йонами SnO22Ц:
Sn2+ + 2OH− → Sn(OH)2↓;
Sn(OH)2 + 2OH− → SnO22Ц + 2H2O;
Bi3+ + 3OH− → Bi(OH)3↓;
2Bi(OH)3 + 3SnO22Ц → 3SnO32Ц + 2Bi↓ + 3H2O.
¬ипадаЇ чорний осад метал≥чного б≥смуту.
ѕри проведенн≥ ц≥Їњ реакц≥њ застосовуЇтьс€ св≥жоприготовлений розчин SnCl2 у хлоридн≥й кислот≥ з гранулами метал≥чного Sn на дн≥ посудини. Ќе сл≥д брати великого надлишку лугу. ѕроведенню ц≥Їњ реакц≥њ заважають кат≥они, €к≥ у лужному середовищ≥ утворюють нерозчинн≥ сполуки або створюють €кесь ≥нше забарвленн€, особливо с≥ре або чорне (Ag2O, Hg2O, Fe(OH)3).
ƒосл≥д 4. ат≥они Bi3+ можна ви€вити м≥крокристалоскоп≥чною реакц≥Їю утворенн€ кристал≥в комплексних сполук Ѕ≥смуту.
ƒл€ проведенн€ ц≥Їњ реакц≥њ до краплини кислого розчину, що м≥стить кат≥они Bi3+, додають крупинку кристал≥чного KI та RbCl або —sCl. ”творюютьс€ червон≥ шестикутн≥ кристали комплексноњ сол≥ руб≥д≥й пента≥одо(≤≤≤) б≥смутату Rb2[BiI5]Ј2,5Ќ2ќ або цез≥й пента≥одо(≤≤≤) б≥смутату Cs2[BiI5]Ј2,5Ќ2ќ, €к≥ розгл€дають п≥д м≥кроскопом.
–ис. Е ристали цез≥й пента≥одо(III) б≥смутату
јналог≥чн≥ кристали утворюють кат≥они Sb3+. «начн≥ к≥лькост≥ кат≥он≥в Sn2+ та Pb2+ заважають ви€вленню кат≥он≥в Bi3+ за ц≥Їю реакц≥Їю.
ƒосл≥д 5. ат≥они Bi3+ можна також в≥дновити метал≥чними алюм≥н≥Їм, цинком, зал≥зом. ƒл€ цього беруть пластинки з цих метал≥в, очищають поверхню в≥д бруду та оксид≥в ≥ на очищене м≥сце нанос€ть дек≥лька крапель п≥дкисненого хлоридною кислотою досл≥джуваного розчину. «а на€вност≥ у розчин≥ кат≥он≥в Bi3+ через дек≥лька хвилин п≥д крапл€ми зТ€вл€ютьс€ чорн≥ пл€ми в≥дновленого б≥смуту:
3Fe + 2Bi3+ → 2Bi↓ + 3Fe2+.
÷≥й реакц≥њ заважають т≥льки кат≥они Sb3+ та Hg2+.
ƒосл≥д 6. ѕри д≥њ на розчини, що м≥ст€ть кат≥они Bi3+, невеликоњ к≥лькост≥ розчину ≤ утворюЇтьс€ чорний осад BiI3:
Bi3+ + 3I− → BiI3↓.
ѕри ви€вленн≥ кат≥он≥в Bi3+ за ц≥Їю реакц≥Їю сл≥д уникати надлишку ≤.
ѕри надлишку ≤ розчин набуваЇ червонувато-жовтого забарвленн€ внасл≥док утворенн€ комплексноњ сол≥ [BiI4]:
Bi3+ + 3 ≤ → BiI3↓ + 3 +;
BiI3↓+ KI → [BiI4].
« кат≥он≥в пТ€тоњ анал≥тичноњ групи ви€вленню кат≥он≥в Bi3+ кал≥й йодидом заважають Sb5+ та Fe3+, оск≥льки вони окиснюють йодид-≥они до ≤2, внасл≥док чого розчин буде забарвлюватись у червоно-коричневий кол≥р. ѕроте, кат≥они Fe3+ з розчину можна видалити в≥дновивши њх до Fe2+ щавлевою кислотою, а кат≥они Sb5+ Ц шл€хом г≥дрол≥зу њх з розчину н≥тратноњ кислоти. « кат≥он≥в ≥нших анал≥тичних груп ви€вленню кат≥он≥в Bi3+ за ц≥Їю реакц≥Їю заважають кат≥они Ag+, Pb2+, Cu2+, Hg2+.
ƒосл≥д 7. –еакц≥ю на кат≥они Bi3+ з кал≥й йодидом доц≥льно проводити крапельним методом у присутност≥ цинхон≥ну, оск≥льки при цьому утворюЇтьс€ оранжевий осад комплексноњ сол≥ BiI3[C19H22ON2]ЈHI, €ка у надлишку розчину ≤ нерозчинна.
ƒл€ ви€вленн€ кат≥он≥в Bi3+ за ц≥Їю реакц≥Їю на ф≥льтрувальний пап≥р нанос€ть краплю досл≥джуваного розчину, п≥дкисненого хлоридною кислотою, ≥ на нењ Ц краплю реактиву. ѕри цьому за на€вност≥ у розчин≥ кат≥он≥в Bi3+ на папер≥ утворюЇтьс€ оранжева пл€ма. ƒл€ приготуванн€ реактиву цинхон≥ну у 100г гар€чоњ води розчин€ють 1г цинхон≥ну, додають 5-10 крапель концентрованоњ н≥тратноњ кислоти. ѕ≥сл€ охолодженн€ до цього розчину додають 2г ≤.
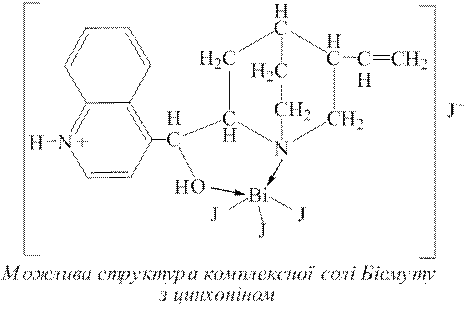
≤нш≥ кат≥они пТ€тоњ анал≥тичноњ групи не заважають ви€вленню кат≥он≥в Bi3+ за ц≥Їю реакц≥Їю. « кат≥он≥в ≥нших анал≥тичних груп заважають ви€вленню за ц≥Їю реакц≥Їю т≥льки кат≥они Hg22+, €к≥ з цим реактивом утворюють сполуку, що маЇ буре забарвленн€. ѕри пор≥вн€но високих концентрац≥€х з цим реактивом йони Ag+, Hg2+, Pb2+, Sb3+ утворюють жовт≥ пл€ми. ѕри високих концентрац≥€х йони Co2+, Ni2+, Cr3+ заважають проведенню ц≥Їњ реакц≥њ власним забарвленн€м.
ƒосл≥д 7. ƒл€ ви€вленн€ кат≥он≥в Bi3+ за реакц≥Їю з т≥осечовиною або родан≥д-≥онами у заглибленн€ порцел€новоњ пластинки внос€ть краплю досл≥джуваного розчину, п≥дкисненого хлоридною кислотою, ≥ сюди ж внос€ть кристалик т≥осечовини або кал≥й родан≥ду чи амон≥й родан≥ду. «а на€вност≥ у розчин≥ кат≥он≥в Bi3+ пл€ма набуваЇ характерного жовтого або червоно-бурого забарвленн€ в≥дпов≥дно Ц утворенн€ комплексного йона [Bi(SCN)4]Ц
| або, в≥дпов≥дно, | 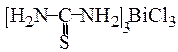
| . ÷≥й реакц≥њ ви€вленн€ |
кат≥он≥в Bi3+ pа участ≥ йон≥в SCNЦ заважають кат≥они Fe3+, €к≥ з йонами SCN− утворюють комплекси, що мають криваво-червоне забарвленн€; кат≥они Cu2+, €к≥ утворюють з йонами SCN− сполуки рожевого забарвленн€, а при висиханн≥ Ц синЇ забарвленн€. «а на€вност≥ кат≥он≥в Hg2+ утворюЇтьс€ чорний осад. « т≥осечовиною ц≥й реакц≥њ заважають кат≥они Sb3+, Sb5+, €к≥ дають той же ефект, що ≥ кат≥они Bi3+, а кат≥они Cu2+, Co2+, Ni2+, Cr3+ маскують своњм забарвленн€м кол≥р комплексного йона Ѕ≥смуту.
ƒосл≥д 8. ѕри взаЇмод≥њ кат≥он≥в Bi3+ з H2S або Na2S2O3 у розчин≥ хлоридноњ кислоти утворюЇтьс€ чорний осад Bi2S3:
2 Bi3+ + 3H2S → Bi2S3↓ + 6Ќ+;
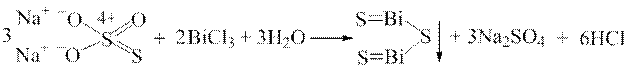
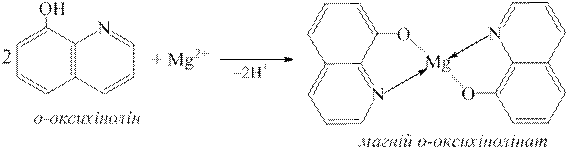
4.6.5. –еакц≥њ ви€вленн€ кат≥он≥в Mg2+
ƒосл≥д 1. ѕри додаванн≥ до розчину, що м≥стить кат≥они Mg2+, розчину луг≥в NaOH, KOH утворюЇтьс€ б≥лий аморфний осад магн≥й г≥дроксиду, €кий розчин€Їтьс€ у розчинах кислот ≥ солей амон≥ю:
Mg2+ + 2OH− → Mg(OH)2↓;
Mg(OH)2 + 2H+ → Mg2+ + 2H2O.
Mg2+ + 2NH4OH → Mg(OH)2↓ + 2NH4+;
Mg(OH)2 + 2NH4+ → Mg2+ + 2NH4OH.
з сол≥
амон≥ю
ƒосл≥д 2. Ќатр≥й г≥дрофосфат Na2HPO4 з кат≥онами Mg2+ у присутност≥ амон≥й хлориду та амон≥й г≥дроксиду утворюЇ б≥лий кристал≥чний осад магн≥й-амон≥й фосфату:
Mg2+ + HPO42Ц + NH4OH → MgNH4PO4 + H2O.
јмон≥й хлорид додають дл€ того, щоб не випав осад Mg(OH)2.
ƒл€ проведенн€ ц≥Їњ реакц≥њ у проб≥рку внос€ть 3-4 крапл≥ розчину сол≥ магн≥ю, додають 4-6 крапель розчину хлоридноњ кислоти (с(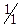 HCl)=2,0моль/дм3) та краплинами розчин Na2HPO4. ѕ≥сл€ цього додають до розчину по одн≥й краплин≥ розчину амон≥аку (с=2,0моль/дм3), перем≥шуючи розчин п≥сл€ кожноњ крапл≥. —початку розчин амон≥аку нейтрал≥зуЇ хлоридну кислоту:
HCl)=2,0моль/дм3) та краплинами розчин Na2HPO4. ѕ≥сл€ цього додають до розчину по одн≥й краплин≥ розчину амон≥аку (с=2,0моль/дм3), перем≥шуючи розчин п≥сл€ кожноњ крапл≥. —початку розчин амон≥аку нейтрал≥зуЇ хлоридну кислоту:
HCl + NH4OH → NH4Cl + H2O.
јмон≥й хлорид перешкоджаЇ утворенню при цьому осаду Mg(OH)2. ¬ипадаЇ характерний кристал≥чний осад MgNH4PO4.
ƒану реакц≥ю сл≥д проводити в амон≥ачному середовищ≥ при рЌ=8. Ќадлишок йон≥в NH4+ заважаЇ випад≥нню осаду MgNH4PO4. Ѕ≥льш≥сть кат≥он≥в, за вин€тком Na+, K+, заважають проведенню ц≥Їњ реакц≥њ.
ƒосл≥д 3. ат≥они Mg2+ можна ви€вити також м≥крокристалоскоп≥чною реакц≥Їю.
раплю розчину, що м≥стить йони Mg2+, нанос€ть на предметне скло м≥кроскопа, додають краплю розчину амон≥аку (w=25%), пот≥м у краплю внос€ть кристалик Na2HPO4 ≥ розгл€дають утворен≥ кристали MgNH4PO4 п≥д м≥кроскопом.
–ис. Е ристали магн≥й-амон≥й фосфату
ƒосл≥д 4. јзобарвники Ц n-н≥трофен≥лазорезорцин
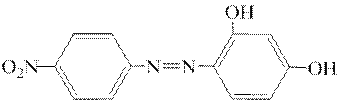
та n-н≥трофен≥лазо-α-нафтол
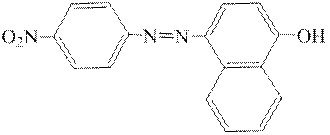
у лужному середовищ≥ мають червоний або червоно-ф≥олетовий кол≥р. јрсорбуючись на поверхн≥ Mg(OH)2, вони забарвлюють б≥лий осад Mg(OH)2.
ƒл€ проведенн€ ц≥Їњ реакц≥њ на порцел€нову пластинку нанос€ть 1-2 крапл≥ розчину, що м≥стить йони Mg2+, та додають 1-2 крапл≥ лужного розчину реактиву. «Т€вл€Їтьс€ синЇ забарвленн€ або син≥й осад. якщо розчин маЇ рЌ<10, то може зТ€витись жовте забарвленн€.
÷€ реакц≥€ заснована на властивост≥ Mg(OH)2 адсорбувати де€к≥ барвники.
—ол≥ амон≥ю заважають переб≥гу ц≥Їњ реакц≥њ.
ƒосл≥д 5. ат≥они Mg2+ з оксих≥нол≥ном утворюють кристал≥чний осад магн≥й оксих≥нол≥нату, €кий маЇ зеленувато-жовте забарвленн€:
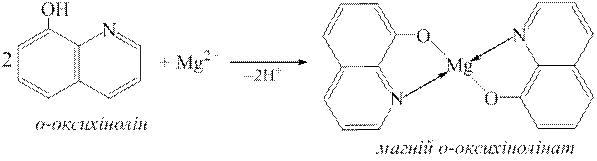
ƒл€ осадженн€ магн≥й оксих≥нол≥нату необх≥дне слабколужне середовище. ƒл€ цього до розчину додаЇтьс€ водний розчин амон≥аку.
ƒо дек≥лькох крапель досл≥джуваного на Mg2+-≥они розчину додають ст≥льки ж розчину амон≥аку, пот≥м розчин NH4Cl до повного розчиненн€ осаду Mg(OH)2 та дек≥лька крапель розчину оксих≥нол≥ну. « розчину випадаЇ кристал≥чний зеленувато-жовтий осад Mg(C9H6NO)2.
ƒосл≥д 6. ѕри взаЇмод≥њ кат≥он≥в Mg2+ з Na2CO3 або 2CO3 випадаЇ б≥лий осад основноњ сол≥:
2Mg2+ +2CO32Ц + Ќ2ќ→ Mg2(OH)2CO3↓ + CO2↑.
”творений осад легко розчин€Їтьс€ €к в кислотах, так ≥ в сол€х амон≥ю, тому амон≥й карбонат не даЇ повного осадженн€ через зм≥щенн€ р≥вноваги реакц≥њ у м≥ру накопиченн€ йон≥в NH4+ л≥воруч:
2MgCl2 + 2(NH4)2CO3 + H2O  (MgOH)2CO3↓ + 4NH4Cl + CO2↑.
(MgOH)2CO3↓ + 4NH4Cl + CO2↑.
якщо попередньо до розчину сол≥ ћагн≥ю додати с≥ль амон≥ю, то основного магн≥й карбонату не випадаЇ при додаванн≥ розчину (NH4)2CO3.
4.6.6. –еакц≥њ ви€вленн€ кат≥он≥в Sb3+
ƒосл≥д 1. як вже зазначалось, сол≥ Sb3+ г≥дрол≥зуютьс€ в б≥льш≥й м≥р≥, н≥ж сол≥ Bi3+:
SbCl3 + H2O 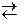 SbOCl↓ + 2HCl,
SbOCl↓ + 2HCl,
тому водн≥ розчини солей —тиб≥ю €вл€ють собою суспенз≥ю стиб≥л≥в або антимон≥л≥в.
ƒл€ проведенн€ ц≥Їњ реакц≥њ г≥дрол≥зу дек≥лька крапель розчину SbCl3 розвод€ть водою. ¬ипадаЇ б≥лий осад стиб≥л хлориду. «наченн€ рЌ середовища при цьому повинно бути не менше 3-4. ѕри нижчому значенн≥ рЌ осад може не утворитись. –еакц≥ю доц≥льно проводити при нагр≥ванн≥. «а на€вност≥ у розчин≥ винноњ кислоти осад не утворюЇтьс€.
« кат≥он≥в пТ€тоњ анал≥тичноњ групи г≥дрол≥зу Sb3+ заважають т≥льки кат≥они Bi3+, €к≥ теж г≥дрол≥зуютьс€ з утворенн€м осад≥в б≥смутил хлориду BiOCl або б≥смутил н≥трату BiONO3. јле €кщо г≥дрол≥з йон≥в проводити у присутност≥ н≥тратноњ кислоти, то йони Bi3+ при цьому не г≥дрол≥зуютьс€, а йони Sb3+ г≥дрол≥зуютьс€. ƒл€ цього до розчину, що м≥стить кат≥они Sb3+ та Bi3+, додають спочатку такий же обТЇм розчину HNO3, а пот≥м 2-3-кратний обТЇм води. ѕри цьому вже на холод≥ випадаЇ осад SbOCl. ѕри нагр≥ванн≥ з надлишком хлоридноњ кислоти осад SbOCl розчин€Їтьс€.
ƒосл≥д 2. ат≥они Sb3+ з т≥осульфат-≥онами при нагр≥ванн≥ утворюють осад Sb2OS2 червоного кольору:
2Sb3+ + 2S2O32Ц + 3Ќ2ќ → Sb2OS2↓ + 2SO42Ц + 6H+.
«а на€вност≥ у розчин≥ йон≥в Bi3+ випадаЇ чорний осад Bi2S3, що маскуЇ червоне забарвленн€ Sb2OS2.
ƒл€ проведенн€ ц≥Їњ реакц≥њ у проб≥рку внос€ть 2-3 крапл≥ розчину SbCl3, додають краплю сульфатноњ кислоти та 5-6 крапель води, внос€ть кристалик Na2S2O3 ≥ нагр≥вають. ¬ипадаЇ червоний осад Sb2OS2. —л≥д мати на уваз≥, що надлишок сульфатноњ кислоти розкладаЇ натр≥й т≥осульфат:
Na2S2O3 +Ќ2SO4 → Na2SO4 + SO2↑+ S↓ + H2O.
ѕереб≥гу даноњ реакц≥њ заважають кат≥они Cu2+, Hg2+ та ≥н., €к≥ утворюють малорозчинн≥ сульф≥ди.
ƒосл≥д 3. ћожливою, але не дуже показовою реакц≥Їю ви€вленн€ кат≥он≥в Sb3+ може бути реакц≥€ в≥дновленн€ Sb3+ до метал≥чного стиб≥ю металами, €к≥ електрох≥м≥чно б≥льш активн≥, н≥ж —тиб≥й.
Ќаприклад: 3Zn + 2SbCl3 → 2Sb↓ + 3ZnCl2.
Ќа добре очищену металеву пластинку (цинкову, алюм≥н≥Їву, зал≥зну та ≥н.) нанос€ть краплю п≥дкисненого хлоридною кислотою досл≥джуваного розчину. „ерез де€кий час поверхн€ пластини п≥д краплею стаЇ чорною в≥д метал≥чного стиб≥ю.
÷ю реакц≥ю необх≥дно проводити у сильнокислому середовищ≥ при рЌ=1-2.
ƒосл≥джуваний розчин не повинен м≥стити сильних окисник≥в.
ƒосл≥д 4. ѕри д≥њ на розчин солей Sb3+ розчинами луг≥в випадаЇ б≥лий осад стиб≥й(≤≤≤) г≥дроксиду:
Sb3+ + 3ќЌ− → 2Sb(ќЌ)3↓.
ќсад Sb(ќЌ)3 маЇ амфотерн≥ властивост≥ ≥ тому розчин€Їтьс€ €к в надлишку кислоти:
Sb(ќЌ)3 + 3Ќ+ → Sb3+ + 3Ќ2ќ.
так ≥ в надлишку розчину лугу; при цьому утворюютьс€ сол≥ метастиб≥йнистоњ кислоти:
Ќ3Sbќ3↓ → ЌSbќ2↓ + Ќ2ќ.
ортостиб≥йниста метастиб≥йниста
кислота кислота
ЌSbќ2↓ + NaOH → NaSbO2 + H2O.
ƒосл≥д 5. –озчин амон≥аку осаджуЇ кат≥они Sb3+ у вигл€д≥ метастиб≥йноњ кислоти, практично нерозчинн≥й у надлишку розчину амон≥аку:
Sb3+ + 3NH3ЈH2ќ → Ќ3Sbќ3↓+ 3NH4+;
Ќ3Sbќ3↓ → ЌSbќ2↓ + Ќ2ќ.
ƒосл≥д 6. ѕри д≥њ Ќ2S на п≥дкиснен≥ хлоридною кислотою розчини солей Sb3+ утворюЇтьс€ €скраво оранжевий осад стиб≥й(≤≤≤) сульф≥ду:
2SbCl3 + 3Ќ2S → Sb2S3↓ + 6HCl.
ќсад Sb2S3 розчин€Їтьс€ при нагр≥ванн≥ в розчин≥ хлоридноњ кислоти (1:1):
Sb2S3 + 12HCl → 2H3[SbCl6] + 3H2S↑.
ƒ≥Їю н≥тратноњ кислоти на Sb2S3 утворюЇтьс€ б≥лий малорозчинний осад метастиб≥йноњ кислоти:
3Sb2S3 + 10HNO3 → 6HSbO3↓ + 9S↓ + 10NO↑ + 2H2O.
—тиб≥й(≤≤≤) сульф≥д, п≥д д≥Їю розчину Na2S або розчину лугу розчин€Їтьс€ з утворенн€м т≥осол≥ або сум≥ш≥ т≥осол≥ та сол≥ в≥дпов≥дноњ оксигеновм≥сноњ кислоти:
Sb2S3 + 3Na2S → 2Na3SbS3;
Sb2S3 + 6NaOH → Na3SbS3 + Na3Sbќ3 + 3H2O.
Ќа в≥дм≥ну в≥д As2S3, As2S5, стиб≥й(≤≤≤) сульф≥д не розчин€Їтьс€ повн≥стю п≥д д≥Їю (NH4)2CO3 або NH4OH, але де€ка його частина переходить у розчин при д≥њ цих реагент≥в у вигл€д≥ в≥дпов≥дних т≥осолей. “≥осол≥ Sb3+ легко розкладаютьс€ кислотами з утворенн€м в≥льних т≥окислот, €к≥ дуже нест≥йк≥ ≥ розкладаютьс€ з утворенн€м Sb2S3 та H2S.
ƒосл≥д 7. ѕри д≥њ метал≥чного цинку на достатньо кисл≥ розчини солей Sb3+ в≥дбуваЇтьс€ в≥дновленн€ Sb3+ до метал≥чного стиб≥ю, а також вид≥л€Їтьс€ SbH3 Ц газ без кольору та запаху:
Zn + 2Sb3+ + 3H+ → Zn2+ + Sb↓ + SbH3.
” сполуц≥ SbH3 ступ≥нь окисненн€ —тиб≥ю дор≥внюЇ 3Ц. SbH3 Ц сильний в≥дновник ≥ легко в≥дновлюЇ йони важких метал≥в, наприклад Ag+, до метал≥чного стану.
4.6.7. –еакц≥њ ви€вленн€ —тиб≥ю з≥ ступенем окисненн€ 5+
—тиб≥й з≥ ступенем окисненн€ 5+ входить до складу комплексного ан≥она [SbCl6]Ц при взаЇмод≥њ HSbO3 з HCl:
HSbO3 + 6HCl → Ќ[SbCl6] + 3Ќ2ќ.
ƒосл≥д 1. ” лужному середовищ≥ за участ≥ NaOH, KOH або NH3ЈH2O комплексний ан≥он [SbCl6]Ц перетворюЇтьс€ на б≥лий осад метастиб≥йноњ кислоти HSbO3:
[SbCl6]− + 5ќЌ− → HSbO3↓ + 6—l− + 2Ќ2ќ.
ƒосл≥д 2. —ол≥ SbV г≥дрол≥зуютьс€ з утворенн€м б≥лого осаду основноњ сол≥:
[SbCl6]− + 2Ќ2ќ → SbO2—l↓ + 5ClЦ + 4Ќ+.
якщо реакц≥йну сум≥ш п≥д≥гр≥ти, то реакц≥€ йде до утворенн€ ортостиб≥йноњ кислоти H3SbO4 або SbO(ќH)3:
SbO2Cl + 2Ќ2ќ → H3SbO4↓ + ЌCl.
ќсад H3SbO4 розчин€Їтьс€ при д≥њ розчин≥в кислоти або лугу:
SbO(ќH)3 + 5HCl → SbCl5 + 4H2O;
H3SbO4 + 3NaOH → Na3SbO4 + 3H2O.
ќдержана в результат≥ ц≥Їњ реакц≥њ с≥ль ортостиб≥йноњ кислоти легко г≥дрол≥зуЇтьс€, утворюючи нормальну або кислу сол≥ п≥ростиб≥йноњ кислоти:
2 3SbO4 + H2O → 2KOH + K4Sb2O7;
K4Sb2O7 + 2H2O → 2KOH + K2Ќ2Sb2O7.
ƒосл≥д 3. ѕри д≥њ розчину амон≥аку на сол≥ Sb5+ утворюЇтьс€ б≥лий аморфний осад метастиб≥йноњ кислоти.
ƒосл≥д 4. ѕри взаЇмод≥њ солей Me3SbO4 з г≥дроген сульф≥дом у пом≥рно кислих розчинах утворюЇтьс€ оранжево-червоний осад Sb2S5. —тиб≥й(V) сульф≥д розчин€Їтьс€ при взаЇмод≥њ з Na2S з утворенн€м т≥осол≥ метастиб≥йноњ кислоти:
Sb2S5 + 3Na2S → 2Na3SbS4,
а при взаЇмод≥њ з розчином лугу Ц сум≥ш≥ т≥осол≥ з т≥окислотою:
Sb2S5 + 6NaќЌ → Na3SbS4 + Na3Sbќ3S + 3Ќ2ќ.
“≥осол≥ SbV легко руйнуютьс€ кислотами з утворенн€м Sb2S5. —тиб≥й(V) сульф≥д легко розчин€Їтьс€ в концентрован≥й хлоридн≥й кислот≥ при нагр≥ванн≥. ” ц≥й реакц≥њ окисником виступаЇ Sb5+, а в≥дновником Ц S2Ц. ќтже, ц€ реакц≥€ Ї реакц≥ю самоокисненн€-самов≥дновленн€:
Sb2S5 + 12HCl → 2H3[SbCl6] + 3H2S + 2S↓.
ƒосл≥д 5. ћетал≥чн≥ Zn, Al, Sn ≥ ≥нш≥ у кислому середовищ≥ в≥дновлюють Sb5+ до метал≥чного стиб≥ю, €кий випадаЇ з розчину у вигл€д≥ чорноњ маси:
2SbCl5 + 5Zn → 2Sb↓ + 5ZnCl2.
ƒосл≥д 6. як ≥ кат≥они Sb3+, кат≥они Sb5+ можуть бути в≥дновлен≥ у кислому середовищ≥ до SbH3:
Sb5+ + Zn + 3H+ → 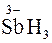 + Zn2+.
+ Zn2+.
ƒосл≥д 7. Ќа в≥дм≥ну в≥д йон≥в Sb3+, йони Sb5+ окиснюють йодид-≥они у кислому середовищ≥ до елементарного йоду, а Sb5+ при цьому в≥дновлюЇтьс€ до Sb3+:
Sb5+ + 2≤− → Sb3+ + ≤2.
–озчин забарвлюЇтьс€ в бурий кол≥р йодом, €кий вид≥ливс€. ÷ей йод можна екстрагувати в орган≥чну фазу, €ка при цьому набуде характерного ф≥олетового забарвленн€.
ƒосл≥д 8. Ћюм≥несцентне ви€вленн€ —тиб≥ю.
—тиб≥й незалежно в≥д ступен€ його окисненн€ в сполуках можна ви€вити за характером забарвленн€ перлин —аќ. якщо на перлину з розжареного кальц≥й оксиду нанести краплю розчину, що м≥стить сол≥ —тиб≥ю, та знову прожарити у полумТњ газового пальника, то п≥сл€ охолодженн€ перлини при њњ осв≥тленн≥ ультраф≥олетовим св≥тлом спостер≥гаЇтьс€ ≥нтенсивна люм≥несценц≥€ в≥д зеленувато-жовтого до бл≥дожовтого кольору у залежност≥ в≥д вм≥сту —тиб≥ю у досл≥джуваному зразку. ÷€ реакц≥€ маЇ дуже велику чутлив≥сть, що даЇ можлив≥сть ви€вити дуже незначн≥ к≥лькост≥ —тиб≥ю у проб≥.
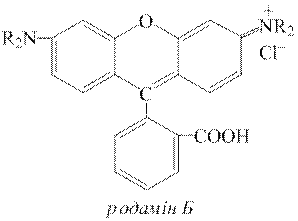
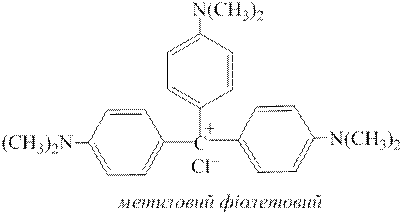
ƒосл≥д 9. ќрган≥чн≥ барвники родам≥н Ѕ та метиловий ф≥олетовий з кат≥онами Sb5+ дають ф≥олетово-синЇ забарвленн€. ÷ю реакц≥ю доц≥льно проводити крапельним методом.
ƒл€ цього до невеликоњ проби досл≥джуваного розчину додають 2-кратний обТЇм розчину концентрованоњ хлоридноњ кислоти, пот≥м дек≥лька крапель розчину KNO3 або NaNO3 (с( )=1,0моль/дм3) дл€ окисненн€ Sb3+ у Sb5+. „ерез 1-2 хвилини кипТ€т≥нн€м або додаванн€м до розчину сечовини CO(NH2)2 видал€ють з нього надлишок йон≥в NO2−. ѕот≥м краплю цього розчину пом≥щають у заглибленн€ порцел€новоњ пластинки та додають до нењ одну краплю розчину родам≥ну Ѕ або метилового ф≥олетового. «а на€вност≥ у розчин≥ кат≥он≥в Sb5+ пл€ма в обох випадках набуваЇ ф≥олетового забарвленн€. ∆оден з кат≥он≥в не заважаЇ ви€вленню SbV за ц≥Їю реакц≥Їю.
)=1,0моль/дм3) дл€ окисненн€ Sb3+ у Sb5+. „ерез 1-2 хвилини кипТ€т≥нн€м або додаванн€м до розчину сечовини CO(NH2)2 видал€ють з нього надлишок йон≥в NO2−. ѕот≥м краплю цього розчину пом≥щають у заглибленн€ порцел€новоњ пластинки та додають до нењ одну краплю розчину родам≥ну Ѕ або метилового ф≥олетового. «а на€вност≥ у розчин≥ кат≥он≥в Sb5+ пл€ма в обох випадках набуваЇ ф≥олетового забарвленн€. ∆оден з кат≥он≥в не заважаЇ ви€вленню SbV за ц≥Їю реакц≥Їю.
|






