До шостої аналітичної групи відносять катіони Cu2+, Co2+, Ni2+, Cd2+, Hg2+.
Електронна будова катіонів цієї аналітичної групи наступна: Cu2+ − [Ar]3d9; Co2+ − [Ar]3d7; Ni2+ − [Ar]3d8; Cd2+ − [Kr]4d10; Hg2+ − [Xe]4f145d10.
Всі ці хімічні елементи схильні до комплексоутворення, особливо стійкими є ціанідні, роданідні та амоніакатні комплекси.
Так, наприклад,
| Кнест[Co(CN)6]3– =1·10–64; | Кнест[Cd(CN)4]2– =1,76·10–18; |
| Кнест[Ni(CN)4]2– =1·10–31; | Кнест[Cu(NH3)4]2+ =9,33·10–13; |
| Кнест[Ni(NH3)6]2+ =1,23·10–8; | Кнест[Hg(CN)4]2– =3,09·10–42; |
| Кнест[Hg(SCN)4]2– =1,7·10–20 |
Груповим реагентом на катіони шостої аналітичної групи є концентрований розчин (w=25%) амоніаку у надлишку. Гідратовані катіони Cu2+, Ni2+, Co2+ мають забарвлення відповідно блакитне, зеленувате та рожеве. Катіони Cd2+, Hg2+ – безбарвні.
При дії розчинів лугів NaOH, KOH на розчини, що містять катіони Cu2+, Ni2+, Cd2+, утворюються аморфні осади гідроксидів:
Cu2+ + 2ОН− → Сu(OH)2↓ – блакитне забарвлення;
Ni2+ + 2ОН− → Ni(OH)2↓ – сіро-зелене забарвлення;
Cd2+ + 2ОН−→ Сd(OH)2↓ – безбарвний.
У лужному середовищі Hg2+-іони утворюють осад HgO, а катіони Co2+ при дії лугів реагують з утворенням основної солі:
Hg2+ + 2ОН− → HgO↓ + Н2О;
Co2+ + ОН− + Сl− (або інший аніон) → Co(OH)Cl↓.
Всі ці осади розчинні у кислотах (HCl, HNO3, H2SO4), а також у надлишку амоніаку, окрім HgО, який розчиняється в розчині амоніаку (w=25%) лише за наявності солей амонію.
Розчин амоніаку, взятий у надлишку, реагує з катіонами шостої аналітичної групи з утворенням різних сполук:
2Cu2+ + SO42– + 2NH3·H2O→ Сu2(OH)2SO4↓ + 2NH4+;
Cd2+ + 2NH3·H2O → Сd(OH)2↓ + 2NH4+;
HgCl2 + 2NH3·H2O → [NH2Hg]Cl↓ + NH4+ + Cl− + 2Н2О;
NiCl2 + NH3·H2O → Ni(OH)Cl↓ + NH4+ + Cl−;
CoCl2 + NH3·H2O → Co(OH)Cl↓ + NH4+ + Cl−.
При взаємодії катіонів шостої аналітичної групи з надлишком концентрованого розчину амоніаку утворюються добре розчинні у воді комплексні амоніакати:
Cu2+ + 4NH3·H2O → [Сu(NH3)4]2+ + 4Н2О – забарвлення інтенсивне
синьо-фіолетове;
Ni2+ + 6NH3·H2O → [Ni(NH3)6]2+ + 6Н2О – забарвлення синє;
Co2+ + 6NH3·H2O → [Co(NH3)6]2+ + 6Н2О – забарвлення блакитне;
Cd2+ + 4NH3·H2O → [Сd(NH3)4]2+ + 4Н2О – розчин безбарвний;
Hg2+ + 4NH3·H2O → [Hg(NH3)4]2+ + 4Н2О – розчин безбарвний;
Ni2+ + 6NH3·H2O → [Ni(NH3)6]2+ + 6Н2О – забарвлення темно-синє.
Утворення амоніакатів Меркурію та Кобальту відбувається при нагріванні і додаванні до суміші NH4Cl.
Амоніакат [Co(NH3)6]2+ під дією кисню повітря, а особливо під дією більш сильних окисників, перетворюється на амоніакат [Co(NH3)6]3+, який має червоно-вишневе забарвлення.
Сульфід-іони з нейтральних розчинів катіонів шостої аналітичної групи осаджують їх у вигляді відповідних сульфідів:
 Cu2+ + S2– → СuS↓;
Cu2+ + S2– → СuS↓;
Ni2+ + S2− → NiS↓; забарвлення
Co2+ + S2− → CoS↓; чорне
Hg2+ + S2− → HgS↓;
Cd2+ + S2− → СdS↓ – забарвлення жовте..
ДР(СuS)=6,3·10–46; ДР(HgS)=1,6·10–52; ДР(NiS)=3,2·10–19;
ДР(СdS)=1,6·10–28; ДР(β-СоS)=1,9·10–27.
У кислих розчинах осади CoS та NiS не утворюються. CdS випадає в осад тільки в слабкокислому середовищі, а CuS − тільки у присутності хлоридної та сульфатної кислот, але розчиняється при нагріванні в розведеній нітратній кислоті. HgS не розчиняється в розведених кислотах, але розчиняється при нагріванні в концентровані нітратній кислоті або суміші концентрованих нітратної та сульфатної кислот.
Для отримання сульфідів катіонів шостої аналітичної групи можна взяти розчини Na2S або H2S. Слід пам’ятати, що H2S надзвичайно отруйний, тому всі досліди з ним або Na2S необхідно проводити у витяжній шафі.
4.7.1. Реакції виявлення катіонів Cu2+
Дослід 1. При взаємодії катіонів Cu2+ з концентрованим водним розчином амоніаку спочатку утворюється блакитний осад купрум гідроксиду, який у надлишку амоніаку розчиняється і утворюється розчин комплексного купрум амоніакату інтенсивного синьо-фіолетового забарвлення:
Сu2+ + 2NH3·H2O → Cu(OH)2↓ + 2NH4+;
Cu(OH)2 + 4NH3·H2O → [Сu(NH3)4](OH)2 + 4H2O.
Дослід 2. Відновлення катіонів Сu2+ до Сu+ тіосульфатом. Ця реакція застосовується в систематичному аналізі для відділення Сu2+ від інших катіонів, зокрема Cd2+, Hg2+.
До підкисненого розчину, що містить йони Сu2+, додають розчин Na2S2O3 і нагрівають. Утворюється темно-бурий осад Cu2S.
В залежності від кількості взятого натрій тіосульфату реакція катіонів Сu2+ з цим реагентом відбувається з утворенням різних продуктів.
При надлишку Na2S2O3:
| 2CuSO4 + 2Na2S2O3 → Na2SO4 + Na2S4O6 + Cu2SO4; Cu2SO4 + Na2S2O3 → Na2SO4 + Cu2S2O3; Cu2S2O3 + Na2S2O3 → Na2[Cu2(S2O3)2]; Na2[Cu2(S2O3)2] + H2SO4 → Na2SO4 + H2[Cu2(S2O3)2]; H2[Cu2(S2O3)2] → H2SO4 + SO2↑ + S↓ + Cu2S↓. |
Підсумкове рівняння реакцій:
2CuSO4 + 4Na2S2O3 → 3Na2SO4 + Na2S4O6 + SO2↑ + S↓ + Cu2S↓.
При еквівалентних співвідношеннях або недостачі реагенту:
CuSO4 + Na2S2O3 → CuS2O3 + Na2SO4;
CuS2O3 + H2O →CuS ↓+ H2SO4.
Застосування тіосульфату для розділення катіонів Cu2+, Cd2+, Hg2+ засновано на тому, що катіони Cd2+ тіосульфатом не осаджуються. Купрум(ІІ) сульфід розчиняється у розведеній нітратній кислоті, а меркурій(ІІ) сульфід не розчиняється. При додаванні до розчину, що містить йони Cu2+, натрій тіосульфату (кристалічного) у надлишку суміш спочатку знебарвлюється внаслідок утворення комплексної солі, яка при нагріванні розкладається з утворенням Cu2S та S.
При проведенні реакції відновлення Cu2+ до Cu+ у розчині не повинно бути окисників, зокрема нітратної кислоти, яка окиснює тіосульфат:
Na2S2O3 + 2HNO3 → Na2SO4 + 2NO2↑ + S + H2O.
Дослід 3. Активні метали – алюміній, цинк, залізо – відновлюють катіони Cu2+ до вільної міді.
Для проведення цієї реакції на очищену пластинку цих металів наносять краплю розчину солі Купруму, підкисненого сульфатною кислотою до рН=1−2. Через деякий час на місці нанесення краплі з’являється червонувата пляма вільної міді:
Cu2+ + Zn → Cu + Zn2+.
Якщо підкиснювати розчин солі Купруму розчином нітратної кислоти, то відновлення Cu2+ до Cu не відбувається. Окисник нітратна кислота перешкоджає відновленню катіонів Cu2+:
Zn + 4HNO3 → Zn(NO3)2 + 2NO2↑ + 2H2O.
Дослід 4. Дуже чутливою реакцією на катіони Cu2+ є їх взаємодія з K4[Fe(CN)6]:
2Cu2+ + [Fe(CN)6]4– → Сu2[Fe(CN)6]↓.
Утворений осад має червоно-буре забарвлення. Реакцію слід проводити в оцтовокислому середовищі, оскільки осад Сu2[Fe(CN)6] руйнується під дією сильних кислот та амоніаку. За наявності у досліджуваному розчині катіонів Fe3+ дану реакцію проводити неможливо внаслідок утворення при цьому берлінської лазурі Fe4[Fe(CN)6]3 інтенсивно синього забарвлення.
Щоб уникнути заважаючого впливу йонів Fe3+, їх необхідно або видалити з розчину, або перевести у малодисоційовану сполуку, яка б мала таку низьку константу дисоціації, щоб при дисоціації цієї сполуки кількість йонів Fe3+ була б недостатньою для утворення берлінської лазурі. Такою сполукою може бути, наприклад, [FeF6]3–.
Проводячи реакцію на йони Cu2+ із [Fe(CN)6]3– у присутності йонів Fe3+, до декількох краплин кислого досліджуваного розчину додають 3-4 краплі розчину NaF, 2-3 краплі розчину CH3COONa, а потім 1-2 краплі розчину К4[Fe(CN)6]. Утворення червоно-бурого осаду свідчить про наявність у досліджуваному розчині катіонів Cu2+. Якщо у розчині цих йонів мало, то спостерігається забарвлення розчину у рожевий колір.
Інші катіони шостої аналітичної групи із К4[Fe(CN)6] теж дають осади, але інших забарвлень, ніж Сu2[Fe(CN)6]: Сd2[Fe(CN)6] та Hg2[Fe(CN)6] – білого кольору; Со2[Fe(CN)6] – сіро-зеленого забарвлення; Ni2[Fe(CN)6] – блідо-зеленого забарвлення.
Реакція катіонів Cu2+ із К4[Fe(CN)6] більш чутлива ніж реакція утворення комплексного купрум амоніакату.
Дослід 5. При взаємодії катіонів Cu2+ з йодид-іонами утворюється осад CuI та виділяється вільний йод:
Cu2+ + 2I− → CuI2;
2СuI2 → 2CuI↓ + I2.
Утворений вільний йод можна екстрагувати в органічну фазу (наприклад, бензен), внаслідок чого органічний шар набуде характерного забарвлення йоду.
Дослід 6. Рубеановоднева кислота при взаємодії в амоніачному або слабкокислому середовищі з катіонами Cu2+ утворює чорний осад внутрішньокомплексної солі:
 .
.
Дослід 7. Амоній тетрародано(ІІ) меркурат з катіонами Cu2+ утворює оливково-зелений кристалічний осад Cu[Hg(SCN)4]·Zn[Hg(SCN)4].
З катіонів шостої аналітичної групи цій реакції заважають катіони Cо2+, які з (NH4)2[Hg(SCN)4] утворюють синьо-блакитний осад Со[Hg(SCN)4] або у присутності йонів Zn2+ – нерозчинну подвійну сіль Cо[Hg(SCN)4]·Zn[Hg(SCN)4] теж синьо-блакитного кольору. Катіони Cd2+ з цим реактивом теж утворюють білий осад Сd[Hg(SCN)4]. Даній реакції заважають катіони Fe3+, оскільки вони забарвлюють розчин у червоний колір, який буде маскувати забарвлення осаду Cu[Hg(SCN)4].
4.7.2. Реакції виявлення катіонів Cо2+
Гідратовані йони Cо2+ мають рожево-фіолетове забарвлення.
Дослід 1. Катіони Cо2+ з роданід-аніонами утворюють роданідний комплекс [Со(SCN)4]2–:
Cо2+ + 4SCN– → [Со(SCN)4]2–.
Тетрародано(ІІ) кобальтат-іон має блакитне забарвлення. Він не стійкий, легко розпадається у водних розчинах. Але якщо екстрагувати амоній тетрародано(ІІ) кобальтат (NH4)2[Со(SCN)4] у аміловий спирт або суміш амілового спирту з діетиловим етером, то органічна фаза забарвлюється у синій колір. Комплекс краще розчиняється в такому органічному розчиннику, ніж у воді. При виконанні цієї реакції слід додавати надлишок роданід-іонів для пригнічення дисоціації комплексного аніона:
[Со(SCN)4]2– 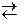 Co2+ + 4SCN–.
Co2+ + 4SCN–.
У пробірку вносять декілька крапель розчину, що містить катіони Co2+, додають 8-10 крапель насиченого розчину амоній або калій роданіду, 5-6 крапель суміші діетилового етеру з аміловим спиртом та збовтують. Після розшарування верхній органічний шар забарвлюється у синій колір, що свідчить про наявність у розчині катіонів Co2+.
Виявленню катіонів Co2+ за реакцією з роданід-іоном заважають катіони Cu2+, Fe3+, Bi3+, які теж утворюють з роданід-іонами забарвлені комплекси.
Для задовільного виявлення катіонів Co2+ у присутності катіонів, що заважають, доцільно аналіз виконати наступним способом. На смужку фільтрувального паперу наносять краплю досліджуваного розчину, краплю концентрованого розчину NH4SCN або KSCN, потім тримають папір над шийкою склянки із концентрованим розчином амоніаку. При цьому йони, що заважають, зв’язуються у нерозчинні гідроксиди. Смужку паперу підсушують над полум’ям пальника. Якщо є катіони Co2+, то периферійна частина плями забарвлюється у інтенсивно синій колір.
Дослід 2. При дії на катіони Cо2+ амоній тетрародано(ІІ) меркуратом (NH4)2[Hg(SCN)4] утворюється синій осад комплексної солі Cо[Hg(SCN)4]. Йони Zn2+ сприяють утворенню осаду:
2(NH4)2[Hg(SCN)4] + Zn2+ + Cо2+ → Cо[Hg(SCN)4]·Zn[Hg(SCN)4]↓ + 4NH4+.
Виявленню катіонів Со2+ за цією реакцією заважають катіони Cu2+, Fe3+, Ni2+ та інші, оскільки вони з реагентом теж утворюють забарвлені сполуки.
Для проведення цієї реакції у пробірку вносять 2-3 краплі розчину (NH4)2[Hg(SCN)4], додають 2 краплі розчину сульфатної кислоти (с( H2SO4)=2,0моль/дм3), 2 краплі розчину ZnSO4 та 2 краплі досліджуваного на наявність катіонів Со2+ розчину. Перемішують скляною паличкою. Випадає осад синього або блакитного кольору.
H2SO4)=2,0моль/дм3), 2 краплі розчину ZnSO4 та 2 краплі досліджуваного на наявність катіонів Со2+ розчину. Перемішують скляною паличкою. Випадає осад синього або блакитного кольору.
Дослід 3. Катіони Cо2+ можна виявити за реакцією із KNO2.
Для цього досліджуваний розчин підкиснюють оцтовою кислотою, додають невелику кількість розчину KNO2 (w=20%), нагрівають. Через деякий час за наявності у розчині катіонів Cо2+ вони зразу ж окиснюються у процесі коплексоутворення до Со3+ і випадає жовтий кристалічний осад K3[Co(NO2)6]:
Cо2+ + 7KNO2 + 2СН3СООН → K3[Co(NO2)6]↓ + NO↑ + H2O + 2CH3COO– + 4K+
або у випадку наявності у досліджуваному розчині йонів Cо3+:
Cо3+ + 6KNO2 → K3[Co(NO2)6]↓ + 3K+.
З катіонами Cо3+ ця реакція відбувається порівняно легко; з катіонами Cо2+ вона проходить повільніше. Тому перед виявленням у розчині катіонів Cо2+ за цією реакцією доцільно спочатку їх окиснити до Cо3+ додаванням невеликої кількості розчину H2O2 та нагріванням до кипіння.
При малих концентраціях йонів Cо2+ осад K3[Co(NO2)6] з’являється через 20-30 хвилин.
Виявленню катіонів Cо2+ або Cо3+ за цією реакцією заважають катіони Ni2+ у присутності катіонів Ca2+, Sr2+, Ba2+, Pb2+, оскільки при цьому також утворюється жовтий осад подвійної солі Ме2[Ni(NO2)6], де Ме – Ca2+, Sr2+, Ba2+, Pb2+.
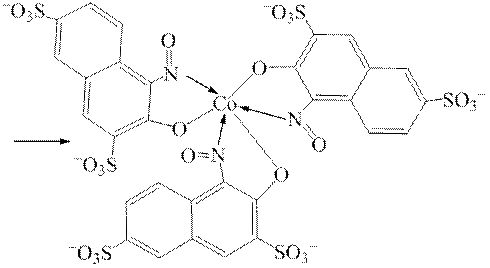
Дослід 4. Co2+-іони можна виявити за реакцією з нітрозо-R-сіллю (динатрієва сіль 3-окси-4-нітрозонафталін-2,7-дисульфокислоти).
У перебігу рееакції йони Со2+ окиснюються киснем повітря у йони Со3+. Со3+-іони з нітрозо-R-сіллю в оцтовокислому середовищі при рН ≈5,5 взаємодіють з утворенням комплексної сполуки, яка має червоне забарвлення:

4.7.3. Реакції виявлення катіонів Ni2+
Гідратовані катіони Ni2+ мають зеленувате забарвлення.
Дослід 1. Найбільш характерною реакцією на катіони Ni2+ є їх взаємодія з диметилгліоксимом (реактивом Чугаєва) у амоніачному середовищі. При цьому утворюється хелатний комплекс, який має світло-червоне забарвлення:
Ni2+ + 6NH3·Н2O → [Ni(NH3)6]2+ + 6H2O;


Для проведення цієї реакції у пробірку вносять декілька крапель розчину солі Ніколу, додають 1-2 краплі розчину Н2О2 для окиснення Fe2+ у Fe3+ та 5-6 крапель концентрованого розчину амоніаку. Якщо при цьому утвориться осад, то його відділяють від розчину центрифугуванням. Одну краплю центрифугату наносять на порцелянову пластинку або в чашку і додають краплю спиртового розчину диметилгліоксиму. Утворюється осад світло-червоного забарвлення.
Цю реакцію треба проводити в амоніачному розчині при рН близько 9.
Проведенню цієї реакції заважають катіони Fe2+, Cu2+, Co2+, які з реактивом Чугаєва теж утворюють забарвлені комплекси і вони мають бути видалені перед виявленням катіонів Ni2+ за цією реакцією. Катіони Cu2+ та Co2+, крім того, в амоніачному середовищі утворюють забарвлені у синій колір відповідні амоніакатні комплекси, які будуть маскувати забарвлення нікол гліоксамату.
Для виявлення катіонів Ni2+ замість диметилгліоксиму можна застосувати також дифенілгліоксим, диацетилмонооксим, ортоциклогексилдіондиоксим і деякі інші органічні реагенти.
Для видалення з розчину йонів Cu2+ , що заважають, до розчину додають розчин лугу. При цьому утворюється осад Cu(OH)2, який при подальшому нагріванні перетворюється на купрум(ІІ) оксид чорного кольору, що у розчині амоніаку практично нерозчинний. Осад відфільтровують, промивають і на фільтрі два-три рази обробляють розчином амоніаку. При цьому основна частина Ni(OH)2 та Cd(OH)2 переходить у розчин у формі відповідних амоніакатів [Ni(NH3)4]2+ та [Cd(NH3)4]2+, а СuO залишається на фільтрі.
Крім того, катіони Cu2+ та Hg2+ можна видалити з розчину у вигляді нерозчинних СuS та HgS.
З диметилгліоксимом катіони Fe2+ теж утворюють комплекс, забарвлений у червоний колір, але їх можна легко окиснити до Fe3+ за допомогою Н2О2. Катіони Fe3+ з даним реагентом комплекс не утворюють.
Дослід 2. Катіони Ni2+ з К4[Fe(CN)6] утворюють зеленуватий осад Ni2[Fe(CN)6]:
2Ni2+ + [Fe(CN)6]4– → Ni2[Fe(CN)6]↓.
Дослід 3. З Na2HPO4 катіони Ni2+ реагують з утворенням зеленого осаду нікол фосфату:
3Ni2+ + 2HPO42– → Ni3(PO4)2↓ + 2Н+.
Дослід 4. NH4SCN з катіонами Ni2+ утворюють світло-зелений осад нікол роданіду, який розчиняється у надлишку реагенту:
Ni2+ + 2SCN– → Ni(SCN)2↓.
Ni(SCN)2 + 2NH4SCN → [Ni(SCN)4]2– + 2NH4+.
4.7.4. Реакції виявлення катіонів Hg2+
При роботі зі сполуками Меркурію необхідно строго дотримуватись правил техніки безпеки зважаючи на їх високу токсичність.
Дослід 1. У кислому середовищі при взаємодії катіонів Hg2+ з сульфідною кислотою утворюється чорний осад меркурій(ІІ) сульфіду, який нерозчинний у розведеній нітратній кислоті:
Hg2+ + H2S → HgS↓ + 2H+.
Меркурій(ІІ) сульфід розчиняється у розчині натрій сульфіду:
HgS + Na2S → Na2HgS2↓,
або у суміші хлоридної та нітратної кислот:
3HgS + 6HCl + 2HNO3 → 3HgCl2 + 2NO↑ + 3S↓ + 4H2O.
При цьому утворюється одна з небагатьох солей – HgCl2 – яка дуже погано дисоціює і є слабким електролітом.
Також утворюється осад HgS при взаємодії йонів Hg2+ з тіосульфатом:
Hg2+ + S2О32– → HgS↓ + SO32–.
Дослід 2. При взаємодії катіонів Hg2+ з йодид-іонами утворюється червоний осад меркурій(ІІ) йодиду:
Hg2+ + 2І– → HgІ2↓,
який розчиняється у надлишку реагенту з утворенням безбарвної дуже стійкої комплексної солі:
HgІ2 + 2КІ → К2[HgІ4]; Кнест[HgІ4]2– = 5·10–31.
За цією реакцією можна виявити катіони Hg2+ у присутності катіонів всіх аналітичних груп, окрім катіонів Ag+ та Pb2+, які також утворюють забарвлені осади йодидів. Для видалення катіонів, що заважають, до досліджуваного розчину додають суміш розчинів калій хлориду та калій сульфату. При цьому в осад випадають AgCl та PbSO4.
Реакцію виявлення йонів Hg2+ з йодид-іонами слід проводити при рН<6.
Зважаючи на те, що Кнест[HgІ4]2– = 5·10–31, а ДР(HgІ2)=6,8·10–13, з розчинів солей Hg2+ при дії на них розчином KI отримати осад HgІ2 практично неможливо, оскільки в момент свого утворення меркурій(ІІ) йодид миттєво переходить у більш стійкий комплексний йон [HgІ4]2–.
Проте, виявити катіони Hg2+ за цією реакцією можна непрямим методом. На смужку фільтрувального паперу наносять послідовно краплю досліджуваного розчину, на неї – краплю розчину КІ. При цьому відбуваються реакції:
Hg2+ + І2 → HgІ2;
HgІ2 + 2КІ → К2[HgІ4].
Потім на це місце наносять краплю концентрованого розчину КОН. Суміш К2[HgІ4] та КОН є реактивом Неслера. Після того, як отримана пляма цілком розійдеться на папері, папір з плямою поміщають над шийкою склянки з розчином амоніаку. При цьому пляма набуває чорного забарвлення внаслідок виділення металічної ртуті.
Дослід 3. Йони Hg2+ можна виявити відновивши їх до металічної ртуті за участі Sn2+-іонів:
2HgCl2 + SnCl2 → Hg2Cl2↓ + SnCl4;
Hg2Cl2 + SnCl2 → 2Hg↓ + SnCl4.
Розчин SnCl2 має бути свіжоприготовленим у розчині хлоридної кислоти з гранулами олова на дні посудини. Реакцію проводять при рН<5.
Сильні окисники заважають проведенню реакції окиснюючи Sn2+ до SnIV.
Дослід 4. Відновити катіони Hg2+ до металічної ртуті можна металічною міддю.
На очищену мідну пластинку наносять краплю досліджуваного на катіони Hg2+ розчину. Через декілька хвилин на поверхні пластинки з’являється сіра або чорна пляма металічної ртуті:
Hg2+ + Сu → Hg↓ + Cu2+.
Виявленню катіонів Hg2+ у такий спосіб заважають катіони Ag+, Bi3+, [Hg2]2+, Sb3+, які також відновлюються до металічного стану у вигляді темних плям.
За наявності в досліджуваному розчині Sb3+ та Bi3+ реакція може відбуватися у присутності аніліну.
Дослід 5. Мікрокристалоскопічна реакція виявлення катіонів Hg2+.
На предметне скло мікроскопа наносять краплю розчину, що містить катіони Hg2+, обережно випарюють досуха. До сухого залишку додають краплинами концентровані розчини Co(NO3)2 та NH4SCN. Утворюються сині кристали Со[Hg(SCN)4] у вигляді або призм, або трикутників, або розеток з голок. Ці кристали розглядають під мікроскопом.
Рис. …Кристали Co[Hg(SCN)4]
Дослід 6. Люмінесцентна реакція виявлення катіонів Hg2+ з СаО.
На платинову петельку набирають кашку з кальцій оксиду, розмішаного з водою, і сильно прожарюють у полум’ї газового пальника. Утворюється перлина СаО. Після того, як перлина охолоне, розглядають її в ультрафіолетовому світлі, яке відфільтроване за допомогою ультрафіолетових світлофільтрів УФС-1 або УФС-3. Переконавшись, що світіння на перлині СаО відсутнє, наносять на неї піпеткою з тонким отвором краплю досліджуваного на катіони Hg2+ розчину і прожарюють у полум’ї газового пальника. Після охолодження перлини її розглядають в ультрафіолетовому світлі. В залежності від вмісту катіонів Hg2+ спостерігають світіння від білого до блакитного кольору.
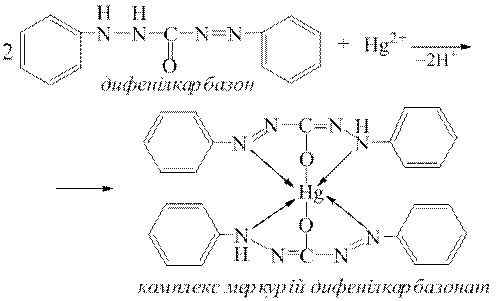
Дослід 7. Виявлення катіонів Hg2+ за реакціями з дифенілкарбазидом або дифенілкарбазоном.
На порцелянову пластинку наносять краплю досліджуваного розчину і на неї – краплю розчину нітратної кислоти та краплю розчину дифенілкарбазиду або дифенілкарбазону. За наявності у досліджуваному розчині катіонів Hg2+ утворюється синьо-фіолетове забарвлення комплексного меркурій дифенілкарбазонату:
4.7.5. Реакції виявлення катіонів Cd2+
Дослід 1. Гідроген сульфід H2S в оцтовокислому середовищі з катіонами Cd2+ утворює жовтий осад кадмій сульфіду CdS:
Cd2+ + H2S → СdS↓ + 2H+.
Виявленню катіонів Cd2+ за цією реакцією заважають інші катіони шостої аналітичної групи, які також утворюють забарвлені нерозчинні сульфіди.
Для видалення йонів, що заважають, поступають наступним чином.
У пробірку вносять 3-4 краплі розчину, що містить катіони Cd2+, додають 6 крапель розчину сульфатної кислоти, 2-3 кристалика Na2S2O3 та нагрівають. При цьому в осад випадають HgS та Cu2S. У розчині залишаються катіони Co2+, Ni2+, Cd2+. Осад відділяють від розчину центрифугуванням. У іншу пробірку вносять 5-6 крапель розчину H2S та додають 2-3 краплі центрифугату. Випадає жовтий осад CdS, який розчиняється в розчині хлоридної кислоти і не розчиняється в оцтовій.
Окисники заважають проведенню даної реакції, оскільки окиснюють сульфід-іони.
Дослід 2. Тіосечовина утворює з солями Кадмію легкорозчинні комплексні солі:
 .
.
Комплексні солі Кадмію не стійкі, легко розкладаються при дії H2S, оскільки Кнест[Cd(CSN2H4)3]2+=1,2·10–3, а ДР(CdS)=3.6·10–29. Процес відбувається в бік утворення більш стійкої сполуки:
[Cd(CSN2H4)3]2+ + H2S → CdS↓ + 3CSN2H4 + 2Н+.
Комплекси з тіосечовиною інших катіонів більш стійкі.
Для проведення цієї реакції у пробірку вносять 3-4 краплі досліджуваного на Cd2+-іони розчину, додають 3-4 кристалика тіосечовини, перемішують, дають постояти 2-3хв., потім додають 5-6 крапель свіжоприготовленого розчину H2S. Випадає жовто-оранжевий осад. Ця реакція дозволяє виявляти йони Cd2+ у присутності катіонів Cu2+, які з тіосечовиною дають стійкий комплекс.
Дослід 3. Виявлення катіонів Cd2+ за реакцією з розчином амоніаку та КІ:
Cd2+ + 4NH3·H2O + 2I– → [Cd(NH3)4]І2↓ + 4H2O.
Катіони Cd2+ з надлишком КІ та NH3·H2O утворюють білий осад комплексного кадмій амоніакату.
До розчину, що містить катіони Cd2+, додають розчин амоніаку до повного розчинення утвореного спочатку осаду Cd(OH)2, а потім – невелику кількість свіжоприготовленого розчину КІ (w=40%). Через деякий час з розчину виділяється білий осад [Cd(NH3)4]І2.
Виявленню катіонів Cd2+ таким способом не заважають інші катіони шостої аналітичної групи, а також катіони інших аналітичних груп, оскільки після додавання розчину амоніаку більшість з них випадає в осад у вигляді гідроксидів або оксидів, який перед додаванням розчину КІ відділяють від розчину, що містить [Cd(NH3)4](ОН)2. Ця реакція на катіони Cd2+ специфічна, але дуже малочутлива.






