Условие равновесия фаз можно получить из теорем термодинамики. Как уже говорилось, при равновесии системы температура и давление всех фаз одинаковые. Если их поддержать постоянными, то термодинамический потенциал системы может только убывать. При равновесии оно принимает минимальное значение. Этим положением мы и воспользуемся для вывода условия равновесия фаз. Пусть 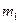 - масса первой фазы,
- масса первой фазы,  - масса второй фазы. Обозначим через
- масса второй фазы. Обозначим через  и
и  удельные термодинамические потенциалы вещества в этих фазах. Термодинамический потенциал всей системы представится в виде
удельные термодинамические потенциалы вещества в этих фазах. Термодинамический потенциал всей системы представится в виде 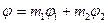 . Пусть Р и Т системы поддерживаются постоянными. Тогда при фазовых превращениях величины
. Пусть Р и Т системы поддерживаются постоянными. Тогда при фазовых превращениях величины  и
и  не будут изменяться, так как они являются однозначными функциями только Р и Т. Не будет изменяться и полная масса вещества
не будут изменяться, так как они являются однозначными функциями только Р и Т. Не будет изменяться и полная масса вещества 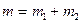 . Могут изменяться только
. Могут изменяться только  . Эти изменения должны происходить в таком направлении, что термодинамический потенциал принял наименьшее значение, возможное в рассматриваемых условиях. Если
. Эти изменения должны происходить в таком направлении, что термодинамический потенциал принял наименьшее значение, возможное в рассматриваемых условиях. Если  , то всякое превращение фазы 1 в фазу 2 сопровождается уменьшением
, то всякое превращение фазы 1 в фазу 2 сопровождается уменьшением  . Это превращение и будет происходить, пока вся фаза 1 не перейдет в более устойчивую фазу 2. Тогда система станет однофазной, и ее термодинамический потенциал достигнет минимального значения
. Это превращение и будет происходить, пока вся фаза 1 не перейдет в более устойчивую фазу 2. Тогда система станет однофазной, и ее термодинамический потенциал достигнет минимального значения  . Если
. Если  , то фаза 2, в конце концов, превратится в фазу 1. Только при условии
, то фаза 2, в конце концов, превратится в фазу 1. Только при условии
 (9.1)
(9.1)
фазы будут находиться в равновесии друг с другом.
Таким образом, условием равновесия фаз является равенство их удельных термодинамических потенциалов.
Уравнение Клапейрона
Перейдем к рассмотрению следствий уравнения (9.1). Ради определенности будем иметь в виду процессы испарения и конденсации. Состояния вещества будем изображать точкой на плоскости РТ. Каждая точка этой плоскости
 соответствует однородному (однофазному) состоянию вещества - либо жидкости, либо пару. Исключение составляет точки линии ДК. Это линия, представляема уравнением (9.1). На линии ДК удельные термодинамические потенциалы жидкости и пара одинаковы. Здесь эти фазы находятся в равновесии. Каждая точка линии ДК изображает либо жидкость, либо ее пар, либо смесь этих фаз в любых пропорциях. Если решить уравнение (9.1) относительно Р, то уравнение кривой ДК представится в виде:
соответствует однородному (однофазному) состоянию вещества - либо жидкости, либо пару. Исключение составляет точки линии ДК. Это линия, представляема уравнением (9.1). На линии ДК удельные термодинамические потенциалы жидкости и пара одинаковы. Здесь эти фазы находятся в равновесии. Каждая точка линии ДК изображает либо жидкость, либо ее пар, либо смесь этих фаз в любых пропорциях. Если решить уравнение (9.1) относительно Р, то уравнение кривой ДК представится в виде:
 .
.
Это уравнение дает зависимость давления насыщенного пара от температуры. Кривая ДК называется кривой равновесия жидкости и ее насыщенного пара, или кривой испарения. Пересечем кривую равновесия горизонтальной прямой АВ. Пусть давление на изобаре АВ меньше критического. В точке А вещество находится в жидком состоянии. Здесь давление  выше давления насыщенного пара
выше давления насыщенного пара  при той же температуре. Под таким давлением пар существовать не может, он сконденсируется в жидкость. При нагревании при постоянном давлении изображающая точка перемещается вправо. В точке С начинается испарение жидкости. Во время испарения температуры жидкости и насыщенного пара будут оставаться постоянными. Когда вся жидкость испарится, изображающая точка при дальнейшем нагревании будет перемещаться по линии СВ - этому соответствует нагревание пара при постоянном давлении. Следовательно, точки, лежащие левее кривой испарения ДК изображают жидкое состояние вещества, а точки, лежащие правее этой кривой - газообразное состояние.
при той же температуре. Под таким давлением пар существовать не может, он сконденсируется в жидкость. При нагревании при постоянном давлении изображающая точка перемещается вправо. В точке С начинается испарение жидкости. Во время испарения температуры жидкости и насыщенного пара будут оставаться постоянными. Когда вся жидкость испарится, изображающая точка при дальнейшем нагревании будет перемещаться по линии СВ - этому соответствует нагревание пара при постоянном давлении. Следовательно, точки, лежащие левее кривой испарения ДК изображают жидкое состояние вещества, а точки, лежащие правее этой кривой - газообразное состояние.
Допустим, что давление на изобаре выше критического, т.е. изобара А/В/ проходит выше критической точки К. Тогда при изобарическом нагревании или охлаждении никаких превращений жидкости в пар или обратно не произойдет. Поэтому кривая испарения ДК должна оканчиваться сверху в критической точке К. Следствием обрыва кривой испарения в критической точке является непрерывность жидкого и газообразного состояний веществ. Действительно, из произвольной начальной точки А можно перейти в произвольную конечную точку В так, чтобы при переходе пересечь кривую испарения. Тогда произойдет фазовое превращение. Но можно перейти в то же конечное состояние, обойдя критическую точку К без пересечения кривой испарения ДК. Тогда не наступит никаких фазовых превращений. Вещество все время останется физически однофазным, и его свойства будут меняться непрерывно.
Найдем наклон кривой испарения. Для этого вычислим производную давления насыщенного пара по температуре 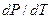 . При смещении вдоль кривой испарения
. При смещении вдоль кривой испарения  . Так как
. Так как  , это соотношение можно записать в виде:
, это соотношение можно записать в виде:
 ,
,
или
 , (9.2)
, (9.2)
где  - удельные энтропии и удельные объемы пара и жидкости. Фазовые превращения, вообще говоря, сопровождаются скачкообразными изменениями энтропии. Это означает, что при таких превращениях поглощается или выделяется тепло. Например, при переходе единицы массы вещества из газообразного состояния 1 в жидкое 2 выделяется тепло
- удельные энтропии и удельные объемы пара и жидкости. Фазовые превращения, вообще говоря, сопровождаются скачкообразными изменениями энтропии. Это означает, что при таких превращениях поглощается или выделяется тепло. Например, при переходе единицы массы вещества из газообразного состояния 1 в жидкое 2 выделяется тепло
 .
.
При обратном переходе из жидкого состояния 2 в газообразное 1 такое же тепло поглощается. Предполагается, что переход совершается при постоянной температуре и постоянном давлении. Тепло 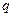 называется удельной теплотой испарения. В общем случае оно называется удельной теплотой фазового превращения (теплота плавления). Уравнение (9.2) перепишем в виде:
называется удельной теплотой испарения. В общем случае оно называется удельной теплотой фазового превращения (теплота плавления). Уравнение (9.2) перепишем в виде:
 . (9.3)
. (9.3)
Это соотношение называется уравнением Клайперона-Клаузиуса.
Вопросы для самоконтроля знаний студентов
1. Что такое термодинамическая фаза вещества?
2. Совпадает ли понятие термодинамической фазы вещества с понятием агрегатного состояния вещества?
3. Как выглядят изотермы реального газа? Как они изменяются при приближении температуры к критическому для данного вещества значению?
4. Какие значения принимает изотермическая сжимаемость вещества в его критической точке?
5. Какое значение имеет скрытая теплота парообразования и поверхностное натяжение вещества в критической точке?
6. Как подсчитать изменение энтропии вещества при фазовом переходе I рода?
7. Как изменяются удельные объемы жидкой и газовой фаз вещества вблизи его критической точки?
8. Что такое насыщенный пар? От чего зависит давление насыщенного пара?
9. При каких условиях имеет место процесс кипения жидкости?
10. Как осуществить непрерывный переход вещества из жидкой фазы в газовую без расслаивания на две фазы?
11. Что такое метастабильные состояния вещества? Как они осуществляются?
12. Как зависит давление насыщающих паров жидкости от кривизны ее поверхности?
13. Как, пользуясь PV — диаграммой реального газа, найти соотношение между количеством вещества в жидкой и газовой фазах для двухфазных состояний вещества?
14. Какие величины связывают между собой уравнение Клайперона-Клаузиуса для однокомпонентной двухфазной системы? Из каких соображений выводится это уравнение?
15. Что такое P-T диаграмма вещества? Как на ней выглядит график процесса возгонки вещества. Как применить уравнение Клаузиуса к процессу возгонки?
16. Возможен ли непрерывный процесс превращения жидкой фазы вещества в кристаллическую?
17. Какой вид имеет V-Т диаграмма вещества, изображающая условие существования газовой, жидкой и твердой фаз вещества?
18. Как подсчитать изменение энтропии вещества при его фазовом превращении первого рода?
19. В вертикальном цилиндре под поршнем находится насыщенный пар. Что произойдет с поршнем, если при постоянной температуре на поршень положить небольшой груз?
20. Что такое термодинамическая фаза вещества? Совпадает ли понятие термодинамической фазы вещества с понятием агрегатного состояния вещества?
21. Какие величины связывает уравнение Клапейрона-Клаузиуса для однокомпонентной двухфазной системы? Из каких соображений оно выводится?
22. Что такое тройная точка? Что такое критическая точка?
23. Как выглядят кривые фазового равновесия в переменных P-Т? Каковы два возможных хода кривых плавления на P-Т диаграмме вещества?
24. Как выглядят кривые фазового равновесия в переменных P-V?
25. Как выглядят кривые фазового равновесия в переменных T-V?
26. Возможен ли непрерывный переход жидкой фазы в кристаллическую и жидкой фазы в газообразную?
27. Жидкость переходит в пар той же температуры. Как при этом меняются удельный большой термодинамический потенциал, энтропия, внутренняя энергия?
28. Открытый сосуд частично заполнен жидкостью. Этот сосуд герметически закрыли. Сравните большие термодинамические потенциалы системы, когда сосуд открыт и через достаточно большой промежуток времени после его закрытия.
29. В замкнутом пространстве помещены один выше другого два открытых сосуда с одной и той же жидкостью. Если температура жидкости в обоих сосудах в начальный момент одинаковы, то через некоторое время температура в нижнем сосуде повышается, а в верхнем понижается. Почему?
30. Под колпак воздушного насоса поставили часовое стекло с налитой на него водой и сосуд с серной кислотой, (для поглощения паров воды). При откачивании воздуха вода на часовом стекле вначале закипает, потом на ее поверхности образуется ледяная корка. Объясните это явление.
31. При исследованиях в области ядерной физики и физики частиц высоких энергий для регистрации быстрых частиц используют камеру Вильсона и пузырьковую камеру. На чем основано использование этих приборов? В чем преимущество пузырьковой камеры?
32. Изобразите на плоскости РТ кривые испарения, плавление и возгонки. Покажите области, в которых вещество находится в твердом, жидком и газообразном состояниях. В какой точке три фазы вещества находятся в равновесии. Покажите точки, соответствующие одинаковым значениям удельного термодинамического потенциала?
 33. В плоскости Р,Т (см. рисунок) показан график изменения давления насыщенного пара чистой жидкости с изменением температуры. Имеет ли эта кривая начало и конец? Какому состоянию вещества соответствуют на рисунке точки 1,2,3. Какие точки характеризуют состояние с одинаковыми удельными термодинамическими потенциалами? Как изменится кривая фазового равновесия, если в этой жидкости растворить какое либо вещество?
33. В плоскости Р,Т (см. рисунок) показан график изменения давления насыщенного пара чистой жидкости с изменением температуры. Имеет ли эта кривая начало и конец? Какому состоянию вещества соответствуют на рисунке точки 1,2,3. Какие точки характеризуют состояние с одинаковыми удельными термодинамическими потенциалами? Как изменится кривая фазового равновесия, если в этой жидкости растворить какое либо вещество?
В каком соотношении находится температура кипения чистой жидкости и раствора при одинаковом атмосферном давлении?
34.Ведется наблюдение за испарением маленьких и больших капель жидкости, находящихся рядом. Почему маленькие капли уменьшаются, а большие увеличиваются?
35.Животный пузырь, наполненный спиртом, при погружении в воду увеличивает свои размеры, а наполненный водой при погружении в спирт уменьшает свои размеры. Как объяснить эти наблюдения?
36.Глиняный сосуд, обработанный особым образом, наполнен раствором сахара. Сосуд закрыт пробкой, в которую вставлена длинная, вертикальная трубка. При погружении сосуда в чистую воду в трубке появляется жидкость. Какова особенность стенок сосуда, приводящая к увеличению давления внутри сосуда. Будет ли высота подъема уровня жидкости в трубке пропорциональна времени наблюдения?
37.Какими путями можно перевести в жидкое состояние газы?
38.Приведите примеры газов, которые никаким способом нельзя привести в жидкое состояние при комнатной температуре. Объясните, почему.
39.Возможен ли непрерывный переход из газообразного состояния в жидкое, минуя стадию двухфазного состояния? Как его осуществить? Возможен ли аналогический переход из твердого в жидкое состояние?
40.Каким явлением сопровождается исчезновение двухфазного состояния жидкость-газ в критической точке? Как оно объясняется?
41.Что называют пересыщенным паром. При каких условиях он может существовать?
42. Как зависит давление насыщающих паров жидкости от кривизны ее поверхности?
Содержание
ПРЕДИСЛОВИЕ.. 3
Программа курса «Молекулярная физика. Термодинамика.». 4
Введение. 9
Глава 1 Термодинамика. 10
§1. Температура и термодинамическое равновесие. 10
§2. Уравнение состояния идеального газа. 12
§3. Законы идеальных газов. 12
§4. Первое начало термодинамики. 15
§5. Макроскопическая работа. 15
§6. Внутренняя энергия. 17
§7. Количество теплоты. Математическая формулировка первого начала термодинамики. 18
§8. Различные приложения I начала термодинамики. Теплоёмкость. 19
§9. Внутренняя энергия идеального газа. Закон Джоуля. 21
§10. Адиабатический процесс. Уравнение Пуассона. 21
§11. Политропический процесс. 24
Вопросы и задания для самостоятельной работы студентов. 25
§12. II начало термодинамики. 28
§13. Равновесные состояния. 29
§14. Обратимые и необратимые процессы.. 30
§15. Цикл Карно. 32
§16. Холодильная машина. 36
§17. Свободная энергия. 37
§18. Энтропия. 38
§19. Некоторые термодинамические соотношения. 39
§20. Закон возрастания энтропии. Второе начало термодинамики. 42
§21. Энтропия и вероятность. 43
§22. Энтропия и беспорядок. 45
§23. Третье начало термодинамики. 46
Вопросы для контроля самостоятельной работы студентов. 48
Глава 2. Неравновесная термодинамика. 50
§1. Основные принципы линейной термодинамики. 50
§2. Нелинейная термодинамика. 53
§3. Принцип синергетики. 54
Глава 3. Статистическая физика и её применение к идеальному газу. 56
§1. Давление газа с точки зрения молекулярно – кинетической теории. 57
§2. Температура как мера средней энергии хаотичного движения молекул. 59
§3. Броуновское движение. 62
§4. Кинетическая теория теплоты.. 65
§5. Классическая теория теплоёмкости и её недостатки. 67
§6. Барометрическая формула. 70
§7. Распределение молекул по скоростям.. 72
§8. Функция распределения. 73
§9. Формула Максвелла. 76
§10. Средняя арифметическая, средняя квадратичная и наивероятнейшая скорости молекул. 77
§11. Среднее число молекул, сталкивающихся со стенкой сосуда. 79
Вопросы для контроля знаний студентов. 79
Глава 4. Явления переноса. 81
§1. Столкновение молекул и явления переноса. 81
§2. Среднее число столкновений в единицу времени и средняя длина свободного пробега молекул. 82
§3. Рассеяние молекулярного пучка в газе. 85
§4. Явление переноса в газах. Уравнение переноса. 85
§5. Диффузия. 87
§6. Нестационарная диффузия. 88
§7. Теплопроводность газов. 90
§8. Вязкость газов (внутреннее трение) 92
§9. Соотношения между коэффициентами переноса. 93
§10. Физические явления в разреженных газах. 94
Вопросы для самостоятельного контроля знаний студентов. 95
Глава 5. 97
§1. Неидеальные газы. Уравнение Ван-дер-Ваальса. Отклонение свойств газов от идеальности 97
§2. Учет сил отталкивания между молекулами. 97
§3. Учет сил притяжения между молекулами. 99
§4. Изотермы Ван-дер-Ваальса. 100
§5. Критическая температура и критическое состояние. 102
§6. Недостатки уравнения Ван-дер-Ваальса. 104
§7. Внутренняя энергия газа Ван-дер-Ваальса. 104
§8. Приведенное уравнение Ван-дер-Ваальса. Закон соответственных состояний. 106
§9. Сжижение газов. 107
Вопросы для самоконтроля изученного материала. 111
Глава 6. Жидкое состояние. 113
§1.Строение жидкостей. 113
§2. Поверхностное натяжение. 114
§3. Условия равновесия на границе двух сред. Краевой угол. 117
§4. Граница жидкости и твердого тела. 118
§5. Силы, возникающие на кривой поверхности жидкости. 118
§6. Капиллярные явления. 120
§7. Упругость насыщенного пара над кривой поверхностью жидкости. 121
Вопросы для самоконтроля знаний студентов. 122
Глава 7. Жидкие растворы.. 124
§1. Свойства растворов. 124
§2. Упругость насыщенного пара над идеальным раствором.. 125
§3. Закон Генри. 126
§4. Осмотическое давление. 127
Глава 8. Кристаллическое состояние. 128
§1. Отличительные черты кристаллического состояния. 128
§2. Классификация кристаллов. 129
§3. Физические типы кристаллических решеток. 130
§4. Тепловое движение в кристаллах. 131
Глава 9. Фазовые переходы.. 132
§1. Фаза и фазовые равновесия. 132
§2. Условия равновесия фаз химически однородного вещества. 133
§3. Уравнение Клапейрона. 134
Вопросы для самоконтроля знаний студентов. 135
Содержание. 139






