Содержание учебного материала: Электролиты и не электролиты. Основные положения теории электролитической диссоциации. Диссоциация кислот, оснований, солей.. Химические реакции между электролитами. Молекулярные, полные и краткие ионные уравнения. Гидролиз солей, его типы.
Основные понятия и термины по теме: сильные и слабые электролиты, электролитическая диссоциация, кислотно-оснóвные реакции в водных растворах,понятие о степени и константе диссоциации, гидролиз солей.
Основные теории химии: Теория электролитической диссоциации кислот и оснований.
Методические рекомендации: При изучении материала необходимо отметить основные положения теории электролитической диссоциации. Обратите внимание на особенности диссоциации кислот и солей. Рассмотрите отдельные виды гидролиза солей.
Краткое изложение теоретических вопросов:
Все вещества по их поведению в растворах принято условно делить на две группы: а) электролиты и б) неэлектролиты.
Электролитами называют сложные вещества, растворы и расплавы которых способны проводить электрический ток (хлороводородная кислота НС1, хлорид натрия NaCl, гидроксид калия КОН). Неэлектролиты, наоборот, электрический ток не проводят.
К неэлектролитам относят многие органические соединения, например спирты, углеводы (сахара), а также газообразные вещества и оксиды.
Диссоциация происходит под действием молекул растворителя (чаще воды) или температуры. При этом химические связи между частицами в кристаллической решетке разрушаются. Таким образом, под электролитической диссоциацией понимают процесс распада электролитов на ионы под действием молекул воды или при расплавлении. Уравнение диссоциации:
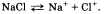
Диссоциация веществ с ковалентной полярной связью происходит несколько сложнее, например диссоциация хлороводорода в воде. Сначала происходит взаимодействие молекул воды с молекулами НС1, находящимися в узлах кристаллической решетки, и их отщепление от нее, а затем происходит «растягивание» полярной молекулы НС1 на гидратированные ионы. Уравнение электролитической диссоциации хлороводорода выглядит так:
 .
.
В составе кислот, солей и оснований (щелочей) можно выделить части, определяющие их химические свойства. У кислот это ионы водорода, у солей — ионы металлов и кислотных остатков, у щелочей — ионы гидроксогрупп.
Реакции в водных растворах электролитов являются реакциями между ионами и называются реакциями ионного обмена. Они протекают практически необратимо в тех случаях, когда в результате их взаимодействия образуются малорастворимые, газообразные вещества или слабодиссоциирующие соединения.
Реакции ионного обмена записывают в молекулярной форме, полной ионно-молекулярной и сокращенной ионно-молекулярной формах.
В полной ионно-молекулярной форме в виде ионов записывают только сильные электролиты, все остальные – в виде молекул. В сокращенной ионно-молекулярной форме оставляют только те ионы и молекулы, которые принимают участие в реакции.
При составлении ионных уравнений реакций НЕЛЬЗЯ записывать в виде ионов:
1. Малорастворимые и нерастворимые соединения (см. таблицу растворимости).
2. Слабые электролиты (слабые кислоты, слабые основания, вода)
3. Газообразные продукты (Н2, О2,Cl2, РН3, SiH4, N2)
4. Простые вещества(S,Zn,Al,F, Br2, I2)
Оксиды (CO, CO2, H2O, SO2, SO3,P2O5)
Алгоритм решения заданий
1.Процесс электролитической диссоциации принято записывать в виде схемы, не раскрывая его механизма и опуская растворитель (H2O), хотя он является основным участником.
CaCl2 ↔ Ca2+ + 2Cl-
KAl(SO4)2 ↔K+ + Al3+ + 2SO42-
HNO3 ↔ H+ + NO3-
Ba(OH)2 ↔ Ba2+ + 2OH-
2. Последовательность составления ионных уравнений.
1.Записать уравнение реакции в молекулярное форме:
BaCl2 + Na2SO4 = BaSO4 ↓ + 2NaCl
2. Переписать уравнение реакции как ионное, заменив молекулы сильных электролитов на ионы. В молекулярной форме записывают трудно растворимые, малодиссоциируемые Н2О; СН3CООН, NH4ОН, и газообразные вещества.
Ba2+ + 2Cl- + 2Na+ + SO42- = BaSO4↓ + 2Na+ + 2Cl-
Это полное ионное уравнение реакции.
3.Исключить из левой и правой части уравнения одинаковые ионы, как не участвующие в реакции, и переписать уравнение без этих ионов:
Ba2+ + SO42- = BaSO4↓
Это сокращённое ионное уравнение выражает сущность реакции, заключающейся во взаимодействии ионов Ba2+ и SO42-
Гидролиз солей – химическое обменное взаимодействие ионов растворенной соли с водой, приводящее к образованию слабодиссоциирующих продуктов (молекул слабых кислот или оснований, анионов кислых солей или катионов основных солей) и сопровождающееся изменением рН среды.
рН - водородный показатель среды, который характеризует кислотность раствора: для нейтральных растворов рН=7; для кислых рН<7; для щелочных рН>7.
Гидролизу подвергаются только те соли, в состав которых входит ион слабого электролита.
Соли, образованные сильными кислотами и основаниями, не содержат в своем составе ионов, способных к взаимодействию с молекулами воды, поэтому гидролизу не подвергаются, а реакция растворов этих солей такая же, как и в воде, нейтральная (рН=7).
Все остальные соли подвергаются гидролизу. Возможны три типа гидролиза солей в зависимости от участия в нем катиона, аниона или того и другого иона соли.
1) Соли, образованные сильной кислотой и слабым основанием гидролизуются по катиону (Кatn+). При этом катионы соли связывают ионы ОН-, а в растворе накапливаются ионы Н+, что обуславливает кислую среду раствора (рН<7):
Katn+ + HOH ↔ KatOH(n-1)+ + H+, (при n=1 образуется KatOH – слабое основание).
2) Соли, образованные слабой кислотой и сильным основанием гидролизуются по аниону (Ann-). При этом анионы соли связывают ионы Н+, а в растворе накапливаются ионы ОН-, что обуславливает щелочную среду (рН>7):
Ann- + HOH ↔ Han(n-1)- + OH-, (при n=1 образуется HAn – слабая кислота.
Гидролиз солей, образованных многозарядными катионами и анионами, проходит ступенчато: число ступеней определяется числовым значением заряда гидролизующего иона. Так, сульфат меди (CuSO4) и сульфид натрия (Na2S) гидролизуются по двум сткпеням:
1-я ступень: Cu2+ + HOH ↔ CuOH+ + H+; S2- + HOH ↔ HS- + OH-;
2-я ступень: CuOH+ HOH ↔ Cu(OH)2 + H+; HS- + HOH ↔ H2S + OH-.
Образующиеся по первой ступени гидролиза ионы Н+ или ОН- значительно снижают вероятность гидролиза по последующим ступеням. В результате практическое значение обычно имеет процесс, идущий только по первой ступени, которым, как правило, и ограничиваются при оценке гидролиза солей в обычных условиях.
3)Гидролиз по катиону и по аниону имеет место при растворении солей, образованных слабой кислотой и слабым основанием.
Рассмотрим этот случай на примере соли CH3COONH4, в растворе которой каждый из ионов подвергается гидролизу:
NH4+ + HOH ↔ NH4OH + H+и
CH3COO- + HOH↔ CH3COOH + OH-
Оба процесса усиливают друг друга за счет практически необратимого связывания ионов Н+ и ОН- (Н+ + ОН- ↔ Н2О); одновременно протекает гидролиз и по катиону, и по аниону: NH4+ + CH3COO- + HOH ↔ NH4OH + CH3COOH
Так как гидролиз солей – процесс обратимый, то для его описания можно использовать принцип Ле Шателье. Гидролиз солей можно усилить, то есть сместить химическое равновесие процесса гидролиза вправо, путем разбавления раствора соли (увеличением концентрации молекул воды), повышения температуры, уменьшением концентрации продукта гидролиза.
Пример: Опишите поведение в воде соли Al(NO3)3 рассмотрите равновесие в ее растворе при добавлении следующих веществ: а) HNO3, б) NaOH, и) K2SO3. Дайте мотивированный ответ на вопрос: в каких случаях гидролиз нитрата алюминия усилится? Составьте молекулярные и ионно-молекулярные уравнения гидролиза соответствующих солей и укажите рН их растворов.
Ответ: Al(NO3)3 – соль, образованная слабым основанием и сильной кислотой, гидролизуется по катиону. Т.к Al3+ - многозарядный катион, имеет место ступенчатый гидролиз с преимущественным протеканием при обычных условиях по первой ступени:
Al3+ + HOH ↔ AlOH2+ + H+,
В растворе накапливаются ионы Н+, поэтому раствор имеет кислую среду (рН<7).
Рассмотрим равновесие в растворе данной соли при добавлении:
А) HNO3. При этом увеличивается концентрация ионов Н+ и равновесие смещается влево, т.е. гидролиз соли подавляется.
Б) NaOH. При этом ионы ОН-будут связывать имеющиеся в растворе ионы Н+ в малодиссоциирующие молекулы воды (ОН- + Н+ ↔ Н2О) и равновесие гидролиза сместится вправо, в направлении образования продуктов гидролиза, т.е.гидролиз усилится.
В) K2SO3. При этом, вследствие гидролиза этой соли по аниону:
SO32- + HOH ↔ HSO3- + OH-
в растворе накапливаются ионы ОН-, которые как в случае б), приведут к смещению равновесия гидролиза соли Al(NO3)3 вправо, т.е. к усилению ее гидролиза. В этом случае наблюдается случай совместного гидролиза, с образованием конечных продуктов гидролиза обеих солей:
2Al(NO3)3 + 6H2O + 3K2SO3 = 2Al(OH)3 ↓+ 3H2SO3 + 6KNO3
2Al3+ + 6HOH + 3SO32- = 2Al(OH)3↓ + 3H2SO3
Вопросы для самоконтроля:
1. Дать определение электролитам и неэлектролитам, привести примеры.
2. Что является причиной электрической проводимости растворов и расплавов веществ?
3. Каков механизм диссоциации кислот, солей, оснований?
4. Какие реакции называются реакциями ионного обмена?
5. В каком виде записываются реакции ионного обмена?
6. Какие вещества нельзя записывать в виде ионов?
Задания для самостоятельной работы:
Задание№1. Составьте возможные уравнения электролитической диссоциации веществ в водных растворах. Основываясь на составленных схемах, дайте определение кислотам с точки зрения ТЭД.
HCI; HNO3; H2SiO3
Задание№2. Составьте возможные уравнения электролитической диссоциации веществ в водных растворах. Основываясь на составленных схемах, дайте определение основаниям с точки зрения ТЭД
NaOH; KOH; Fe(OH)2
Задание№3. Составьте возможные уравнения электролитической диссоциации веществ в водных растворах. Основываясь на составленных схемах, дайте определение солям с точки зрения ТЭД.
NaCI; KNO3; BaSO4
Задание№4. Напишите уравнения электролитической диссоциации азотной и азотистой кислот. В чём различие процессов электролитической диссоциации сильных и слабых электролитов? В каком уравнении необходимо поставить знак равенства, а в каком — знак обратимости?
Задание №5. Допишите уравнения реакций в молекулярном виде. Составьте ионные уравнения этих реакций.
1.MgCl2 + NaOH  …;
…;
2. К2CO3 + HNO3  …;
…;
3. Ba(OH)2 + HCl  ….
….
Задание №6. Составьте уравнения ионного обмена в молекулярной, полной ионно-молекулярной и сокращенной ионно-молекулярной форме между следующими веществами:
ВаCl2+H2SO4→
ВаCl2+К2CrO4→
AgNO3+KBr→
AgNO3+NaCl→
Задание№7 Подготовьте опорный конспект на тему: «Гидролиз в природе».
Приведите по 2 примера гидролиза солей, которые основаны:
- сильным основанием и слабой кислотой;
- сильной кислотой и слабым основанием;
- слабым основанием и слабой кислотой;
- сильным основанием и сильной кислотой.
Задание№8 Какие из солей: Al2(SO4)3, K2S, Pb(NO3)2, KCl – подвергаются
гидролизу? Составьте ионные и молекулярные уравнения гидролиза соответствующих солей.
Список рекомендуемой литературы:
1. Пустовалова Л.М., Никанорова И.Е.Неорганическая химия. Ростов-н/Д. Феникс, 2005
2. Бабков, А.В. Общая и неорганическая химия [Текст]: учебник / А.В. Бабков, Т.И. Барабанова, В.А. Попков. – М.: ГЭОТАР-Медиа, 2014. – 384 с.
3. Егоров А.С. Химия. Пособие-репетитор для поступающих в вузы. – Ростов н/Д, Феникс, 2007
4. Саенко, О.Е. Химия для колледжей [Текст]: учебник / О.Е. Саенко. – Ростов н/Д: Феникс, 2012. – 282с.
5. Н.П. Глинка. Общая химия. – М.: Интеграл-Пресс, 2008






