Химические реакции по направлению их протекания можно разделить
Необратимые реакции протекают только в одном направлении (реакции ионного обмена с ↑, ↓, мдс, горения и некоторые др.)
Например, AgNO3 + HCl → AgCl↓ + HNO3
Обратимые реакции при одних и тех же условиях протекают в противоположных направлениях (↔).
Например, N2 + 3H2 ↔ 2NH3
Состояние обратимой реакции, при котором υ→ = υ← называетсяхимическимравновесием.
Химическое равновесие – динамическое.
Чтобы реакция на химических производствах проходила как можно полнее, необходимо сместить равновесие в сторону продукта. Для того, чтобы определить, как тот или иной фактор изменит равновесие в системе, используют принцип Ле-Шателье (1844 г.):
Если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить t, р, С), то равновесие сместится в ту сторону, которая ослабит это воздействие.
Равновесие смещается:
1) при ↑ Среаг равновесие смещается в сторону прямой реакции (→),
при ↑ Спрод равновесие смещается в сторону обратной реакции (←);
2) при ↑ p (для газов) - в сторону уменьшения объема,
при ↓ р – в сторону увеличения V;
если реакция протекает без изменения числа молекул газообразных веществ, то давление не влияет на равновесие в данной системе.
3) при ↑ t – равновесие смещается в сторону эндотермической реакции (- Q),
при ↓ t – равновесие смещается в сторону экзотермической реакции (+ Q).
Катализатор не смещает равновесие, но ускоряет его достижение.
Задания для самоконтроля:
1.Понятие о химической реакции.
2.Типы химических реакций, их классификация.
3. Реакции, идущие с изменением состава веществ:
-по числу и характеру реагирующих и образую щихся веществ (разложения, соединения, замещения, обмена);
-по изменению степеней окисления элементов (окислительно-восстановительные и не окислительно-восстановительные реакции);
-по тепловому эффекту (экзо- и эндотермические);
-по фазе (гомо- и гетерогенные);
-по направлению (обратимые и необратимые);
-по использованию катализатора (каталитические и некаталитические).
Примеры решения задач
Скорость химической реакции измеряется количеством молей продукта реакции, образующимися в единицу времени.
Скорость химической реакции зависит от различных внешних условий, но чаще всего приходится влиять на неё, изменяя концентрации реагирующих веществ. Зависимость между скоро-стью химической реакции и концентрацией веществ, участвующих в ней, выражается законом действия масс. Этот закон предложен Гульдбергом и Вааге. Он читается так: скорость химической реакции пропорциональна произведению концентрации реагирую-щих веществ.
Если в реакции участвует m молей вещества Аиn молей вещества В, то скорость реакции v будет равна:

где: [A] и [B] – соответственно концентрации веществ А и В, выраженные в молях; k – коэффициент пропорциональности.
Этому закону достаточно точно следуют только реакции, протекающие в гомогенной среде – между газами или веществами в растворах. В случае же реакций, протекающих в гетерогенной среде, можно приближённо считать, что их скорость пропорциональна только концентрации вещества, которое находится в растворённом или газообразном состоянии.
Пример 1. Написать выражение закона действия масс для
следующих реакций:
а) H2 + Br2 = 2HBr
б) Na2S2O3 + 2HCl = 2NaCl + SO2 + S + H2O
в) C + O2 = CO2
Решение
а) 
б) 
в) 
Закон действия масс позволяет решать вопрос о том, как изменяется скорость реакции при изменении концентрации всех или некоторых веществ, участвующих в них.
Пример 2. Как изменится скорость химической реакцииА+2В  2Е+D, если концентрацию вещества А увеличить в 2, а В – 4 раза?
2Е+D, если концентрацию вещества А увеличить в 2, а В – 4 раза?
Решение
Обозначим константу скорости реакции через k, а концентрацию вещества А через x, концентрацию В через y, скорость реакции до изменения концентрации через 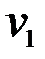 , после изменения через
, после изменения через  . Тогда:
. Тогда:


Разделив  на
на 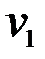 , получим:
, получим: 

Ответ: скорость реакции увеличится в 32 раза.
Пример 3. Константа равновесия реакции А+В  Е+D равна 9. Определить концентрации продуктов реакции Е+D после установления равновесия, если концентрации исходных веществ были А=1 М, В=1 М.
Е+D равна 9. Определить концентрации продуктов реакции Е+D после установления равновесия, если концентрации исходных веществ были А=1 М, В=1 М.
Решение
Пишем уравнение реакции. Сверху над формулами вещества показываем их исходные концентрации, а внизу – концентрации при установившемся равновесии, обозначив неизвестные концент-рации через х:


Подставив величины всех концентраций в уравнение закона химического равновесия, получим:


Преобразуем: 8 х 2 – 18 х + 9 = 0.
Решая это уравнение, получим два значения концентрации х1 и х2
х1 =1,5 М, х2 =0,75 М
Имея по одному молю исходных веществ А и В нельзя получить больше одного моля Е и D. Следовательно, значение х1 не удовлетворяет условию задачи, а действительным ответом будет значение х2.
Пример 4. В реакции CH3OH+H2SO4  (CH3)2SO4+2H2O концент-рация метилового спирта – 2 моль/л, серной кислоты 1 моль/л. После установления равновесия концентрация диметилсульфата стала 30% от исходной концент-рации метилового спирта. Определить К.
(CH3)2SO4+2H2O концент-рация метилового спирта – 2 моль/л, серной кислоты 1 моль/л. После установления равновесия концентрация диметилсульфата стала 30% от исходной концент-рации метилового спирта. Определить К.
Решение
1. Константу диссоциации можно определить по формуле:
 ,
,
где в квадратных скобках – равновесные концентрации веществ.
2. Напишем уравнение реакции с указанием исходных концентра-
ций веществ, вступающих в реакцию:

3. Рассчитаем равновесные концентрации исходных и полученных
веществ:
по условию равновесная концентрация (СН3)2SО4 составляет 30%
от исходной концентрации метилового спирта, т.е.

Согласно уравнению, воды получается в 2 раза больше, чем
диметилсульфата, т.е. [H2O]равн. = 0,6·2 = 1,2 моль/л.
По реакции также рассчитаем равновесные концентрации
метилового спирта и серной кислоты:
[H2SO4]равн. = 1 – 0,6 = 0,4 моль/л
[CH3OH]равн. = 2 – (0,6·2) = 0,8 моль/л
4. Подставим равновесные концентрации в выражение константы:


Задания для самостоятельной работы:
Дайте обоснованные ответы на следующие вопросы:
1. В какую сторону сместится химическое равновесие в системе
N2(г)+3H2(г) ↔ 2NH3(г), если уменьшать давление?
2. В какую сторону сместится химическое равновесие в системе
H2O + CO2 ↔ H2CO3, если увеличивать концентрацию CO2?
3. В какую сторону сместится химическое равновесие в системе
CaCO3(т) + Q ↔ CaO(т) + CO2(г), если ее охлаждать?
4. Составить таблицу: «Сравнительная характеристика химических реакций».
5. Упражнения по определению типа химических реакций. Работа с учебником.
6.Химическая реакция протекает в растворе, согласно уравнению: А+В=С. Исходные концентрации: вещества А – 0,80 моль/л, вещества В – 1,00 моль/л. Через 20 минут концентрации вещества А снизилась до 0,74 моль/л.
Определите: а) среднюю скорость реакции за этот промежуток времени; б) концентрацию вещества В через 20 минут
7.Определите, как изменяется скорость некоторой реакции: а) при повышении температуры от 10 0С до 50 0С; б) при понижении температуры от 10 0С до 0 0С.
Температурный коэффициент реакции равен 3.
Подготовьте доклад, реферат или презентацию на тему:
· «Химические реакции как основа жизнедеятельности живых организмов»;
· «Биологические катализаторы – ферменты»;
Список рекомендуемой литературы:
1. Пустовалова Л.М., Никанорова И.Е.Неорганическая химия. Ростов-н/Д. Феникс, 2005
2. Бабков, А.В. Общая и неорганическая химия [Текст]: учебник / А.В. Бабков, Т.И. Барабанова, В.А. Попков. – М.: ГЭОТАР-Медиа, 2014. – 384 с.






