Наиболее важные фармакокинетические параметры при выборе режима дозирования - клиренс (мера способности организма элиминировать ЛС) и объём распределения (мера кажущегося пространства в организме, способного вместить ЛС).
Объём распределения Vd (л, л/кг) - гипотетический объём жидкости организма, необходимый для равномерного распределения всего количества ЛС (введённой дозы) в концентрации, аналогичной концентрации в плазме крови. При внутривенном введении:
 где С0 - начальная концентрация препарата в крови.
где С0 - начальная концентрация препарата в крови.
Высокие значения объёма распределения свидетельствуют о том, что препарат активно проникает в биологические жидкости и ткани. Если препарат активно связывается, например, жировой тканью, его концентрация в крови может практически мгновенно стать очень
низкой, а объём распределения достигнет нескольких сотен литров, превысив реальный объём жидкостей организма. В связи с этим его ещё называют «кажущийся объём распределения». Объём распределения зависит от различных факторов: физико-химические свойства препарата (молекулярная масса, уровень ионизации и полярности, растворимость в воде и жирах), физиологические факторы (возраст, пол, общее количество жира в организме). Например, у пожилых людей и новорождённых объём распределения снижен. Объём распределения изменяется при некоторых патологических состояниях, особенно при заболеваниях печени, почек, сердечно-сосудистой системы и т.д.
Объём распределения используют при подборе режима дозирования для расчёта НД (нагрузочная доза), требуемой для достижения необходимой концентрации препарата в крови:
 где С - эффективная концентрация ЛС в крови.
где С - эффективная концентрация ЛС в крови.
Общий клиренс Cl (мл/мин, л/ч) - объём плазмы или крови, который полностью очищается от препарата за единицу времени. В рамках линейной модели:
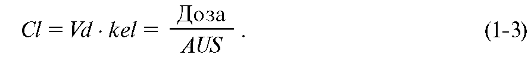 В связи с тем, что основные пути выведения - почки и печень, общий клиренс представляет собой сумму почечного и печёночного клиренсов. Под печёночным клиренсом подразумевают метаболический клиренс в печени и выведение препарата с желчью. Например, почечный клиренс циметидина составляет около 600 мл/мин, метаболический - 200 мл/мин и желчный - 10 мл/мин, следовательно, общий клиренс равен 810 мл/мин. Другие пути выведения или вне- печёночный метаболизм не имеют существенного практического значения и при расчёте общего клиренса их во внимание обычно не принимают.
В связи с тем, что основные пути выведения - почки и печень, общий клиренс представляет собой сумму почечного и печёночного клиренсов. Под печёночным клиренсом подразумевают метаболический клиренс в печени и выведение препарата с желчью. Например, почечный клиренс циметидина составляет около 600 мл/мин, метаболический - 200 мл/мин и желчный - 10 мл/мин, следовательно, общий клиренс равен 810 мл/мин. Другие пути выведения или вне- печёночный метаболизм не имеют существенного практического значения и при расчёте общего клиренса их во внимание обычно не принимают.
Основные физиологические факторы, определяющие клиренс, - функциональное состояние основных физиологических систем организма, объём притока крови и скорость кровотока в органе. Для пече-
ни клиренс определяют по скорости печёночного кровотока или функциональной способности метаболизирующих ферментов. Например, клиренс лидокаина, который интенсивно метаболизируется ферментами печени, зависит, прежде всего, от скорости его доставки к печени, т.е. от объёма притекающей крови, скорости кровотока. Именно поэтому при снижении печёночного кровотока в результате застойной сердечной недостаточности клиренс лидокаина уменьшен. В то же время клиренс фенотиазинов зависит в основном от функционального состояния метаболизирующих ферментов, поэтому при поражении гепатоцитов клиренс препаратов резко снижается, их концентрация в крови значительно возрастает.
Константа скорости элиминации kel (ч-1) - процент снижения концентрации вещества за единицу времени (отражает долю препарата, выводимую из организма за единицу времени).
Общий клиренс, объём распределения и константа элиминации связаны между собой уравнением:
 Период полувыведения Tl/2 (ч) - время, необходимое для снижения концентрации в плазме крови на 50%:
Период полувыведения Tl/2 (ч) - время, необходимое для снижения концентрации в плазме крови на 50%:
 Практически за один период полувыведения из организма выводится 50% ЛС, за два периода - 75%, за три периода - около 87% и т.д.
Практически за один период полувыведения из организма выводится 50% ЛС, за два периода - 75%, за три периода - около 87% и т.д.
Зависимость между периодом полуэлиминации и константой скорости элиминации важна для выбора интервала между дозами, а также для определения промежутка времени, необходимого для достижения равновесной концентрации (обычно 5-7 Tl/2) при многократном введении ЛС.
Если ЛС вводят в постоянной дозе через фиксированные интервалы времени, меньшие, чем время элиминации препарата, то его концентрация в крови возрастает, а затем наступает период, когда в каждом интервале между приёмом очередных доз ЛС количество всасывающегося препарата равно количеству элиминируемого. Это состояние называется «стационарное», или Steady state, а концентрация, достиг-
нутая при этом, - «стационарная» (реже - «равновесная»), - Css. В результате концентрация ЛС колеблется в пределах средней величины с определёнными максимальными (Cssmax) и минимальными значениями (Cssmin) концентрации препарата.
Именно при установлении стационарной концентрации проявляется в полном объёме клинический эффект препарата. Чем короче период полувыведения соединения, тем скорее достигается равновесная концентрация и тем выраженнее будут её колебания. Например, прокаинамид имеет период полувыведения около 2-3 ч и его равновесная концентрация характеризуется большим разбросом значений при его назначении через каждые 6 ч, поэтому для предупреждения и уменьшения указанных колебаний равновесной концентрации в крови в последнее время всё шире используют препараты с замедленным высвобождением.
На практике равновесную концентрацию ЛС можно вычислить по концентрации данного препарата после однократного введения:
 где τ - интервал времени между дозами.
где τ - интервал времени между дозами.
При расчёте дозы, необходимой для поддержания нужной концентрации ЛС в крови, так называемой поддерживающей дозы, используют значение клиренса:
 При внесосудистом введении препарата по естественным причинам не всё его количество достигает системного кровотока.
При внесосудистом введении препарата по естественным причинам не всё его количество достигает системного кровотока.
Биодоступность F (%) - часть дозы препарата, достигшая системного кровотока, после его внесосудистого введения.
Биодоступность бывает абсолютной и относительной, и определяют её как отношение значений «площади под кривой» (AUC). Когда данные о внесосудистом введении препарата сравнивают с данными того же препарата при его внутривенном введении, то получают абсолютную биодоступность:
 Когда сравнивают два внесосудистых пути введения, то говорят об относительной биодоступности (подробнее см. раздел «Исследования биоэквивалентности»).
Когда сравнивают два внесосудистых пути введения, то говорят об относительной биодоступности (подробнее см. раздел «Исследования биоэквивалентности»).
Необходимо отметить, что на практике врачу, как правило, не требуется рассчитывать значения основных фармакокинетических параметров, так как их приводят в Инструкции по применению на ЛС (а также в различных справочниках по ЛС). Однако врач должен уметь с их помощью грамотно подобрать режим дозирования конкретному пациенту с целью повышения эффективности и безопасности фармакотерапии (табл. 1).

БИЛЕТ 49
Рациональное использование лекарственных средств. Определение. Факторы, определяющие рациональность фармакотерапии.
Рациональное использование лекарственных средств, по определению ВОЗ, состоит в применении лекарственных средств согласно клиническим показаниям, в дозах, соответствующих индивидуальным потребностям пациента, в течение адекватного периода времени и по минимальной цене для больного и общества. Тем не менее, по данным ВОЗ, во всем мире более 50% всех лекарственных средств выписывается или продается без соблюдения необходимых условий, а более 50% пациентов применяют лекарства, не соблюдая правил. Кроме того, 1/3 населения Земли не имеет доступа к основным лекарственным средствам.
Основные факты
- Более 50% всех лекарств назначаются, отпускаются или продаются ненадлежащим образом, и каждый второй пациент принимает лекарства неправильно.
- Чрезмерное, недостаточное или неправильное использование лекарств наносит вред людям и приводит к расточительному расходованию ресурсов.
- Более 50% всех стран не проводят основную политику по стимулированию рационального использования лекарств.
- В развивающихся странах менее 40% пациентов государственного сектора и 30% пациентов частного сектора проходят лечение в соответствии с клиническими руководящими принципами.
- На улучшение использования лекарственных средств эффективно влияет сочетание таких мер, как образование и контролирование поставщиков медицинских услуг, просвещение потребителей и надлежащие поставки лекарственных средств, в то время как любая из этих мер в отдельности оказывает ограниченное воздействие.
Рациональное использование лекарственных средств подразумевает правильное, соответствующее и надлежащее использование лекарственных средств. Рациональное использование означает, что пациенты получают надлежащие лекарственные препараты в правильных дозировках, на соответствующий период времени и по самой низкой стоимости для них и их сообщества.






