
|
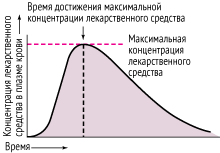
Концентрация лекарственного препарат в плазме крови возрастает с увеличением степени абсорбции; максимальные значения показателя достигаются, когда скорость элиминации соответствует скорости абсорбции. Определение биодоступности, основанное на оценке максимальной концентрации в плазме крови, может быть ошибочным, поскольку выведение лекарственного средства начинается сразу, как только оно попадает в кровоток. Время достижения максимальной концентрации – наиболее широко используемый показатель скорости абсорбции: чем медленнее абсорбция, тем позже регистрируется пик концентрации.
Биодоступность препаратов, выводимых в неизмененном виде с мочой, можно оценить путем измерения общего количества лекарственного вещества, экскретируемого после однократного введения. В идеале моча собирается на протяжении 7–10 периодов полувыведения для оценки полной элиминации лекарственного препарата. После многократного приема и достижения равновесного состояния биодоступность можно оценивать путем измерения количества неизмененного лекарственного вещества, обнаруживаемого в моче за 24-часовой период.
На биодоступность лекарства влияют:
1)Путь введения лекарства. Например у в/в пути введения биодоступность почти 100%. А вот у перорального пути введения той же самой дозы лекарства она сравнительно очень низкая, т.к. лекарство выраженно разрушается при прохождении через ЖКТ и конечная концентрация в крови очень невысокая.
2) Абсорбция лекарства. Лучше преодолевают мембраны на пути поступления в кровь молекулы липофильных лекарств. А вот молекулы гидрофильных соединений плохо преодолевают мембраны и в крови, вследствие этого, могут создавать невысокие концентрации.
3) Аффинитет к белкам плазмы. Более биодоступными являются лекарства с низким аффинитетом к белкам плазмы и наоборот, менее биодоступны лекарства с высоким аффинитетом к белкам плазмы крови.
Биодоступность лекарства может быть абсолютной и относительной.
Абсолютная биодоступность - величина, характеризующая долю поглощенного организмом лекарства при внесосудистом введении, по отношению к его количеству после в/в введения этого же препарата в той же самой дозе.
Относительная биодоступность - величина, определяющая относительную степень всасывания лекарственного вещества из испытуемого препарата, по отношению к всасыванию лекарственного вещества из препаратов сравнения.
БИЛЕТ 57
Объём распределения лекарственных средств. Факторы, влияющие на объём распределения.
Объем распределения (Vd) — гипотетический объем жидкостей, который необходим при равномерном распределении лекарственного вещества во всех частях организма для создания концентрации (Со) в нем, равной таковой в плазме крови в конце внутривенного введения определенной дозы (D) вещества при условии его мгновенного распределения.
Vd = D/Co (3)
Сo называют кажущейся начальной кон центрацией препарата. Это концентрация, которая получилась бы при мгновенном распре делении внутривенно введенного препарата по органам и тканям в одночастевой модели, или в объеме центральной камеры (кровь и моментально обменивающиеся с ней препаратом ткани и органы) в многочастевой фармакокинетической модели.
Величину Сo можно получить, продолжив на графике, начальный отрезок кривой до пересечения с вертикальной осью графика. Существует также понятие о стационарной концентрации (steady state concentration — Css) в плазме крови. Так определяют концентрацию, которая устанавливается в крови при поступлении лекарства в организм с постоянной скоростью. При прерывистом введении препарата существуют Сss max — после очередного введения лекарства и Сss min — перед очередным введением.
Если в формулу (3) подставлять всю дозу вещества, введенного в организм больного, выражая ее, например, в миллиграммах, а концентрацию Сo, подставляя в формулу, выражать в миллиграммах на литр, то объем распределения будет выражаться в литрах и укажет на общий объем жидкости, необходимый для распределения всего введенного количества вещества при концентрации Сo:
Vd= D (мг)/Co (мг/л); мг*л/мг=л (3а)
При подстановке в формулу (3) дозы лекарства, выраженной в единицах массы (например, в миллиграммах) на 1 кг массы тела больного, мы получим величину удельного объема распределения (∆d), выражающегося в литрах на килограмм.
Объем распределения лекарственных средств колеблется в широких пределах в зависимости от степени связывания с белками плазмы и тканей, коэффициента распределения препарата между липидной и водной фазами и других факторов. На объем распределения влияют возраст, пол, состав тела, патологические достояния.
Источник: http://sportwiki.to/%D0%A0%D0%B0%D1%81%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D0%B5%D0%BD%D0%B8%D0%B5_%D0%BB%D0%B5%D0%BA%D0%B0%D1%80%D1%81%D1%82%D0%B2%D0%B5%D0%BD%D0%BD%D1%8B%D1%85_%D1%81%D1%80%D0%B5%D0%B4%D1%81%D1%82%D0%B2#.D0.9E.D0.B1.D1.8A.D0.B5.D0.BC_.D1.80.D0.B0.D1.81.D0.BF.D1.80.D0.B5.D0.B4.D0.B5.D0.BB.D0.B5.D0.BD.D0.B8.D1.8F
бъем распределения зависит от многих факторов (молекулярная масса ЛС, его ионизация и полярность, растворимость в воде и жирах). Возраст, пол, беременность пациентов, общее количество жира в организме также влияют на величину объема распределения. Объем распределения изменяется при некоторых патологических состояниях, особенно при заболеваниях печени, почек и сердечнососудистой системы.
БИЛЕТ 56
Биоэквивалентность лекарственных средств. Клиническое значение
Биоэквивалентность (фармакокинетическая эквивалентность) — степень подобия фармацевтически эквивалентного лекарственного средства по отношению к референтному препарату (обычно — дженерика к оригинальному патентованному средству). Определяется экспериментально, in vivo. Основные критерии биоэквивалентности — степень и скорость всасывания лекарства, время достижения максимальной концентрации в крови и её значение, характер распределения препарата в тканях и жидкостях организма, тип и скорость выведения препарата.
Выделяют также фармацевтическую биоэквивалентность, которая рассматривается, как полное воспроизведение препаратом-дженериком состава и лекарственной формы оригинального лекарственного препарата.
В связи с этим исследования биоэквивалентности имеют большое фармацевтическое, экономическое и клиническое значение. Проведение исследований биоэквивалентности позволяет производителю лекарственного средства не проводить широкомасштабные и дорогостоящие клинические исследования, что существенно сокращает сроки регистрации и выведения на рынок препарата, а так же снижает затраты на проведение исследований.
Биоэквивалентность изучается на здоровых добровольцах или, в некоторых случаях, на пациентах с определенным заболеванием. Число добровольцев зависит от вариабельности фармакокинетических параметров конкретного лекарственного средства, но должно быть не менее 12 человек.
Препаратом сравнения в исследовании биоэквивалентности должен выступать соответствующий оригинальный препарат, зарегистрированный в РФ, или его аналог, широко применяющийся в РФ. Содержание действующего вещества в испытуемом препарате и препарате сравнения не должно отличаться более чем на 5 %. Исследуемые лекарственные средства вводятся в одинаковых дозировках. Биоэквивалентность гарантирует обеспечение аналогичного терапевтического эффекта дженерика по сравнению с оригинальным лекарственным препаратом
БИЛЕТ 55
Пути введения лекарственных средств. Зависимость эффективности и безопасности лекарственных средств от пути введения.






