Управление степенью дисперсности.
Процесс образование новой фазы и степень её дисперсности определяется соотношением скоростей образования  и роста зародышей
и роста зародышей  . Часто регулятором пересыщения в системе выступает температура, т.к. это наиболее удобный путь. В высокотемпературной метастабильной зоне зародыши не образуются (малы пересыщения), но если зародыши внести извне, то фаза расти может (выращивание монокристаллов). При определённой температуре скорость роста будет максимальной (высокая скорость диффузии и оптимальные пересыщения). Затем с уменьшением Т возрастает вязкость и
. Часто регулятором пересыщения в системе выступает температура, т.к. это наиболее удобный путь. В высокотемпературной метастабильной зоне зародыши не образуются (малы пересыщения), но если зародыши внести извне, то фаза расти может (выращивание монокристаллов). При определённой температуре скорость роста будет максимальной (высокая скорость диффузии и оптимальные пересыщения). Затем с уменьшением Т возрастает вязкость и 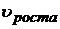 уменьшается (уменьшается доставка вещества). Однако, при этом увеличивается также пересыщение γ, а значит появляются условия образования центров конденсации. Скорость их образования тоже будет иметь максимум, а с дальнейшим уменьшение температуры
уменьшается (уменьшается доставка вещества). Однако, при этом увеличивается также пересыщение γ, а значит появляются условия образования центров конденсации. Скорость их образования тоже будет иметь максимум, а с дальнейшим уменьшение температуры  будет уменьшаться из-за сильного увеличения вязкости и затруднениями в конденсации частиц.
будет уменьшаться из-за сильного увеличения вязкости и затруднениями в конденсации частиц.
Варианты соотношения 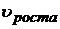 и
и  :
:
Максимумы на зависимостях 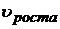 и
и  близки – вещество кристаллизуется легко (металлы).
близки – вещество кристаллизуется легко (металлы).
Максимумы удалены – система переохлаждается и может переходить в стеклообразное состояние не кристаллизуясь (стекло)
При перекрывании кривых 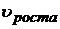 и
и  можно получить вещества как в кристаллическом, так и в стеклообразном состоянии (S, Se)
можно получить вещества как в кристаллическом, так и в стеклообразном состоянии (S, Se)
Сильное возрастание вязкости с уменьшение температуры уменьшает 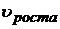 и
и  (глицерин легко переохлаждается)
(глицерин легко переохлаждается)
Смеси веществ кристаллизуются хуже (уменьшение вероятность концентрирования однородных атомов и молекул)
Быстрое переохлаждение приводит к стеклообразному состоянию, наличие инородных ядер уменьшает этот процесс (металлы и алмаз).
Управление степенью дисперсности.
Для получения высокодисперсных систем:
1. необходимо обеспечить высокую скорость образования зародышей и малую скорость их роста (создавать высокие пересыщения ПИ/ПР);
2. увеличить вязкость дисперсной среды;
3. ввести в систему ПАВы, адсорбирующиеся на поверхности зародышей и тормозящие их рост;
4. используют вещества с малой растворимостью; это даёт высокую степень пересыщения.
Для получения грубодисперсной системы (крупные частицы)
1. создать небольшие пересыщения (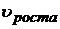 большая,
большая,  мало)
мало)
2. использовать вещества с высокой растворимостью (γкр- мало)
Для получения полидисперсной системы:
повышают длительность процесса осаждения во времени.
Для получения монодисперсной системы
уменьшают время образования зародышей и их роста.
Двойной электрический слой.
Механизм его образования.
Стремление гетерогенной системы к уменьшению поверхностной энергии вызывает определенное ориентирование полярных молекул, ионов, электронов в поверхностном слое. Вследствие этого соприкасающиеся фазы приобретают заряды противоположного знака, но равной величины. Так возникает на поверхности двойной электрический слой (ДЭС). Он имеет свой потенциал φ, заряд q, ёмкость С.
Различают три возможных механизма образования двойного электрического слоя:
1. Поверхностная ионизация – переход ионов, электронов из одной фазы в другую. Например с поверхности металла в газовую фазу переходят электроны, образуя со стороны газовой фазы электронное облако. Количественная характеристика процесса – работа выхода. В результате поверхность металла приобретает положительный заряд, а газовая фаза отрицательный – возникает ДЭС.
В воде на поверхности частиц АgJ может образовываться ДЭС по следующему механизму: при растворении АgJ в воду преимущественно переходят Аg+, т.к. они сильнее гидратируются. В результате поверхность АgJ будет приобретать избыточный отрицательный заряд за счёт J- (потенциал определяющий ион), который будет нейтрализовываться ионами Аg+ (противоионами). При добавлении в раствор соли АgNO3 возрастает электрохимический потенциал Аg+. Потенциал определяющий ион и противоионы поменяются местами. Для определения заряда поверхности используют правило Фаянса-Панета, согласно которому структуру кристаллической решётки могут достраивать только те ионы, которые входят в её состав.
2. ДЭС может образовываться за счёт избирательной адсорбции в межфазном слое ионов, электронов, не входящих в состав вещества, т.е. примесей. Так добавка в систему металл-вода раствора NaCl приводит к избирательной адсорбции Cl` – ионов на поверхности металлов. Появляется избыточный отрицательный заряд на поверхности металла, который компенсируется Na+ в близлежащем слое раствора. Таким образом на межфазной поверхности также произойдет образования ДЭС.
3. Если межфазная поверхность образованна веществами не способными обмениваться зарядами, то ДЭС может образовываться в результате ориентирования полярных молекул сопряжённых фаз в результате их взаимодействия. По этому механизму образуется ДЭС при адсорбции недиссоциируемых полярных молекул из раствора. Для определения знака заряда на поверхности в безэлектролитном растворе работает правило Кёна: из двух соприкасающихся фаз положительно заряжается та, которая имеет большую ε (диэлектрическую проницаемость). Поэтому все недиссоциируемые вещества, находящиеся в контакте с водой, имеющей большую ε заряжаются отрицательно.
Строение ДЭС.
Представление о строение ДЭС за последние сто лет истории претерпели принципиальные изменения.
Предположения об его образовании сделал Квинки. Гельмгольц и Перрен представляли его строение по аналогии со строением плоского конденсатора. Предполагалось, что на границе соприкасающихся фаз заряды располагаются в виде двух рядов разноимённых ионов. Толщина слоя считалась близкой к размерам молекул или сольватированных ионов. На этом расстоянии потенциал ДЭС уменьшался до 0. Поверхностный заряд определяется в соответствии с теорией плоского конденсатора.
Однако, такое строение возможно без учёта теплового движения ионов.
Независимо друг от друга Гюи и Чепмен предположили строение ДЭС с учётом теплового движения частиц. По их мнению все противоионы будут рядом с потенциал - определяющими ионами только при 273 К. При более высоких температурах из-за кинетической энергии ионов они располагаются неупорядочено, образуя размытую диффузную структуру.
Современная теория строения ДЭС предложена лауреатом Нобелевской премии Штерном. Она объединяет обе предыдущие теории: слой противоионов состоит из двух частей: вблизи поверхности есть адсорбционный слой Гельмгольца, толщиной δ не более диаметра гидратированных ионов; далее находится диффузный слой Гюи, толщиной λ с потенциалом φ δ, зависящем от свойств и состава системы. Т.к. противоионы в диффузной части распределены неравномерно, то j его изменяется нелинейно. Заряд ДЭС может быть определен как сумма:
qДЭС = qδ + qλ, где qδ и qλ – заряды на межфазной поверхности и границе слоя Гельмгольца.
Гуи и Чепмен предположили, что в диффузной части ионы в результате теплового движения распределяются в соответствии с законом Больцмана. В результате было выведено уравнение, определяющее связь ДЭС с расстояние от поверхности (уравнение Гуи-Чепмена).
При φ д.э.с.<<25мВ
φ х = φ δе-х/λ, при х = λ, φ х = φ δ/е,
За толщину диффузной части ДЭС берется расстояние, на котором φ уменьшается в «е» раз (2,7 раза).
Каково же это расстояние? Так для симметрично одновалентного элемента при его концентрациях 10-1, 10-3, 10-5 моль/л, λ=1, 10, 100 нм, т.е.  , и много больше диаметра ионов.
, и много больше диаметра ионов.
На λ оказывают влияние состав раствора, Т, ε (они его повышают), z заряд противоионов (понижает).
Полная электрическая емкость ДЭС выражается как суммарная емкость двух последовательно соединенных конденсаторов  ,
,
В разбавленных растворах сδ >> cλ, отсюда с @ сλ, т.к. δ << λ.




