Может быть молекулярной и ионной. В отличие адсорбции из растворов от адсорбции из газовой фазы в том, что поверхность адсорбата полностью занята молекулами растворителя. Поэтому адсорбция идёт путём вытеснения с поверхности молекул растворителя.
Присутствие в растворе двух компонентов приводит к конкурирующей адсорбции. Избирательность или селективность адсорбента к тому или иному адсорбату определяется величиной сродства компонента к поверхности адсорбента. Избирательность адсорбента зависит от физико-химической природы адсорбата и растворителя. Чем хуже адсорбция растворителя, тем лучшее будет адсорбироваться растворимое вещество. В свою очередь растворитель адсорбируется тем хуже, чем больше его величина поверхностного натяжения. Отсюда:
1. адсорбция лучше из водных растворов, чем из органических;
2. чем лучше растворитель растворяет вещество, тем хуже оно адсорбируется из раствора (правило Шилова);
Экспериментально установлено, что неполярные твёрдые тела лучше адсорбируют неполярные адсорбаты и наоборот.
Согласно правилу полярности Ребиндера – процесс адсорбции идёт в сторону уравнивания полярности фаз и тем сильнее, чем больше разность полярностей исходных веществ.
Так адсорбция ПАВ на синтетических тканях выше, чем на хлопчатобумажных, т.к.  .
.
С увеличением молярной массы вещества адсорбция увеличивается. При ферментативном катализе сложные органические молекулы адсорбируются на ферментах, разлагаются и их мелкие фрагменты уже неконкурентоспособны с крупными молекулами.
Ароматические соединения адсорбируется лучше алифатических.
Непредельные органические соединения адсорбируются лучше предельных.
Адсорбция увеличивается в 3,0-3,5 раза при удлинении углеводородной цепи на одно звено (не для мелкопористых адсорбентов)
Повышение температуры уменьшает адсорбцию.
Еще более сложны закономерности ионной адсорбции.
ü адсорбируются заряженные частицы (ионы, катионы)
ü адсорбция идет только на полярных адсорбентах
ü адсорбция сопровождается образованием ДЭС
ü выражена избирательность адсорбции (катионы, анионы)
ü адсорбция кинетически необратима
ü наличие рядов селективности (рядов Гофмейстера) Li+<Na+<K+; Th4+>>Al3+>>Ca2+>>K+
Коэффициент распределения: 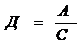 .
.
Коэффициент разделения: 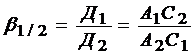 , показывает, во сколько раз отношение величин адсорбции разделяемых компонентов больше отношения их концентраций в объеме.
, показывает, во сколько раз отношение величин адсорбции разделяемых компонентов больше отношения их концентраций в объеме.
Распределение масс разделяемых веществ между фазами характеризуется степенью извлечения  и разделения
и разделения 
 ;
; 






