Очевидно, что такая зависимость должна быть. Межатомные связи с увеличением температуры ослабевают. Из объединенного уравнения I и II начал термодинамики следует:

Пусть p, s, ni, q – const, тогда имеем:  ;
;
 ;
;
для единичной поверхности  ;
;
известно, что  , подставив:
, подставив: 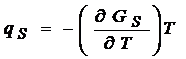 и
и  в уравнение для внутренней энергии, получим
в уравнение для внутренней энергии, получим
 - уравнение Гиббса – Гельмгольца.
- уравнение Гиббса – Гельмгольца.
Уравнение Гиббса-Гельмгольца устанавливает связь σ и 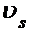 с температурой.
с температурой.
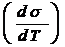 - температурный коэффициент поверхностного натяжения,
- температурный коэффициент поверхностного натяжения,
так как qs всегда больше 0, то  , значит
, значит  ,
,
т.е. с увеличением температуры поверхностное натяжение уменьшается, причём линейно.
При Т=Ткр σ = 0. Так как с увеличением Т поверхностное натяжение уменьшается, а qs увеличивается, то 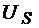 для большинства жидкостей от температуры не зависит. Для
для большинства жидкостей от температуры не зависит. Для 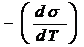 есть таблицы для различных веществ. С его помощью можно определить σ при любой температуре, если известно значения поверхностного натяжения при определенной температуре, т.е.
есть таблицы для различных веществ. С его помощью можно определить σ при любой температуре, если известно значения поверхностного натяжения при определенной температуре, т.е.
 ; где ∆Т = Тт - Т0
; где ∆Т = Тт - Т0
Если 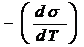 неизвестно, то для определения σ можно использовать полуэмпирические соотношения:
неизвестно, то для определения σ можно использовать полуэмпирические соотношения:
Закон Этвеша: 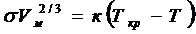 . Здесь Vм – мольный объём;
. Здесь Vм – мольный объём;  - мольная поверхностная энергия.
- мольная поверхностная энергия.
к = 2,1×10-7 (в системе СИ) – для неполярных жидкостей, для полярных жидкостей «к» может быть < 2,1, а для жидкостей с большой мольной массой к >2,1.
 - уравнение Сагдена (эмпирическое соотношение)
- уравнение Сагдена (эмпирическое соотношение)
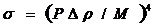 ,
,
Р – парахор (физический смысл - мольный объём с поправкой на эффект сжатия, обусловленный межмолекулярными силами)
∆ρ - разность плотностей
М – мольная масса вещества
Механизм процессов самопроизвольного уменьшения
поверхностной энергии. Принцип Гиббса-Кюри.
Все тела в природе стремятся уменьшить свободную энергию. Это относится и к поверхностной энергии. Создание новой поверхности сопряжено с затратой энергии на разрыв связей. Отсюда предполагается, что обратный процесс должен проходить самопроизвольно: с уменьшением энергии Гиббса. Но G=σS, значит G может быть снижена как за счёт уменьшения σ, так и уменьшения площади межфазной поверхности S.
Уменьшение S может быть обеспечено за счёт изменения формы тела (в невесомости вес тела сферической формы, капли жидкости стремятся приобрести сферическую форму).
Уменьшение σ может быть обеспечено за счёт адсорбции ПАВ, изменение заряда поверхности q.
Вывод: структура поверхностного слоя формируется путём самопроизвольного уменьшения G за счёт уменьшения площади поверхности и поверхностного натяжения σ.
Термодинамически более устойчивой является форма тела, которая обладает минимальной поверхностной энергией (энергией Гиббса), т.е.
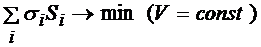 - принцип Гиббса-Кюри
- принцип Гиббса-Кюри
Здесь σi и Si – удельные поверхностные энергии и площади отдельных частей тела.
Принцип позволяет провести границу между твёрдым и жидким состояниями вещества. В связи с изотропностью жидкостей (σ во всех точках жидкости постоянно). Отсюда для жидкостей:
 ,
,
т.е. термодинамические устойчивой является форма тела с минимальной поверхностью при 
Для твёрдых тел из-за анизотропии их свойств всё сложнее. Так для монокристалла термодинамически устойчивой является форма, где
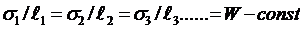 Вульфа;
Вульфа;
 - расстояние от центра кристалла до грани 1, 2, 3 или
- расстояние от центра кристалла до грани 1, 2, 3 или

На форму кристалла влияет также природа материала.






