Государственное бюджетное образовательное учреждение
Высшего профессионального образования
«Омская государственная медицинская академия»
Министерства здравоохранения Российской Федерации
ХИМИЯ ОБЩАЯ И НЕОРГАНИЧЕСКАЯ
Часть I. Общая химия
Учебное пособие для студентов I курса специальности
060301 – фармация
ОМСК – 2015
УДК 54(076)
ББК 24я73
Р 84
Степанова И.П., Ганзина И.В., Мендубаева З.А., Уварова Т.А. Химия общая и неорганическая. Часть I. Общая химия.: Учебное пособие для студентов I курса специальности 33.05.01 (060301) – фармация.– Омск: Изд-во ОмГМА, 2015. – 106 с.
Авторы: И.П. Степанова, И.В. Ганзина, З.А. Мендубаева, Т.А. Уварова.
Рецензент:
Кандидат химических наук, доцент И.В. Конева – доцент кафедры химии ФГБОУ ВПО ОмГАУ им. П.А. Столыпина.
ISBN
Учебное пособие для подготовки к занятиям дисциплины «Химия общая и неорганическая» включает содержание разделов дисциплины и перечень контролируемых учебных элементов, составленных в соответствии с новой программой ФГОС ВПО, инструкцию по охране труда и технике безопасности для студентов при работе в лабораториях кафедры химии; кодификатор зачетной работы. Пособие содержит методические материалы, включающие теоретическое содержание занятия, типовые обучающие задачи, тестовые задания, вопросы для подготовки к занятиям, контрольные задания к каждой теме. Для подготовки к экзамену по дисциплине «Химия общая и неорганическая» представлены кодификатор и характеристика экзаменационной работы, инструкция по ее выполнению. Учебное пособие предназначено для обучающихся по специальности 33.05.01 (060301) – фармация.
ÓИ.П. Степанова, И.В. Ганзина, З.А. Мендубаева, Т.А. Уварова. 2015
ÓГБОУ ВПО «ОмГМА Росздрава», 2015
| СОДЕРЖАНИЕ | ||
| Предисловие….......................................................................................................................... 1. Тематические разделы дисциплины «Химия общая и неорганическая» | 4 | |
| 1.1. | Растворы. Способы выражения концентрации растворов ….......................... | 6 |
| 1.2. | Введение в титриметрический анализ. Метод нейтрализации ….................. | 14 |
| 1.3. | Оксидиметрия. Перманганатометрия …............................................................ | 24 |
| 1.4. | Элементы химической термодинамики …........................................................ | 30 |
| 1.5. | Энергетика химических процессов …............................................................... | 36 |
| 1.6. | Коллигативные свойства растворов. Осмос …................................................ | 40 |
| 1.7. | Водородный показатель среды растворов – pH …........................................... | 47 |
| 1.8. | Буферные системы ….......................................................................................... | 53 |
| 1.9. | Строение атома…………..…………………………………………………….. | 59 |
| 1.10. | Химическая связь……………………………………………………………… | 68 |
| 1.11. | Комплексные соединения……………………………………………………. | 81 |
| 2. Инструкция по охране труда и пожарной безопасности для студентов при работе в лабораториях кафедры химии………………………………………. Заключение………………………………………………………………………………… Глоссарий…………………………………………………………………………………. Ответы на тестовые задания…………………………………………………………….. Список литературы………………………………………………………………………. Приложения………………………………………………………………………………
| 90 95 96 99 103 104 | |
Предисловие
Учебное пособие дисциплины «Химия общая и неорганическая» рекомендовано обучающимся 1-ого курса специальности 33.05.01 (060301) – фармация Омской государственной медицинской академии в качестве пособия для самостоятельной подготовки к лабораторным занятиям, контрольным работам и экзамену по дисциплине «Химия общая и неорганическая». Содержание учебного пособия соответствует рабочей программе, составленной на основе федерального государственного образовательного стандарта высшего профессионального образования.
Пособие составлено по модульному принципу и является необходимой составной частью учебно-методического комплекса дисциплины «Химия общая и неорганическая».
Учебное пособие включает следующие разделы (части):
- тему и содержание занятий;
- контрольные вопросы и задания;
- инструкцию по технике безопасности при работе в химической лаборатории;
- характеристику зачетной работы и инструкцию по ее выполнению.
Структура занятий включает тему, теоретическое введение (краткий курс теории), типовые задания с анализом их решения, контрольные вопросы (ориентируют студента в самостоятельной работе с литературой, помогают лучше усваивать материал), ситуационные задачи (носят практикоориентированный характер), список литературы (содержит ссылки на соответствующие источники).
Содержание всех компонентов структуры пособия позволит обучающимся закрепить пройденный программный материал и будет способствовать его более глубокому и прочному усвоению.
Медико-биологическая направленность предлагаемых заданий значительно расширит представления первокурсников о тесной связи химии и фармации, а также роли химии в создании новых фармацевтических препаратов.
Обучение по дисциплине «Химия общая и неорганическая» складывается из аудиторных занятий (48 часов), включающих лекционный курс и лабораторные занятия, и самостоятельной работы (24 часа). В соответствии с требованиями ФГОС ВПО в учебном процессе широко используются активные и интерактивные формы проведения занятий.
Лекционный материал подается в форме электронных презентаций, проблемных лекций, лекции-визуализации.
Основное учебное время выделяется на лабораторные практикумы по закреплению знаний и получение практических навыков.
Занятия проводятся в виде семинаров, лабораторных работ с использованием наглядных пособий, решением ситуационных задач, тестовых заданий.
Для организации самостоятельной работы обучающися используются технологии направляющего текста, проблемного обучения, дидактических задач, обеспечивающие дифференцированный подход к обучаемым и возможность организовывать индивидуальную и групповую работу.
Работа с учебной литературой рассматривается как вид учебной работы по дисциплине и выполняется в пределах часов, отводимых на её изучение.
Каждый обучающийся обеспечен доступом к библиотечным фондам Академии и кафедры.
При подготовке к занятию обучающиеся самостоятельно изучают учебную литературу, оформляют домашние задания и рефераты и представляют доклады на конференцию. Самостоятельная работа способствует формированию активной жизненной позиции поведения, аккуратности, дисциплинированности.
Исходный уровень знаний первокурсников определяется тестированием, проверкой выполнения домашнего задания, текущий контроль усвоения предмета определяется устным опросом в ходе занятий, ответами на тестовые задания и контрольные вопросы.
Изучение дисциплины завершается сдачей экзамена. Изучение дисциплины завершается сдачей экзамена. Для подготовки к экзамену представлен кодификатор экзаменационной работы по дисциплине «Химия общая и неорганическая», характеристика и пример экзаменационного билета, инструкция по его выполнению.
1. ТЕМАТИЧЕСКИЕ РАЗДЕЛЫ ДИСЦИПЛИНЫ «ХИМИЯ ОБЩАЯ И НЕОРГАНИЧЕСКАЯ»
РАСТВОРЫ. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ
Учение о растворах представляет для медиков особый интерес, поскольку растворы имеют большое значение в биологии, физиологии, медицине и фармации. Растворами являются биологические жидкости организма: кровь, лимфа, спинномозговая и другие жидкости. Усвоение пищи связано с переходом питательных веществ в растворенное состояние. Биохимические реакции в живых организмах протекают в растворах. Лекарственные вещества эффективны лишь в растворенном состоянии или переходят в растворенное состояние в организме.
Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более компонентов. Каждый из компонентов раствора равномерно распределён между другими по всему объёму раствора в виде молекул, атомов или ионов.
По агрегатному состоянию растворы могут быть газообразными, жидкими и твёрдыми. Компонент, который в данных условиях находится в том же агрегатном состоянии, что и образующийся раствор, считается растворителем, остальные составляющие раствора – растворёнными веществами. Если все компоненты раствора находятся в одном агрегатном состоянии, растворителем считается тот из них, которого в растворе больше.
Важная характеристика раствора – концентрация. Она выражает относительное содержание растворённого вещества в растворителе. Этой величиной определяются многие свойства растворов.
В связи с введением в действие СИ, применяются следующие способы выражения концентрации растворов.
Массовая доля растворённого вещества – отношение массы растворённого вещества к массе раствора.
Wв = mв / mр
Wв – массовая доля растворённого вещества;
mв – масса растворённого вещества (г, кг);
mр– масса раствора (г, кг).
Массовую долю растворенного вещества (W в) обычно выражают в долях единицы или %-ах.
Например, массовая доля растворённого вещества гидроксида натрия NaOH в воде = 0,1 или 10%. Это означает, что в растворе массой 100 г содержится NaOH массой 10 г и вода массой 90 г.
Молярная концентрация – показывает число молей растворенного вещества в одном кубическом дециметре раствора.
С(х) = n(х) / V, [моль/дм3, моль/л, М]
С(х) – молярная концентрация вещества;
n(х) – число моль вещества;
V – объём раствора (дм3, л).
Например, С(NaOH) = 0,1 моль/дм3;
С(H2SO4) = 0,5 моль/дм3;
С(Н+) = 2 ∙10 –2 моль/дм3.
Молярное соотношение реагирующих веществ не всегда равно 1÷1, оно определяется стехиометрическими коэффициентами в уравнении реакции. В связи с этим вводится понятие «химический эквивалент».
Химический эквивалент – реальная или условная частица вещества, которая в обменной реакции эквивалентна одному протону, а в о/в реакции – одному электрону.
В связи с этим понятием вводится ещё один способ выражения концентрации растворов – молярная концентрация эквивалента вещества.
Молярная концентрация эквивалента вещества (нормальная концентрация) – показывает число моль эквивалента вещества в одном дм3 (л) раствора.
Молярную концентрацию эквивалента вещества обозначают С(1/z X) выражают [моль/дм3, моль/л, н].
Выражение 1/ z называется фактором эквивалентности. Он показывает, какая доля реальной частицы вещества соответствует эквиваленту.
В обменных реакциях число z показывает суммарный заряд обменивающихся ионов (в соответствии с уравнением реакции, знак заряда во внимание не принимается), в о/в реакциях – число отданных или принятых электронов.
Важно отметить, что одно и то же вещество может иметь разные эквиваленты в разных химических реакциях, поэтому эквивалент вещества может быть определён только для конкретной реакции. Рассмотрим это на примерах:
1. В реакциях обмена с участием Н2SO4 может происходить замещение одного или двух протонов. В зависимости от этого эквивалент серной кислоты меняется:
а) H2SO4 + NaOH = NaHSO4 + H2O z = 1 => 1/z = 1
б) H2SO4 + 2NaOH = Na2SO4 +2 H2O z = 2 => 1/z = 2
2. В о/в реакциях с участием КМnO4 в зависимости от кислотности среды образуются продукты восстановления, число электронов меняется, поэтому и эквивалент КМnO4 также будет разным:
а) кислая среда
МnO4– + 8Н+ + 5 е → Mn2+ + 4H2O z = 5 => 1/z = 1/5
б) нейтральная среда
МnO4– + 3Н+ + 3 е → MnО2 + 2H2O z = 3 => 1/z= 1/3
в) щелочная среда
МnO4 – + 1 е → MnО42– z = 1 => 1/z = 1
Необходимо быстро и правильно переходить от одного способа выражения концентрации к другому. Полезно запомнить, что С(1/zХ) = z ∙ С(Х)
Если 1/z = 1, то молярная концентрация эквивалента вещества будет равна молярной концентрации. Во всех других случаях она всегда будет больше молярной концентрации во столько раз, во сколько раз эквивалент меньше реальной частицы, т.е.
С(1/zХ): С(Х) = z
Например, молярная концентрация эквивалента раствора Н3РО4 с молярной концентрацией С(Н3РО4) = 0,2 моль/дм3 составляет С(1/3 Н3РО4) = 0,2 · 3 = 0,6 моль/дм3.
Расчёт молярных масс эквивалентов М (1/ z Х) кислот, щелочей солей,
окислителей-восстановителей
Молярная масса эквивалента кислоты есть отношение молярной массы данной кислоты к числу ионов водорода участвующих в реакции:
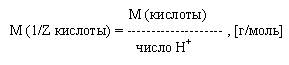
Молярная масса эквивалента основания есть отношение молярной массы основания к числу ионов гидроксила участвующих в реакции:

Молярная масса эквивалента соли есть отношение молярной массы соли к произведению числа атомов металла данной соли на его степень окисления.

Молярная масса эквивалента окислителя или восстановителя есть отношение молярной массы окислителя или восстановителя к числу электронов, отданных или принятых в данной реакции.

Титр – отношение массы растворённого вещества к объёму раствора.
t = m / V, [г/см3]
t – титр раствора;
m – масса растворённого вещества, г;
V – объём раствора.
Например, t(Na2СО3) = 0,00125 г/см3, означает, что в 1см3 раствора содержится 0,00125 г Na2СО3.
Для освоения темы «Способы выражения концентрации растворов» необходимо знать следующие понятия и их обозначения:
mв – масса растворённого вещества (г, кг);
mр – масса раствора (г, кг);
Wв – массовая доля вещества (доля единицы, %);
М(Х) – молярная масса вещества (г/моль, кг/моль);
1/z – фактор эквивалентности (безразмерная величина);
n(Х) – количество вещества (моль);
n(1/zХ) – количество вещества эквивалента (моль);
С(Х) – молярная концентрация (моль/дм3, моль/л);
С(1/zХ) – молярная концентрация эквивалента (моль/дм3, моль/л);
ρ – плотность раствора (г/см3, кг/м);
V – объём раствора (дм3, см3, м);
t – титр раствора (г/см3).
При решении задач полезно пользоваться вышеприведёнными формулами, а также:
mр = ρр ∙ Vр;
n(Х) = m(Х) / М(Х);
m(Х) = С(Х) · М(Х) · V;
m(Х) = С(1/zХ) · М(1/zХ) · V.
Контрольные вопросы
- Растворы: значение и применение.
- Понятие эквивалента. Фактор эквивалентности.
- Расчет молярной массы эквивалента соединений.
- Способы выражения концентрации раствора:
Ø массовая доля растворенного вещества в растворе;
Ø молярная концентрация растворенного вещества в растворе;
Ø молярная концентрация эквивалента вещества в растворе;
Ø титр раствора.
Типовые задачи
Задача 1.Определите молярную концентрацию раствора натрия гидроксида с массовой долей 30%, плотность раствора 1,29 г/см3.
| Дано: | Решение: |
| W(NaOH) = 30 % | 1. Найти массу 1 дм3 раствора: |
| ρр(NaOH) = 1,29 г/см3 | (1 дм3 = 1000 см3) |
| С(NaOH) =? | mр = Vр · ρ р = 1000 · 1,29 = 1290 (г) |
| 2. Найти массу NaOH в 1 дм3 раствора: W(NaOH) · mр 30 · 1290 m(NaOH) = ----------------------- = --------------- = 387 (г) 100 100 | |
| 3. Определить молярную массу натрий гидроксида: M(NaOH) = 23 + 16 + 1 = 40 г/моль | |
| 4. Определить молярную концентрацию раствора натрий гидроксида: m(NaOH) 387 C(NaOH) = -------------------- = ---------- = 9,68 (моль/дм3) M(NaOH) · Vр 40 · 1
| |
| Ответ: С(NaOH) = 9,68 моль/дм3 | |
Задача 2.Какова массовая доля (%) пероксида водорода в растворе, применяемом наружно как кровоостанавливающее и дезинфицирующее средство, если молярная концентрация этого раствора составляет 0,89 моль/дм3, плотность раствора 1 г/см3?
| Дано: | Решение: |
| С(H2О2) = 0,89 моль/дм3 | 1. Найти массу 1 дм3 раствора: |
| ρ р(H2О2) = 1 г/см3 | mр = Vр · ρ р = 1000 · 1 = 1000 (г) |
| --------------------------------- | 2. Определить молярную массу пероксида водорода: |
| W(H2О2) =? | M(H2О2) = 34 г/моль |
| 3. Найти массу H2О2: m(H2О2) = С(H2О2) · М(H2О2) · Vр = 0,89 · 34 · 1 = 30,26 (г) | |
| 4. Найти массовую долю (%) пероксида водорода в растворе: m(H2О2) 30,26 · 100 W(H2О2) = --------------- · 100 = ------------------ · 100 = 3,03 % mр 1000
| |
| Ответ: W(H2О2) = 3,03 % | |
Задача 3.Определите молярную концентрацию эквивалента раствора гептагидрата сульфата магния MgSO4 · 7Н2О, применяемого внутривенно для снижения давления крови, если массовая доля соли в растворе составляет 20 %, плотность раствора 1,22 г/см3.
| Дано: | Решение: |
| W(MgSO4 · 7Н2О) = 20 % | 1. Найти массу 1 дм3 раствора: |
| ρр(MgSO4 · 7Н2О) = 1,22 г/см3 | mр = Vр · ρ р = 1000 · 1,22 = 1220 (г) |
| С(1/z MgSO4 · 7Н2О) =? | |
| 2. Найти массу соли в 1 дм3 раствора: | |
| W(MgSO4 · 7Н2О) · mр 20 · 1220 m(MgSO4 · 7Н2О) = ------------------------------ = -------------- = 244 (г) 100 100 | |
|
3. Определить молярную массу эквивалента соли: M(½ MgSO4 · 7Н2О) = 246/2 = 123 г/моль | |
|
4. Определить молярную концентрацию эквивалента раствора: m(½ MgSO4 · 7Н2О) 244 C(½ MgSO4 · 7Н2О) = ---------------------------------- = ---------- = 1,98 (моль/дм3) M(½ MgSO4 · 7Н2О) · Vр 123 · 1 | |
| Ответ: С(½ MgSO4 · 7Н2О) = 1,96 моль/дм3 | |
Задача 4.Определите титр изотонического раствора натрия хлорида, если в 150 см3 раствора содержится 1,3163 г NaCl.
| Дано: | Решение: |
| Vр(NaСl) = 150 см3 |
m(NaCl) 1,3163 t(NaCl) = -------------- = ------------ = 8,775 · 10 – 3 (г/см3) Vр 150 |
| m(NaCl) = 1,3163 г | |
| t(NaCl) =? | |
| Ответ: t(NaCl) = 8,775 · 10 – 3 г/см3
| |
Задача 5.Определите массовую долю (%) раствора кальция хлорида, применяемого перорально, молярная концентрация эквивалента которого составляет 2 моль/дм3, плотность раствора 1,11 г/см3.
| Дано: | Решение: |
| С(½СаСl2) = 2 моль/дм3 | 1. Найти массу 1 дм3 раствора: |
| ρ р(СаСl2) = 1,11 г/см3 | mр = Vр · ρ р = 1000 · 1,11 = 1110 (г) |
| W(СаСl2) =? | 2. Определить молярную массу эквивалента кальций хлорида: |
| M(½СаСl2) = М(СаСl2): 2 = 111: 2 = 55,5 г/моль | |
| 3. Найти массу кальций хлорида в 1 дм3 раствора: m(СаСl2) = С(½СаСl2) · М(½СаСl2) · Vр = 2 · 55,5 · 1 = 111 (г) | |
| 4. Найти массовую долю (%) кальций хлорида в растворе: m(½СаСl2) 111 W(СаСl2) = ---------------- · 100 = --------- · 100 = 10 % mр 1110 | |
| Ответ: W(СаСl2) = 10 % | |






