миев^-Однако при любых скоростях охлаждения до и С часть спермиев погибает, ИССДВДОВЗНИЯ ОДцетбльствуют о том, что спермии хряка более чувствительны к пониженным температурам, чем спермии быка и барана. Одно из средств смягчения холодового удара — введение в сперму желтка куриного яйца. Другой метод заключается в том, что свежеполученную сперму выдерживают при комнатной температуре в течение 1—2ч.
С понижением температуры в оставшихся живыми спермиях уменьшаются обменные процессы. При температуре около 0° наступает состояние анабиоза, при котором спермии прекращают движение, а обменные процессы в них находятся на низком уровне. При этом, как правило, удлиняются сроки выживания спермиев. При глубоком анабиозе, который достигается при охлаждении спермы до температуры —196°С (температура кипения жидкого азота) спермии в течение многих лет сохраняют оплодотворяющую способность. При нагревании незамороженных или оттаивании и нагревании непогибших замороженных спермиев восстанавливается их подвижность.
Обычно для достижения состояния анабиоза с целью хранения спермы пользуются сочетанием двух факторов, влияющих на снижение обменных процессов в спермиях,— понижением температуры и повышением кислотности среды, каждый из которых усиливает действие другого.
Свет. В естественных условиях спермии не встречаются со светом. Сохранение спермы при рассеянном дневном или электрическом освещении не приводит к заметному снижению выживаемости спермиев. Прямые солнечные и бактерицидные лучи быстро убивают спермии.
Противомикробные препараты. Для борьбы с микрофлорой спермы в разбавители вносят различные антимикробные препараты. В настоящее время известно большое количество противомикробных соединений. Большинство из них — продукты жизнедеятельности животных, растений и микроорганизмов, многие получены синтетическим путем. Свое губительное влияние на микроорганизмы они оказывают благодаря изменению структуры или функции микробных клеток. Естественно, что все указанные соединения определенно влияют и на спермии, которые являются изолированными живыми клет-
209
ками. Подавляющее большинство этих соединений в дозах, губительно влияющих на микроорганизмы (в основном бактерии), оказывались токсичными и для спермиев. Только отдельные препараты (в основном антибиотики и сульфаниламиды) могут быть применены для санации спермы. Широкое распространение для обеззараживания спермы получили пенициллин, стрептомицин и белый стрептоцид. Эти вещества входят в состав препарата спер-мосан. Однако ряд исследований свидетельствует о том, что и указанные вещества в дозах, рекомендуемых для внесения в разбавители, бывают токсичными для спермиев, особенно стрептомицин. Установлено, что 50—85 % серий стрептомицина и 10—12 % серий пенициллина токсичны для спермиев. Учитывая, что наряду с этим в последние годы отмечено повышение устойчивости микрофлоры спермы к спермосану, продолжается поиск других эффективных и менее токсичных для спермиев соединений. С этой целью предложены ампициллин, оксациллин, мономицин, йодвисмуткомплексонат, полимиксин. В последние годы большое внимание уделяется канамицину, который широко используется для санации спермы животных в ГДР.
Некоторые вредные вещества. В естественных условиях спермии встречаются с ограниченным количеством веществ, присутствующих в организме животных, к тому же, как правило, находящихся в нем в определенных концентрациях. При искусственном осеменении число соединений, с которыми могут встретиться спермии, значительно возрастает. Многочисленные исследования показали, что подавляющее большинство веществ естественного и в особенности искусственного происхождения оказывает отрицательное влияние па спермии. К ним, например, относятся почти все моющие и дезинфицирующие средства, а также многие лекарственные препараты. Токсичны для спермиев окислы и соли тяжелых металлов. В результате только ограниченное число препаратов может быть применено в средах для разбавления спермы, для мытья посуды, инструментов и приборов, соприкасающихся со спермой. Мойка и стерилизация посуды, инструментов и приборов должны проводиться в емкостях из неокисляющихся металлов или с антикоррозийными покрытиями (эмаль, никель и др.).
Особую опасность для спермиев представляют летучие вещества. Их молекулы могут содержаться в воздухе в значительных концентрациях и попадать оттуда в сперму, поэтому в лаборатории или вблизи от нее нельзя хранить
210
посторонние вещества, особенно медикаменты и дезсред-ства. Неблагоприятное влияние на спермии оказывает вазелин, применяемый для смазывания искусственных вагин. Однако до настоящего времени не найдено безвредного для спермиев препарата, способного заменить вазелин. Токсичны для спермиев и многие сорта резины. Это связывается с наличием в ней тетраметилтиурам-дисульфида. Стерилизация резины паром или кипячением способствует снижению ее токсичности. Белая резина и резиновые камеры вагин обычно слаботоксичны для спермиев. Лучше всего снижает токсичность резины 96°-ный этиловый спирт и в некоторых случаях — 2 %-ный раствор соды. Однако обработка этими средствами не устраняла токсичности резины в такой степени, чтобы искусственная вагина стала безвредной для спермиев хряка. Токсичность резины зависит от площади и времени соприкосновения со спермой. Отрицательное влияние на спермии иногда оказывает также полиэтилен.
ОЦЕНКА КАЧЕСТВА СПЕРМЫ
Ни один из известных в настоящее время показателей качества спермы не может служить критерием ее оплодотворяющей способности. Во многих случаях сперма, имеющая нормальные характеристики по всем показателям качества, не обладает оплодотворяющей способностью. Это наблюдается при хранении спермы, при ее замораживании и оттаивании, при воздействии на нее химических, лучевых и температурных факторов. Значительная часть молодых хрячков, не имеющих отклонений от нормы по показателям качества спермы, не оплодотворяет слученных с ними свиноматок^По ^казее•1•'ву ^йермы недьая-также установить разницу в степени ее оплодотворяющей способности у отдельных хряков.
В то же время опенка спермы позволяет с достаточной точностью отбраковать не пригодные для использования эякуляты, оценить пригодность среды для разбавления спермы, установить нормальные границы колебаний отдельных показателей качества у каждого хряка, что дает возможность своевременно выявить и устранить причины ее ухудшения и связанного с этим снижения оплодотворяющей способности. Оценка спермы позволяет определить оптимальную степень ее разбавления, что имеет решающее значение для рационального использования хряков.
211
Оценку спермы проводят органолептически и с помощью микроскопа (микроскопический метод).
Органолептическая оценка спермы. Сперма хряка в норме имеет жидкую консистенцию, цвет ее — от сывороточного до молочного. Только в очень редких случаях при высокой концентрации спермиев она может иметь цвет и консистенцию сливок. Розовый или красный цвет спермы указывает на попадание в нее крови, бурый или зеленый — гноя, желтый — мочи. Такие эякуляты выбраковывают.
Сперма хряка обычно не имеет специфического запаха. Запах жиропота указывает на не очень чистое получение спермы. Гнилостный запах свидетельствует о воспалительных процессах в половых органах, такую сперму выбраковывают.
Ввиду того, что секреты куперовых желез отфильтровываются, как правило, при получении спермы у хряка оценивается объем профильтрованной части эякулята. Если сперму получают в спермоприемник, не имеющий фильтра, то ее объем определяют после процеживания эякулята через марлю. Объем сгустка секрета куперовых желез оценивают только с научной целью. Объем профильтрованной части эякулята составляет в среднем 200—300 мл с колебаниями от 50 до 1000 мл. Значительные различия в объеме спермы отмечаются как между отдельными производителями, так и в разных эякулятах одного и того же хряка.
Микроскопическая оценка спермы. Для микроскопической оценки спермы применяют биологические микроскопы различных отечественных марок. Для оценки спермы хряков нежелательно пользоваться упрощенными микроскопами. Как правило, микроскопы имеют набор объективов с увеличением в 8, 20, 40 и 90 раз и ОКуЛЯрОВ с увеличением в 7, 10 и 15 раз. Увеличение, достигаемое в микроскопе, определяют умножением величин объектива и окуляра, которые указаны на каждом из них. Бинокулярные насадки повышают размер указанного расчетного увеличения на величину, указанную на насадке (АУ-12 в 1,5 раза). С помощью комбинации объективов и окуляров в монокулярном микроскопе можно получать увеличение от 56 до 1350 раз.
Для оценки спермы по густоте, концентрации и пе-реживаемости обычно применяют увеличение в 120 раз. При этом используют объектив 8Х и окуляр 15Х. Применение объектива с малым увеличением позволяет охватить
212
при оценке спермы больший участок препарата, что облегчает и ускоряет работу. При этом для наводки достаточно пользоваться только макровинтом. С целью оценки патологических форм спермиев применяют увеличение в 600 раз (объектив 40Х, окуляр 15Х) или 1350 раз (объектив 90Х, окуляр 15Х).
Для работы с микроскопом желательно иметь искусственные источники света. При большом объеме работ по микроскопической оценке спермы лучше использовать осветители ОИ-19, которые дают параллельные лучи и позволяют регулировать их интенсивность. При применении упрощенных осветителей, электрического термостата, естественного света труднее добиться нужного освещения поля зрения, в результате чего на оценку затрачивается больше времени и быстрее утомляется зрение.
Перед работой с микроскопом протирают мягкой тряпочкой стекла объектива, окуляра и зеркальце. Устанавливают осветитель ОИ-19 на расстоянии около 12,5 см от зеркальца микроскопа и направляют световой пучок в центр зеркала. Поворотом зеркальца направляют свет в конденсор так, чтобы он сконцентрировался в центре его верхней линзы. Затем смотрят в окуляр и, поправляя зеркальце, добиваются равномерного освещения поля зрения. При использовании упрощенного осветителя ОИ-32, вставляемого в гнездо для зеркальца, степень интенсивности и равномерность освещения достигаются движением патрона с лампой вдоль оси и поворотом вокруг оси. После установки препарата на столик микроскопа опускают объектив почти до его поверхности. Затем смотрят в окуляр и поднимают объектив до тех пор, пока в поле зрения не возникнет изображение искомого объекта. Если изображение не появилось, то операцию повторяют. Нельзя смотреть в окуляр и, опуская тубус, искать объект. При этом можно раздавить предметное стекло. После нахождения объекта нужно, поднимая или опуская конденсор, добиться наиболее контрастного изображения. С этой же целью сужают или расширяют ирисовую диафрагму конденсора.
Спермии лучше видны при неярком освещении поля зрения микроскопа. Достигать этого нужно силой светового потока осветителя и фильтрами. Не следует опускать конденсор и сужать диафрагму. Пользоваться нужно только плоским зеркалом. Вогнутое зеркало применяется при снятом конденсоре или, когда при естественном освещении, с помощью плоского зеркала не получают необходимой освещенности поля зрения. Если объект необходимо
213
рассматривать при большом увеличении, то сначала его находят с помощью объектива малого увеличения. Нужное место препарата перемещают в центр поля зрения микроскопа и поворотом револьвера включают в ход лучей объектов нужного увеличения (20, 40). В микроскопах с конденсором КОН-3 выводят из светового потока откидную линзу. Затем поворотом микровинта фокусируют микроскоп на резкость изображения.
Оценка спермы по активности (подвижности) спер-миев. Оценку свежеполученной спермы по активности проводят при температуре 40—42°С. Для подогрева спермы применяют электрические термостаты, в которые помещают микроскоп, или нагревательные столики, укладываемые на предметный столик микроскопа. Используют водоналивные нагревательные столики Морозова, а также электрические нагревательные столики конструкции Морозова и Пакенаса. Водоналивные столики быстро остывают, поэтому неудобны в работе, особенно при оценке спермы, разбавленной хелатоновой средой. Для поддержания определенной температуры в электрических столиках необходимо постоянно наблюдать за ней и менять напряжение электрического тока. Столики конструкции Пакенаса (СЭПМ) поддерживают нужную температуру автоматически. Установление желательной температуры осуществляется поворотом винта через отверстие в блоке питания. Положительное качество последней конструкции — большая поверхность, что позволяет одновременно с оценкой спермы подогревать другие препараты, а также предметные и покровные стекла.
Оценка спермиев по подвижности ведется по 10-балльной шкале. При этом учитывают только спермин с прямолинейно-поступательным движением. Каждые 10 % спермиев с прямолинейно-поступательным движениями оцениваются в 1 балл. Таким образом, высшую оценку 10 баллов получает сперма, в которой все спермии (100 %) движутся прямолинейно-поступательно. Чем больше спермиев с манежным, колебательным движением или неподвижных, тем ниже оценка. Если таких спермиев 10 %, то активность спермы равна уже 9 баллам и т. д.
Для правильной оценки активности спермы необходимо, чтобы все спермии были четко видны. При густой и средней сперме каплю ее перед оценкой смешивают с каплей 2,9 %-ного цитрата натрия или физиологического раствора. С этой же целью можно наносить на предметное стекло маленькую каплю спермы. Так как точно оце-
214
нить соотношение различных форм движения и мертвых спермиев при рассматривании всего поля зрения невозможно, то поступают следующим образом. Выбирают ограниченный участок, примерно со средней характеристикой, где находятся 1—2 мертвых или с неполноценными формами движения спермия. Затем подсчитывают, сколько спермиев с прямолинейно-поступательным движением одновременно пересекают указанный участок. По их соотношению и дают оценку сперме. Для большей точности можно оценить два-три таких участка поля зрения. Обычно сперма хряков имеет высокую активность и оценивается в 8—10 баллов.
При оценке препарата спермы хряка спермии, имеющие прямолинейно-поступательное движение, часто начинают собираться в конгломераты и становятся неподвижными. Это происходит в результате того, что спермии задерживаются мелкими встречными частицами секрета. После разбавления спермы подобные скопления спермиев обычно не наблюдаются. При оценке активности спермы спермии в подобных конгломератах не учитывают (не считают неподвижными, мертвыми). Однако если в процессе хранения произошла истинная агглютинация спермиев (не исчезает при подогревании препарата, при встряхивании спермы), то агглютинированные спермии относят к неподвижным. С целью оценки по активности каплю спермы берут стеклянной палочкой, наносят на теплое предметное стекло и покрывают подогретым покровным. При разбавлении спермы хелатоновой средой спермии находятся в анабиозе. Для того, чтобы вывести все спермии из этого состояния, необходимы повышенная температура (43—45°С) и большее время. Если готовить мазок обычным способом, то сперма подсохнет и спер-чии погибнут в ней раньше, чем восстановится их подвижность, поэтому на подогретое предметное стекло нужно наносить большую каплю спермы и не накрывать ее сразу покровным стеклом. Только тогда, когда многие спермии проявят движение, ее накрывают покровным стеклом, фокусируют микроскоп и наблюдают до тех пор, пока в оцениваемом препарате спермин не проявят наивысшую подвижность. Вскоре после этого подвижность спермы начинает снижаться в результате подсыхания препарата. Иногда на оценку пробы разбавленной спермы затрачивается до 3 мин и более. С целью экономии времени можно наносить на одно предметное стекло три пробы спермы. При этом нужно применять покровные стекла раз-
215
мером 18Х 18 мм. В некоторых случаях оценивают дополнительно в баллах спермин с манежным и колебательным движением. Манежное движение сокращенно обозначается буквой М, а колебательное — буквой К. Подобная запись может выглядеть следующим образом:
64-2М+1К. Неподвижность всех спермиев эякулята (не-кроспермия) сокращенно обозначается буквой Н.
Для разбавления допускается сперма с активностью не ниже 7 баллов. Если хряки, представляющие племенную ценность, почти регулярно выделяют сперму с меньшей активностью, то ее можно проверить по оплодотворяющей способности. В случае наличия у такой спермы высокой оплодотворяющей способности ее можно использовать без ограничений. При пониженной оплодотворяющей способности спермы вопрос о возможности использования хряка должен решаться специалистами хозяйств.
Оценка спермы по густоте. Оценку спермы по густоте проводят для ориентировочного определения в ней концентрации спермиев. Густой считается сперма с концентрацией более 200 млн. спермиев в 1 мл, средней — от 100 до 200 и редкой—до 100 млн. Чем выше концентрация спермиев, тем гуще они будут располагаться в поле зрения микроскопа. Каплю для оценки нужно брать среднюю, каждый раз примерно одинаковых размеров. Если капля окажется большой, то слой спермы между покровным и предметным стеклом станет толще и сперма будет казаться более густой, а при меньшей капле, наоборот, более редкой, поэтому применять в качестве покровных нужно стекла определенных размеров. При большей поверхности покровного стекла слой оцениваемой спермы будет тоньше и она будет казаться более редкой. На результаты оценки спермы может также оказать влияние скорость движения спермиев. Чем быстрее движутся спермии, тем гуще кажется сперма. Представление о различной густоте спермы можно получить только после оценки эяку-лятов в разной концентрации спермиев. Однако даже опытные специалисты не могут по густоте с примерной точностью установить концентрацию и нередко ошибаются в 2 раза и более, поэтому оценка спермы по густоте может иметь только ориентировочное значение и обязательно должна дополняться ее оценкой по концентрации. Густая сперма сокращенно обозначается буквой Г, средняя — С и редкая — Р. Отсутствие спермиев в сперме называется аспермией и обозначается буквой А, а очень незначительное их содержание — олигоспермией (О).
216
Оценка спермы по концентрации спермиев (концентрация спермы). При меньшем, чем оптимальное, количестве спермиев в дозе для осеменения снижаются оплодотворяе-мость и многоплодие свиноматок, при большем — лишние спермии расходуются бесполезно. В связи с этим определение концентрации спермиев, позволяющей нормировать их количество, в дозе за счет соответствующих степеней разбавления спермы является необходимым условием рационального использования производителей. С целью подсчета спермиев в определенном объеме спермы желательно, чтобы они, по возможности, располагались в один слой. Площадь подсчета спермиев должна быть достаточно большой во избежание ошибок, так как спермии могут гуще или реже расположиться в отдельном ее участке. Помимо этого, чтобы не сбиться со счета, не пропустить спермии или не сосчитать один спермии несколько раз, необходимо площадь подсчета разделить на мелкие квадраты. Все эти условия создаются в специальных счетных камерах Горяева, Бюркера, Тома и т. д., применяемых в медицине для подсчета форменных элементов крови. Камеры состоят из толстого стекла с поперечными желобками, между которыми в средней части стекла образуются три площадки. Средняя площадка в большинстве камер на 0,1 мм ниже боковых. Продольным желобком в середине она разделена на две части, на каждой нанесена сетка. Площадь одной сетки в камере Горяева равна 9 мм2. Сетка состоит из 225 больших квадратов, 25 из них разделены дополнительно горизонтальными и вертикальными линиями на 16 маленьких квадратов.
С целью подготовки камеры для подсчета спермиев к центральным боковым поперечным площадкам притирают шлифовальное покровное стекло. Для этого его помещают в центре камеры на площадки. Большими пальцами прижимают края стекла и двигают его вдоль площадок вперед и назад до появления радужных колец. При этом между покровным стеклом и центральной площадкой (сетками) остается зазор толщиной в 0,1 мм. Если стекло не притерто с обеих сторон, то при зарядке камеры спермой край его или все оно может приподняться, толщина слоя спермы станет толще и оценка спермы по концентрации окажется завышенной. При необходимости вместо шлифовальных стекол можно использовать обычные покровные, но они значительно труднее притираются и легко ломаются.
Для зарядки камеры на край средней площадки, не прикрытой покровным стеклом, наносится капля спермы,
217
которая сама засасывается в зазор между стеклами. Излишки спермы стекают в желобки. При узкой камере, когда она по ширине равна покровному стеклу, каплю спермы наносят сбоку. Для этого камеру ставят ребром и каплю наносят сверху в место нахождения покровного стекла. Если камеру зарядить неразбавленной спермой, то спермии в ней трудно будет сосчитать из-за постоянного их движения и густого расположения, и часть из них будет прикрывать другие спермии. Поэтому перед зарядкой в счетную камеру сперму разбавляют средой, которая одновременно убивает спермии. Обычно для этих целей применяют 3 %-ный раствор поваренной соли или дистиллированную воду. Однако дистиллированная вода не пригодна для разбавления спермы хряка, так как при этом наступала агглютинация и подсчет спермиев становился невозможным. Для разбавления спермы хряка раньше рекомендовали специальные стеклянные трубочки, лейкоцитарные меланжеры,- в которых сперма и раствор набирались в расширение. При встряхивании меланжеров бусинка перемешивала среды. Применение меланжеров существенно затрудняло работу по определению концентрации. Это было связано с тем, что сперму в них можно разбавлять только в 10 или 20 раз. В результате при оценке средней и густой спермы нужно было подсчитать большое число спермиев и затратить на это много времени. Только для равномерного перемешивания в меланжерах спермы с 3 %-ным раствором поваренной соли их необходимо было встряхивать в течение минимум 3 мин. Много времени затрачивалось на промывание, просушивание и обезжиривание меланжеров спиртом и эфиром. В результате на оценку одной пробы спермы затрачивалось около 20 мин. Это обычно делало невозможным определение концентрации спермы до ее разбавления у всех хряков. При использовании меланжеров нельзя также определять концентрацию спермиев в разбавленной сперме.
Учитывая недостатки, связанные с применением меланжеров, мы изучили возможность исключения их из метода и упростили способ определения концентрации спермиев. В предложенном нами способе устраняются все отмеченные недостатки. При его использовании разбавление спермы с целью подсчета спермиев в счетной камере проводится с помощью пипеток и флаконов (колбочек). Сперму разбавляют в зависимости от густоты в 20, 30, 40 или 50 раз, чтобы в счетной камере (при оценке пробы) подсчитывать около 50—100 спермиев.
218
При разбавлении спермы в 20 раз число спермиев, подсчитанных в пяти больших квадратах камеры Горяе-ва, соответствует их концентрации в сперме в миллионах в 1 мл. Чтобы получить значение концентрации оцениваемой спермы при ее разбавлении в 30 раз, число спермиев, подсчитанное в пяти больших квадратах, умножают на 1,5, при разбавлении в 40 раз — на 2 и при разбавлении в 50 раз — на 2,5. Так, если при разбавлении спермы в 20 раз в пяти больших квадратах подсчитано 100 спермиев, то это означает, что концентрация спермиев в оцениваемой сперме составляет 100 млн/мл; разбавленной в 40 раз — 200 млн/мл. Метод определения концентрации спермиев с помощью счетной камеры является точным, так как при нем подсчитывается каждый спермий в определенном объеме спермы.
Другие методы определения концентрации спермы основаны на оценке степени ее прозрачности. Спермий менее прозрачны, чем плазма, поэтому, чем концентрированнее сперма, тем меньше лучей будет проникать через нее. Такие методы менее точны, так как прозрачность спермы зависит и от других факторов. Чем большие размеры будут иметь спермий (они колеблются как у разных производителей, так и в отдельных эякулятах одного хряка), тем более завышенной окажется оценка спермы. Зависит она также от соотношения в эякуляте секретов различных придаточных желез — секреты каждой железы имеют различную оптическую плотность. Плазма спермы содержит в среднем около 4 % сухого вещества, но в секрете предстательной и уретральных желез концентрация сухого вещества составляет только около 1 %, а в секрете пузырьковидных — около 16 %, т. е. ненамного меньше, чем в спермиях (около 25 %). В то же время соотношение секретов придаточных половых желез существенно меняется даже в разных эякулятах одного хряка. Большое влияние оказывает на прозрачность спермы скармливание кормов, содержащих красящие вещества (морковь, свекла и др.). Проникая в сперму, они значительно снижают ее прозрачность. На неточность определения концентрации спермиев по прозрачности спермы влияют также клеточные элементы из придаточных половых желез и мочеполового канала (эпителиальные плоские клетки, мелкие и крупные ядра и т. д.).
Быстрый и точный метод определения концентрации спермиев пока не найден. За рубежом для определения концентрации спермиев рекомендован электрический счет-
219
чик частиц, применяемый в медицине для подсчета форменных элементов крови. Оценка проводится очень быстро. Но оказалось, что прибор подсчитывает не только спер-мии, но и содержащиеся в сперме и применяемых для ее разведения растворах частицы, близкие по размерам к спермиям. Не получено положительных результатов и в определении концентрации спермиев по объему осадка спермы после ее центрифугирования (сперматокрит). До настоящего времени единственным точным остается метод определения концентрации спермиев с помощью счетной камеры.
Оценка спермы по выживаемости спермиев. От способности спермиев выживать в половых органах свиноматки зависит 'оплодотворяющая способность спермы. Нередко считают, что чем дольше спермии выживают при хранении вне организма, тем выше их оплодотворяющая способность. На самом деле между указанными показателями нет прямой зависимости, так как применяемые для разбавления спермы среды существенно отличаются по составу от секрета маточно-трубного сочленения. Однако, несмотря на это, очень большое значение имеет оценка спермы по выживаемости спермиев, так как позволяет судить о качестве применяемых сред, об устойчивости спермиев к факторам внешней среды, об ориентировочных сроках хранения спермы в разных средах. Снижение сроков выживаемости спермиев в определенной среде свидетельствует об ухудшении качества спермы и указывает на необходимость выяснения причины этого. Обычно определяют абсолютную выживаемость спермиев.
При этом в стеклянный флакон объемом около 10 мл вносят 1—2 мл спермы и приливают в 2—3 раза больше среды. В него можно вносить и 4—5 мл разбавленной 1:2—1:3 спермы. Флакончик закрывают пробкой и ставят на хранение при температуре 16—18°С. Один или два раза в сутки из флакончика берут пробу спермы и оценивают ее по подвижности спермиев. Оценку проводят до полной гибели спермиев. Время, в течение которого спермии сохраняли подвижность, определяет абсолютную выживаемость спермиев. При хорошем качестве ГХЦС среды и спермы абсолютная выживаемость спермиев превышает 6 суток и достигает 10 суток и более. В молочной среде абсолютная выживаемость спермиев составляет 2—4 суток. При использовании ГХЦС среды сперму иногда оценивают только в течение 3 суток. Подвижность спермиев после 3-суточного хранения должна составлять не менее 6 баллов.
220
|
|
^
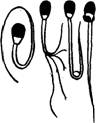
' 234 5 6 7 8 9 10 11. 12 13 14 15 16 Рис. 15. Нормальные и морфологически измененные формы спермиев:
1 — нормальный спермий; 2 — гигантский спермий; 3 — карликовый спермин; 4 — узкая головка; 5 — круглая головка; 6 -- головка с выемкой; 7 — отделенная головка; 8 — головка без чехлика; 9, К) — двойная головка; 11 — утолщенное тело; 12 — двойной хвост:
13 — закрученный хвост и грушеобразная головка; 14 — расщепленный хвост; 15 — закругленный хвост с протоплазматической каплей; 16 — проксимальная протоплазмати-ческая капля
Наиболее точная — оценка по абсолютному показателю выживаемости спермиев. Однако ввиду сложности рекомендуемый метод не находит применения в производстве, так как требуется оценивать сперму при нескольких степенях разбавления, проводить сложные расчеты для вычисления показателя. В своей работе мы применяем упрощенный способ, используя одну степень разбавления спермы — 1:2 или 1:3. В зависимости от применяемых сред оцениваем сперму по подвижности спермиев один (ГХЦС среда) или два раза в сутки (остальные среды) до полной гибели спермиев. Все полученные показатели оценки спермы по подвижности складываем и умножаем на период времени между двумя оценками спермы. При однократной в сутки оценке спермы он составляет 24 ч, а при двукратной — 12 ч. При хорошем качестве спермы и ГХЦС среды показатель превышает 990.
Определение морфологически измененных (патологических) форм спермиев. Определение патологических форм спермиев характеризует состояние сперматогенеза самцов, поэтому повышенное их количество имеет высококоррелятивную отрицательную связь с оплодотворяющей способностью спермы.
Патологические формы спермиев встречаются во всех эякулятах в значительном количестве (рис. 15). Причины их появления недостаточно изучены.