Титрование раствором перманганата калия используют для определения множества веществ – восстановителей и окислителей (с предварительным восстановлением).
Перманганатометрия – один из лучших способов определения железа в разных объектах. После растворения образца железо оказывается в степени окисления +3, поэтому его предварительно переводят в Fe2+ хлоридом олова (II) или металлами. Таким же образом с предварительным восстановлением можно определять V, Mo, W, U, Ti, Sn, Sb, которые после растворения образцов получаются в высшей степени окисления.
5Н2О2 + 2МnО4- + 6Н+ → 5О2 + 2Мn2+ + 8Н2О,
5[Fe(CN)6]4- + МnО4- + 8Н+ → 5[Fe(CN)6]3- + Мn2+ + 4Н2О,
5АsIII + 2МnО4- + 16Н+ → 5Аsv + 2Мn2+ + 8Н2О.
Перманганатометрию используют для определения нитритов по реакции:

Прямое титрование невозможно: поскольку нитрит в кислой среде неустойчив, поэтому добавляют избыток перманганата и через некоторое время оттитровывают избыток стандартным раствором соли Мора.
Раствор перманганата можно использовать для определения ионов, образующие малорастворимые оксалаты (Сa, Mg, Zn, Ba, Pb, Ag, Sr, Co). Обратным перманганатометрическим титрованием определяют восстановители, реагирующие с KMnO4 медленно – иодиды, цианиды, фосфиты и др
Перманганатометрия используется для определения общей окисляемости воды или почвы. При этом с MnO4– – ионом в кислой среде реагируют все органические компоненты.
В биохимии и в клиническом анализе методом перманганатометрии определяют содержание мочевой кислоты в моче, ионы Ca2+ в кровяной сыворотке, сахара в крови.
Лабораторная работа.
«Перманганатометрическое титрование»
Цель работы Научиться проводить стандартизацию раствора перманганата калия. Уметь применять навыки перманганатометрического титрования для определения концентрации исследуемого раствора.
Реактивы и оборудование
Бюретки на 25 мл в штативе, химические воронки, пипетки Мора на 5мл и 10мл, колбы конические для титрования на 100мл, резиновые груши, стаканчики для слива;водяная баня, спиртовой термометр, стандартный раствор щавелевой кислоты H2C2O4, 0,05N концентрации, раствор KMnO4, 2н раствора H2SO4, исследуемый раствор Н2О2.
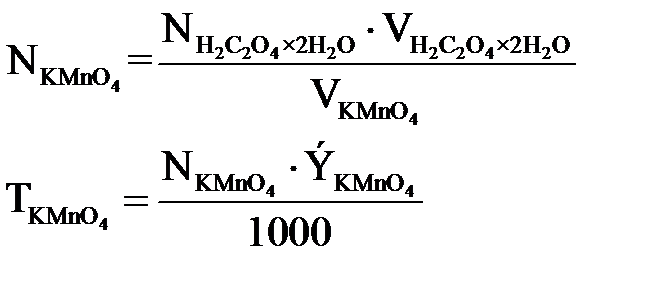
Работа 1. Установление нормальности и титра KMnO 4 по 0,05н раствору щавелевой кислоты
Нормальность и титр KMnO4устанавливают по щавелевой кислоте. В основе процесса титрования лежит реакция между KMnO4 и H2C2O4·H2O в кислой среде:
2KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + 10CO2 + K2SO4 + 8H2O
Ход определения
Бюретку заполняют раствором KMnO4. Кончик бюретки должен быть полностью заполнен раствором перманганата.
В коническую колбу для титрования с помощью пипетки вносят 5мл раствора щавелевой кислоты H2C2O4. Добавляют 2–2,5 мл 2н раствора H2SO4 и нагревают на водяной бане до 70o–80oC, не допуская кипения раствора. Горячий раствор титруют перманганатом калия, добавляя его по каплям и непрерывно перемешивая. Первые капли KMnO4 обесцвечиваются не сразу. Пока не произошло обесцвечивание, не рекомендуется приливать последующие капли. Титрование прекращают, когда прибавление очередной капли раствора KMnO4 вызывает уже неисчезающую розовую окраску содержимого колбы в течение 1–2 минут. Объем KMnO4, затраченный на титрование отмечают на бюретке по верхнему мениску.
Титрование повторяют 3 раза и данные записывают в таблицу 1.
Таблица 1
Результаты опыта
| № | V(H2C2O4 2H2O) | N(H2C2O4 2H2O) | V(KMnO4) | N(KMnO4) | T(KMnO4) |
| 1 | |||||
| 2 | |||||
| 3 | |||||
| ср |
Нормальность и титр раствора перманганата калия вычисляют, исходя из среднего объема раствора KMnO4, затраченного на титрование