Химические элементы, имеющие переменную степень окисления, могут быть количественно определены титриметрически с применением окислительно-восстановительной реакции (ОВР). Методы окислительно-восстановительного (ОВ) титрования или red-ox-методы – это титриметрические методы, основанные на использовании окислительно-восстановительных реакций.
Окислительно-восстановительное титрование можно разделить:
1 По характеру титранта:
– оксидиметрические – методы определения восстановителей с применением титранта-окислителя;
– редуктометрические – методы определения окислителя с применением титранта-восстановителя.
2 По природе реагента (титранта), взаимодействующего с определенным веществом:
– KMnO4 – перманганатометрия;
– KBrO3 – броматометрия;
– KI,Na2S2O3 – иодометрия;
– I2 – иодиметрия;
– Br2 – бромометрия;
– Ce(SO4)2 – цериметрия
В зависимости от решаемой аналитической задачи в редоксиметрии используют прямое, обратное и заместительное титрования. Редоксиметрически могут быть количественно определены как неорганические, так и органические вещества. Например, восстановлением с помощью перманганата калия в сильнощелочной среде могут быть определены метанол, муравьиная, винная, лимонная, салициловая кислоты, а также глицерин, фенол, формальдегид и др.
Схематично ОВР, с учетом закона электронейтральности раствора, можно изобразить следующим образом:
OX1+ne Red1 m
Red2-m2e OX2 n
mOX1+ nRed2↔ mRed1+ n OX2
Здесь индексы 1 и 2 относятся к веществам 1и 2 в окисленной (Ox1 и Ox2) и восстановленной (Red1 и Red2) формах. В ходе ОВР вещество Ох1 с большим сродством к электрону (окислитель) присоединяет электроны, понижает свою степень окисления, восстанавливается, а вещество Red2 с меньшим сродством к электрону (восстановитель) окисляется.
Окисленная и восстановленная формы реагирующих в ОВР веществ образуют окислительно-восстановительные (оксред-, редокс-) пары Ох1/Red1 и Ox2/Red2, а превращения типа Ox+ze Red называют оксред - (редокс)-переходами или окислительно-восстановительными полуреакциями.
§2. Окислительно-воостановительный потенциал.
Уравнение Нернста.
Окислительно-восстановительные процессы, как и все динамические процессы, в той или иной мере обратимы. Направление реакций определяется соотношением электронодонорных свойств компонентов системы одной окислительно-восстановительной полуреакции и электроно-акцепторных свойств второй (при условии постоянства факторов, влияющих на смещение равновесных химических реакций). Перемещение электронов в ходе окислительно-восстановительных реакций приводит к возникновению потенциала. Таким образом, потенциал, измеряемый в вольтах, служит мерой окислительно-восстановительной способности соединения.
Для количественной оценки редокс-свойств редокс-пар используют редокс - (окислительно-восстановительные) потенциалы. При вычислении окислительно-восстановительного потенциала используют уравнение Нернста:
E (Ox/Red) = E0 (Ox/Red) + 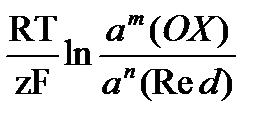
где E(Ox/Red) - реальный или равновесный редокс-потенциал, В;
E0(Ox/Red) - стандартный редокс-потенциал, равный равновесному при а(Ох) = а(Red) = 1 моль/дм3;
R - универсальная газовая постоянная (8,31 Дж/К·моль);
Т - абсолютная температура, K; F - число Фарадея (96500 Кл/моль);
z - число электронов, участвующих в редокс-переходе в ОХ+ze dRed;
a(OX) и a(Red) - активности соответственно окисленной и восстановленной форм вещества, моль/дм3.
При подстановке в уравнение Нернста значений R, F и T = 298 К, а также переходе к десятичному логарифму, получим
E(Ox/Red) =E0(Ox/Red) + 
Редокс-потенциал зависит также от кислотности среды, комплексообразования или осаждения одного из компонентов редокс-пары в процессе редокс-перехода. Чем больше концентрация ионов водорода в растворе, тем больше окислительная способность окисленной формы вещества редокс-пары и тем больше E(Ox/Red).
При выборе вещества титранта в редоксиметрии проводят качественную и количественную оценку возможности (направленности) и полноты прохождения ОВР между титрантом и определяемым веществом.
Качественную оценку проводят путем сравнения табличных величин E0(Ox|Red) вещества титранта и определяемого вещества, приведенных в аналитических, химических и физико-химических справочниках.
Перманганатометрия
Перманганатометрическим методом объемного анализа называют метод, основанный на окислении различных веществ перманганатом калия (KMnO4).
В зависимости от условий, в которых протекает реакция окисления-восстановления, ионы MnO4– могут принимать различное число электронов.
В кислой среде:

В нейтральной среде:

В щелочной среде:
Нормальный потенциал системы Е0 (MnO4–⁄Mn2+) = +1,52В, а Е0(MnO4–⁄MnO2) = +0,57В, поэтому перманганат калия в кислой среде обладает сильными окислительными свойствами и способен окислять многие вещества.
Эквивалент перманганата калия в кислой среде равен:
М(1/zKMnO4) = М(KMnO4)/ne = 158/5 = 31,608 г/моль
В лабораторной практике перманганат калия применяют в виде растворов различной концентрации. Обычно пользуются 0,1н раствором KMnO4, хотя в некоторых случаях применяют 0,01н, 0,05н, 0,2н растворы.
Приготовление рабочего раствора KMnO 4
Перманганат калия, применяющийся для приготовления рабочего раствора KMnO4, обычно содержит ряд примесей, из которых наиболее значительными являются соединения марганца (IV). Кроме того, в первые дни после приготовления раствора происходит восстановление KMnO4 органическими примесями, содержащимися даже в дистиллированной воде. В результате концентрация раствора KMnO4 изменяется:

Поэтому сначала готовят раствор приблизительной концентрации. Например, для приготовления 500 мл 0,1н раствора KMnO4 рассчитывают необходимую навеску вещества по формуле:
m(KMnO4) = N(KMnO4) · M(1/zKMnO4) · V
m=31,608 0,1 0,5≈1,58г.
Навеску растворяют в мерной колбе объемом 0,5л. Раствор переливают в склянку из темного стекла и оставляют в темном месте не менее чем на неделю. За это время перманганат окислит все примеси, содержащиеся в воде, а образовавшийся в результате частичного восстановления перманганата диоксид марганца MnO2 осядет на дно склянки. Раствор отфильтровывают от MnO2 и хранят в темных склянках. Очевидно, что после этого приступают к стандартизации раствора.
В качестве исходных веществ для установки точной концентрации раствора KMnO4 обычно применяют оксалат аммония (NH4)2C2O4·H2O, оксалат натрия Na2C2O4 и щавелевую кислоту H2C2O4·2H2O. Наиболее удобным является оксалат натрия, т.к. он кристаллизуется без воды и не гигроскопичен.

Реакция автокаталитическая, поэтому для ускорения процесса раствор следует нагреть.
Разность потенциалов для этой реакции определяют вычитанием из нормального потенциала системы MnO4–/Mn2+ (E0=+152В) нормального потенциала системы 2CO2/C2O42– (E0=–0,49В), то Е = +1,52–(–0,49)=2,01В
Большая разность потенциалов показывает, что реакция необратима.
Все продукты этой реакции бесцветны, тогда как раствор KMnO4 красно-фиолетовый. Поэтому течение реакции должно сопровождаться обесцвечиванием прибавляемого раствора перманганата. Если прибавить к кислому раствору оксалата натрия 2–3 капли раствора KMnO4, бесцветный раствор окрасится в розовый цвет, что указывает на присутствие непрореагировавшего KMnO4. Окраска исчезает только через несколько минут. Это свидетельствует о небольшой вначале скорости реакции. Обесцвечивание раствора после прибавления последующих капель раствора KMnO4 происходит все быстрее и быстрее, и, наконец, будет происходить почти моментально вплоть до точки эквивалентности. Лишняя капля KMnO4 окрасит титруемый раствор в неисчезающий розовый цвет.






