
 Правильный ответ 1.
Правильный ответ 1.
1. 2.
 3. 4.
3. 4.
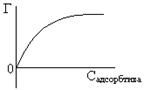
11. соли желчной кислоты – ПАВ, снижающие поверхностное натяжение, значит, зависимость поверхностного натяжения мочи от концентрации солей желчных кислот можно представить следующим образом:

Нанесем на график σ мочи в норме: 57-68, проведем линию до графика и опустим перпендикуляр на ось Х. Получим отрезок, где содержание желчи в норме. Если желчи будет меньше нормы, то поверхностное натяжение должно быть больше N, если содержание в моче солей желчной кислоты повышенное, то σ должно быть меньше нормы.
σ = 78 или 71  , σ больше нормы, значит содержание желчи пониженное.
, σ больше нормы, значит содержание желчи пониженное.
σ = 63  , σ в норме, содержание желчи в норме.
, σ в норме, содержание желчи в норме.
σ = 53  , σ меньше нормы, содержание желчи повышенное. Правильный ответ 4.
, σ меньше нормы, содержание желчи повышенное. Правильный ответ 4.
12. Величина адсорбции на твердых сорбентах рассчитывается по уравнению Лэнгмюра. Для адсорбции из растворов: 
 для адсорбции газов:
для адсорбции газов:  Второе уравнение – это уравнение Гиббса для расчета адсорбции на поверхности жидкости. Правильный ответ 1.
Второе уравнение – это уравнение Гиббса для расчета адсорбции на поверхности жидкости. Правильный ответ 1.
13.молекулярная адсорбция подчиняется правилу Ребиндера. Адсорбция максимальна в том случае, если полярность адсорбента лежит между полярностью адсорбтива и растворителя. Адсорбция протекает по принципу подобное адсорбируется на подобном.
 Мел – адсорбент полярный – соединение с ионным типом связи. Дифильный адсорбтив адсорбируется на полярном сорбенте своей полярной частью (полярная часть изображается о), поэтому в схеме адсорбции дифильное вещество ориентировано своей полярной частью к адсорбенту: .
Мел – адсорбент полярный – соединение с ионным типом связи. Дифильный адсорбтив адсорбируется на полярном сорбенте своей полярной частью (полярная часть изображается о), поэтому в схеме адсорбции дифильное вещество ориентировано своей полярной частью к адсорбенту: .
Неполярный растворитель (|) не имеет сродства к полярному адсорбенту.
Схема адсорбции полностью:

В данной схеме наблюдается закономерное изменение полярности. Полярность адсорбтива лежит между полярностью адсорбента и растворителя. Схема подчиняется правилу Ребиндера. Адсорбция полная. Правильный ответ 1.
14. Уголь – адсорбент неполярный. По принципу подобное адсорбируется на подобном, на неполярном угле будут адсорбироваться и дифильный адсорбтив своей неполярной частью, и неполярный растворитель:  .
.
Это одна из причин неполной адсорбции – сродство к адсорбенту и растворителя и адсорбтива. Вторая причина неполной адсорбции – сродство растворителя и адсорбтива - в растворе образуется сольват ( ).
).
Схема адсорбции
полностью: 
Адсорбция неполная. Схема не подчиняется правилу Ребиндера. Правильный ответ 3.
15. Уголь – адсорбент неполярный. Дифильное вещество адсорбируется своей неполярной частью:  . Вода – полярный растворитель не имеет сродства к неполярному адсорбенту. Схема адсорбции полностью:
. Вода – полярный растворитель не имеет сродства к неполярному адсорбенту. Схема адсорбции полностью:

Соблюдается правило уравнивания полярностей Ребиндера: полярность адсорбтива лежит между полярностью адсорбента и растворителя. Адсорбция полная. Правильный ответ 2.
16. Речь идет об адсорбции из спиртового раствора адсорбтива. растворитель-спирт ( ) и адсорбтив (
) и адсорбтив ( ) - оба дифильные вещества – имеют сродство друг к другу, поэтому в растворе образуют сольват (
) - оба дифильные вещества – имеют сродство друг к другу, поэтому в растворе образуют сольват ( ). Кроме того, идет конкуренция за место на адсорбенте между адсорбтивом и растворителем: .
). Кроме того, идет конкуренция за место на адсорбенте между адсорбтивом и растворителем: .

Дифильные вещества адсорбируются своей полярной частью. Адсорбция неполная. Схема не подчиняется правилу Ребиндера.
 Схема адсорбции полностью:
Схема адсорбции полностью:
Правильный ответ 4.
17. Уголь – адсорбент неполярный. Обе причины неполной адсорбции налицо: 1) сродство растворителя и адсорбтива (в растворе образуется сольват  ) и 2) сродство к адсорбенту и растворителя и адсорбтива (оба дифильных вещества адсорбируются своей неполярной частью:
) и 2) сродство к адсорбенту и растворителя и адсорбтива (оба дифильных вещества адсорбируются своей неполярной частью: 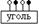 ).
).
Схема адсорбции полностью:
Правильный ответ 2.
18. Дана смесь твердых веществ: 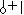 ;
; 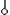 - дифильное вещество;
- дифильное вещество;
| - неполярное вещество. Сначала вещества нужно растворить. Подбор растворителя осуществляется по принципу – подобное растворяется в подобном. Оба вещества имеют неполярную часть, значит, их можно растворить в неполярном растворителе – бензоле. Составим часть схемы адсорбции:

Подберем правило Ребиндера для дифильного адсорбтива: неполярный растворитель – малополярный адсорбтив – полярный адсорбент. Значит, в качестве адсорбента нужно взять мел. Схема адсорбции полностью:

Из смеси дифильного и неполярного веществ на меле адсорбируется только дифильное своей полярной частью.
Правильный ответ 4.
19. Правильный ответ:  - полярный адсорбент. На нем избирательно адсорбируются, согласно первому правилу Панета-Фаянса, ионы, которые достраивают кристаллическую решетку сорбента. Из всех представленных веществ только
- полярный адсорбент. На нем избирательно адсорбируются, согласно первому правилу Панета-Фаянса, ионы, которые достраивают кристаллическую решетку сорбента. Из всех представленных веществ только 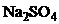 содержит ионы
содержит ионы  , входящие в кристаллическую решетку адсорбента
, входящие в кристаллическую решетку адсорбента  . Правильный ответ 1.
. Правильный ответ 1.
 20.По первому правилу Панета-Фаянса на поверхности сорбента
20.По первому правилу Панета-Фаянса на поверхности сорбента  адсорбируются те ионы, которые входят в состав кристаллической решетки сорбента. Это либо ионы
адсорбируются те ионы, которые входят в состав кристаллической решетки сорбента. Это либо ионы  , либо
, либо  . Эти ионы в первую очередь должны окружать адсорбент. Поверхность приобретает заряд.
. Эти ионы в первую очередь должны окружать адсорбент. Поверхность приобретает заряд.
По второму правилу на заряженной поверхности сорбента могут дополнительно поглощаться ионы противоположного знака - противоионы: 
Правильный ответ 2.
ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ IX. ДИСПЕРСНЫЕ СИСТЕМЫ
Ответы к тестовым заданиям раздела I
1. 2; 2. 2; 3. 4; 4. 1; 5. 3; 6. 1; 7. 3; 8. 3; 9. 1; 10. 2; 11. 3; 12. 2.
13. 3; 14. 4; 15. 2; 16. 4; 17. 3; 18. 1; 19. 1; 20. 4.
21. Запишем уравнение реакции получения золя по реакции обмена (конденсационный метод)
BaCl2(избыток) + Na2SO4 → BaSO4 (микрокристаллы) +2NaCl
Соль BaCl2 взята в избытке, значит BaCl2 является стабилизатором. Запишем уравнение диссоциации стабилизатора. Учтем, что в растворе присутствует n моль BaCl2.
n BaCl2 → nBa 2+ + 2nCl -
В ядре мицеллы находится нерастворимый в воде микрокристалл ВаSO4.В данном случае потенциалопределяющие ионы – анионы Ва2+, противоионы – ионы Cl -. Мицелла золя сульфата бария, полученного в избытке хлорида бария может быть изображена следующим образом:
{[m BaSO4] ∙ n Ba 2+ 2(n-x) Cl - } 2x+∙2x Cl -∙ yH2O
 ядро
ядро  диф.слой гидрат.оболочка
диф.слой гидрат.оболочка
гранула
мицелла
Заряд гранулы положительный.
Правильный ответ 2.
22. Запишем уравнение реакции получения золя по реакции гидролиза(конденсационный метод). Реакция обратима, чтобы сместить равновесие реакции гидролиза раствор нагревают, разбавляют или подщелачивают.
AlCl3+3H2O ↔ Al(OH)3 (микрокристаллы) +3HCl
Соль AlCl3,взятая для гидролиза, всегда присутствует в растворе в избытке и потому является стабилизатором. Запишем уравнение диссоциации стабилизатора. Учтем, что в растворе присутствует n моль AlCl3.
n AlCl3→ nAl3+ + 3nCl -
В ядре мицеллы находится нерастворимый в воде микрокристалл Al(OH)3.В данном случае потенциалопределяющие ионы – анионы Al3+, противоионы – ионы Cl -. Мицелла золя гидроксида алюминия, полученного по реакции гидролиза AlCl3 может быть изображена следующим образом:
{[m Al(OH)3] ∙ n Al3+ 3(n-x) Cl - } 3x+∙3x Cl -∙ yH2O
 ядро
ядро  диф.слой гидрат.оболочка
диф.слой гидрат.оболочка
гранула
мицелла
Заряд гранулы положительный.
Продукты гидролиза могут взаимодействовать между собой с образование оксохлорида алюминия, который также может выступать в роли стабилизатора:
Al(OH)3 +HCl→ AlOCl + 2H2O
Запишем уравнение диссоциации стабилизатора:
n AlОCl→ nAlО+ + nCl -
В ядре мицеллы находится нерастворимый в воде микрокристалл Al(OH)3.В данном случае потенциалопределяющие ионы – анионы AlО+, противоионы – ионы Cl -. Мицелла золя гидроксида алюминия, может быть изображена следующим образом:
{[m Al(OH)3] ∙ n AlО+ (n-x) Cl - } x+∙x Cl -∙ yH2O
 ядро
ядро  диф.слой гидрат.оболочка
диф.слой гидрат.оболочка
гранула
мицелла
Заряд гранулы также положительный. По реакции гидролиза образуются коллоидные частицы только с положительным зарядом. Правильный ответ 3.
23. В данном случае методом получения золя является механическое диспергирование: серебро измельчили в растворе стабилизатора. Запишем уравнение диссоциации стабилизатора.
nAgNO3→ nAg+ + nNO3-
В ядре находятся микрочастицы серебра. Потенциало-
пределяющими ионами являются ионы Ag+, противоионами NO3-. Мицелла золя серебра:
{[mAg] ∙ nAg+ (n-x)NO3- } x+∙xNO3- ∙ yH2O
 ядро
ядро  диф.слой гидрат.оболочка
диф.слой гидрат.оболочка
гранула
мицелла
Заряд гранулы положительный. Правильный ответ 4.
24. Правильный ответ 3.
25. Запишем уравнение реакции получения золя по реакции обмена (конденсационный метод)
СaCl2(избыток) + Na2SO4 → СaSO4 (микрокристаллы) +2NaCl
Соль СaCl2 взята в избытке, значит СaCl2 является стабилизатором. Запишем уравнение диссоциации стабилизатора. Учтем, что в растворе присутствует n моль СaCl2.
n СaCl2 → nСa 2+ + 2nCl -
В ядре мицеллы находится нерастворимый в воде микрокристалл СаSO4. Потенциалопределяющими являются ионы адсорбирующиеся в первую очередь: по первому правилу Панета-Фаянса на поверхности полярного сорбента в первую очередь адсорбируются ионы, входящие в состав кристаллической решетки сорбента. Поскольку реакция проводится в избытке хлорида кальция на поверхности микрокристалла, в первую очередь адсорбируются ионы Сa 2+. В результате этого микрокристалл приобретает положительный заряд; ионы, сообщающие ему этот заряд, называются потенциалопределяющими (ПОИ). Правильный ответ 3.
26. Запишем уравнение реакции получения золя по реакции обмена (конденсационный метод)
СaCl2+ Na2SO4(избыток) → СaSO4 (микрокристаллы) +2NaCl
Соль Na2SO4 взята в избытке,значит Na2SO4 является стабилизатором. Запишем уравнение диссоциации стабилизатора. Учтем, что в растворе присутствует n моль Na2SO4.
n Na2SO4 → 2nNa + + 2nSO4 2-
В ядре мицеллы находится нерастворимый в воде микрокристалл СаSO4. Потенциалопределяющими являются ионы, адсорбирующиеся в первую очередь: по первому правилу Панета-Фаянса на поверхности полярного сорбента в первую очередь адсорбируются ионы, входящие в состав кристаллической решетки сорбента. Поскольку реакция проводится в избытке сульфата натрия на поверхности микрокристалла, в первую очередь адсорбируются ионы SO4 2-. В результате этого микрокристалл приобретает отрицательный заряд; ионы, сообщающие ему этот заряд, называются потенциалопределяющими (ПОИ). Правильный ответ 1.
27. Соли взяты в равных объемах, но концентрация бромида калия 0,002М больше, чем концентрация нитрата серебра 0,001М, следовательно, бромид калия взят в избытке (стабилизатор).
AgNO3+ KBr(избыток) → AgBr(микрокристаллы) + KNO3
Мицелла золя, образующегося при взаимодействии избытка бромида калия с нитратом серебра, имеет следующее строение:
{[mAgBr] ∙ n Br– (n-x) K+ } x-∙x K+ ∙ yH2O
 ядро
ядро  диф.слой гидрат.оболочка
диф.слой гидрат.оболочка
гранула
мицелла
Диффузионный слой мицеллы образован ионами калия.
Правильный ответ 3.
28. Концентрации солей одинаковы, но обем взятого раствора хлорида магния 20мл больше, чем объем раствора карбоната натрия 10мл, следовательно, хлорид магния взят в избытке.
MgCl2(избыток) + Na2CO3 → СaCO3 (микрокристаллы) +2NaCl
Построим мицеллу золя карбоната магния, полученную по реакции обмена в избытке хлорида магния (стабилизатор MgCl2). Запишем уравнение диссоциации стабилизатора:
nMgCl2 →nMg2+ + 2nCl-
В ядре мицеллы располагается карбонат магния. ПОИ – ионы магния, противоионы - Cl-
{[mMgCO3] ∙ n Mg2+ 2(n-x) Cl- } 2x+∙2x Cl- ∙ yH2O
 ядро
ядро  диф.слой гидрат.оболочка
диф.слой гидрат.оболочка
гранула
мицелла
Диффузионный слой мицеллы образован хлорид-ионами.
Правильный ответ 4.
29.1. 1; 30. 4.
31. Мицелла золя, образующегося при взаимодействии избытка бромида калия с нитратом серебра, имеет следующее строение:
{[mAgBr] ∙ n Br– (n-x) K+ } x-∙x K+ ∙ yH2O
 ядро
ядро  диф.слой гидрат.оболочка
диф.слой гидрат.оболочка
гранула
мицелла
Коллоидная частица (гранула) заряжена отрицательно, значит, она будет перемещаться в электрическом поле к положительному электроду. Правильный ответ 3.
32. Мицелла золя, образующегося при взаимодействии избытка нитрата серебра с бромидом калия, имеет следующее строение:
{[mAgBr] ∙ nAg+ (n-x) NO3- } x+∙x NO3- ∙ yH2O
 ядро
ядро  диф.слой гидрат.оболочка
диф.слой гидрат.оболочка
гранула
мицелла
Коллоидная частица (гранула) заряжена положительно, значит, она будет перемещаться в электрическом поле к отрицательному электроду. Правильный ответ 1
33.2; 34.2. 3; 35. 4; 36. 1; 37. 3;
38. Построим мицеллу золя карбоната магния, полученную по реакции обмена в избытке хлорида магния (стабилизатор MgCl2). Запишем уравнение диссоциации стабилизатора:
nMgCl2 →nMg2+ + 2nCl-
В ядре мицеллы располагается карбонат магния. ПОИ – ионы магния, противоионы - Cl-
{[mMgCO3] ∙ n Mg2+ 2(n-x) Cl- } 2x+∙2x Cl- ∙ yH2O
 ядро
ядро  диф.слой гидрат.оболочка
диф.слой гидрат.оболочка
гранула
мицелла
Гранула золя заряжена. Коагулирующее действие оказывают ионы противоположного знака. В данном случае – анионы электролита. Правильный ответ 3.
39. Построим мицеллу золя карбоната кальция, полученную по реакции обмена в избытке карбоната натрия (стабилизатор Na2CO3). Запишем уравнение диссоциации стабилизатора:
n Na2CO3→2nNa+ + nCO32-
В ядре мицеллы располагается карбонат магния. ПОИ – ионы магния, противоионы - Cl-
{[mСаCO3] ∙ n CO32-2(n-x) Na+ } 2x-∙2x Na+ ∙ yH2O
 ядро
ядро  диф.слой гидрат.оболочка
диф.слой гидрат.оболочка
гранула
мицелла
Гранула золя заряжена отрицательно. Коагулирующее действие оказывают ионы противоположного знака. В данном случае – катионы электролита.
Правильный ответ 1.
40. Построим мицеллу золя оксалата кальция, полученную по реакции обмена в избытке хлорида кальция (стабилизатор СаCl2). Запишем уравнение диссоциации стабилизатора:
nСаCl2 →nСа2+ + 2nCl-
В ядре мицеллы располагается оксалат кальция. ПОИ – ионы кальция, противоионы - Cl-
{[mСаC2O4] ∙ n Са2+ 2(n-x) Cl- } 2x+∙2x Cl- ∙ yH2O
 ядро
ядро  диф.слой гидрат.оболочка
диф.слой гидрат.оболочка
гранула
мицелла
Гранула золя заряжена положительно. Коагулирующее действие оказывают ионы противоположного знака. В данном случае – анионы электролита. Максимальным коагулирующим действием по правилу Щульце-Гарди будет обладать ион с наибольшим по модулю зарядом PO43- .
Правильный ответ 1.
41. Построим мицеллу золя оксалата кальция, полученную по реакции обмена в избытке хлорида кальция (стабилизатор Na2C2O4). Запишем уравнение диссоциации стабилизатора:
n Na2C2O4 →2nNа+ + nC2O42-
В ядре мицеллы располагается карбонат магния. ПОИ – оксалат-ионы, противоионы - Nа+
{[mСаC2O4] ∙ n C2O42- 2(n-x) Nа+ } 2x-∙2x Nа+∙ yH2O
 ядро
ядро  диф.слой гидрат.оболочка
диф.слой гидрат.оболочка
гранула
мицелла
Гранула золя заряжена отрицательно. Коагулирующее действие оказывают ионы противоположного знака. В данном случае – катионы электролита. Максимальным коагулирующим действием по правилу Щульце-Гарди будет обладать ион с наибольшим зарядом Al3+ . Правильный ответ 2.
42. 2; 43. 1; 44. 4; 45. 2; 46. 1; 47. 3; 48. 4
ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
1. Заряд комплексного иона – внутренней сферы - равен заряду внешней сферы.


 , где NO-
, где NO-  и NH
и NH  - лиганды
- лиганды
внутрен.сфера внешн.сфера
Заряд внешней сферы: 2×(-1)= -2, значит заряд внутренней сферы, т.е. комплексного иона равен 2+. Правильный ответ 2.
2. Сначала определим заряд комплексного иона:


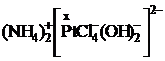
внешняя сфера внутренняя сфера
Заряд внешней сферы: 2×(+1)= +2, значит заряд внутренней сферы, т.е. комплексного иона равен 2-.
Определим заряд комплексообразователя –х. Складываем заряды к. о. и лигандов.
Х+4×(-1) + 2×(-1) = -2
Х-4-2= -2
Х= +4. Правильный ответ 3
3. Сначала определим заряд комплексного иона:



Внутренняя сфера Внешняя сфера
Заряд внешней сферы: 2-, значит заряд внутренней сферы, т.е. комплексного иона равен 2+. Определим заряд комплексообразования –х. Складываем заряды к.о. и лигандов:
Х+ (-1) + 5×0= +2
Х=+3. Правильный ответ 2.
4. Координационное число определяется по количеству образуемых к.о. σ-связей или количеству лигандов, если они монодентантные, т.е. образуют по одной σ-связи с к.о. и занимают одно место в координационной сфере. В данном комплексном соединении лигандами являются  и
и  , которые относятся к монодентантным. Следовательно, координационное число будет равно числу лигандов: 4+2=6.
, которые относятся к монодентантным. Следовательно, координационное число будет равно числу лигандов: 4+2=6.
Правильный ответ 3.
5.Лиганд  , имеющий структурную формулу
, имеющий структурную формулу  - бидентантный лиганд. Он образует две
- бидентантный лиганд. Он образует две  -связи с к.о.. Поэтому координационное число в 2 раза больше, чем число лигандов, т.е. 6. Правильный ответ 4.
-связи с к.о.. Поэтому координационное число в 2 раза больше, чем число лигандов, т.е. 6. Правильный ответ 4.
6.  и
и  взятые в данном примере являются монодентантными лигандами. Следовательно, координационное число равно числу лигандов. Во всех соединениях, кроме третьего, координационное число равно 4. В соединении
взятые в данном примере являются монодентантными лигандами. Следовательно, координационное число равно числу лигандов. Во всех соединениях, кроме третьего, координационное число равно 4. В соединении  координационное число равно 6.
координационное число равно 6.
Правильный ответ 3.
7. Центральным атомом к.о.- в данном случае может выступать только положительно заряженный ион  . Его координационное число равно 4 (чаще всего к.ч. равно заряду иона, умноженному на 2).
. Его координационное число равно 4 (чаще всего к.ч. равно заряду иона, умноженному на 2).  - нейтральные лиганды, их число должно быть равно 4. Этим условиям отвечает только формула
- нейтральные лиганды, их число должно быть равно 4. Этим условиям отвечает только формула  . Правильный ответ 2.
. Правильный ответ 2.
8. Между к.о. и лигандами образуется ковалентная полярная связь по обменному или донорно-акцепторному механизму.
Правильный ответ 1.

 9. Чтобы дать правильное название, определим заряд внутренней сферы и степень окисления к.о.
9. Чтобы дать правильное название, определим заряд внутренней сферы и степень окисления к.о.

внешняя сфера внутренняя сфера
Заряд внешней сферы: 3×(+1) =+3 равен по абсолютному значению заряду внутренней сферы: 3-. Знак заряда «-» - значит комплексное соединение анионного типа- в названии к.о. будет латинский корень, а также окончание ат.-феррат.
Определим степень окисления к.о. –х. Сумма зарядов лигандов и к.о. равно заряду комплексного иона: -3
Х+ 5×(-1)+0= -3 Х-5=-3 Х=+2
|
 и
и  . Поэтому, в названии комплексного иона первыми перечисляют заряженные лиганды
. Поэтому, в названии комплексного иона первыми перечисляют заряженные лиганды  (циано), а потом нейтральные
(циано), а потом нейтральные  (аммин). Если лигандов несколько, то их перечисляют в алфавитном порядке.
(аммин). Если лигандов несколько, то их перечисляют в алфавитном порядке.

|
|






