Натрия пентацианомоноамминферрат (+2). Если лиганд один, то приставка «моно» обычно не пишется. Правильный ответ 3.
10. Чтобы дать правильное название, определим заряд внутренней сферы и степень окисления комплексообразователя.
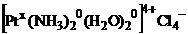
внешняя среда внутренняя среда
Заряд внешней сферы: 4.(-1)=-4 равен по абсолютному значению заряду внутренней сферы: 4+ Знак заряда «+» - значит комплексное соединение катионного типа – в названии комплексообразователя русский корень – платина. Определим степень окисления комплексообразователя – х. Сумма зарядов лигандов и комплексообразователя равна заряду комплексного иона: +4.
х + 2 • 0 + 2 • 0 = +4
х = +4.
Данное комплексное соединение смешанного типа, в качестве лигандов выступают нейтральные молекулы 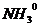 и
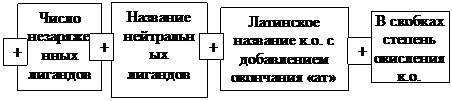
и 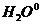 их перечисляют в алфавитном порядке: сначала «аква» а потом «аммин» название катионного комплексного соединения = число заряженных лигандов + название анионных лигандов + число незаряженных лигандов + название нейтральных лигандов + русское название к.о. + в скобках степень окисления комплексообразователя + название аниона внешней среды диаквадиамминплатины (+4) хлорид.
их перечисляют в алфавитном порядке: сначала «аква» а потом «аммин» название катионного комплексного соединения = число заряженных лигандов + название анионных лигандов + число незаряженных лигандов + название нейтральных лигандов + русское название к.о. + в скобках степень окисления комплексообразователя + название аниона внешней среды диаквадиамминплатины (+4) хлорид.
Правильный ответ 2.
11. Чтобы дать правильное название, определим заряд внешней сферы и степень окисления комплексообразователя
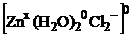
внутренняя среда
В данном комплексном соединении нет внешней сферы, т.е. заряд внутренней среды равен 0. Это нейтральное комплексное соединение. В нейтральном комплексном соединении дается русское название комплексообразователя. Определим степень окисления комплексообразователя – х. Сумма зарядов лигандов и комплексообразователя равна 0.
х+2·0+(-1)·2=0 х=+2.
Данное комплексное соединение смешанного типа. В качестве лигандов выступают нейтральные молекулы 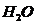 и
и 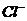 заряженные лиганды перечисляем первыми. Название нейтрального комплексного соединения + число заряженных лигандов + название анионных лигандов + число незаряженных лигандов + название нейтральных лигандов + русское название комплексообразователя + в скобках степень окисления к.о. дихлородиаквацинк (+2). Правильный ответ 3.
заряженные лиганды перечисляем первыми. Название нейтрального комплексного соединения + число заряженных лигандов + название анионных лигандов + число незаряженных лигандов + название нейтральных лигандов + русское название комплексообразователя + в скобках степень окисления к.о. дихлородиаквацинк (+2). Правильный ответ 3.
12. Сначала определим какой ион будет выступать в роли комплексообразователяю Это 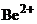 Затем определим координационное число этого иона. Обычно координационное число в 2 раза больше, чем заряд иона, значит координационное число равно 4. Составляем формулу
Затем определим координационное число этого иона. Обычно координационное число в 2 раза больше, чем заряд иона, значит координационное число равно 4. Составляем формулу 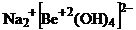 название натрия тетрагидроксобериллат (+2). Правильный ответ 3.
название натрия тетрагидроксобериллат (+2). Правильный ответ 3.
13. В качестве комплексообразователя здесь выступает 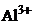 Его координационное число обычно равно 6 (в 2 раза больше, чем заряд). Значит формула соединения
Его координационное число обычно равно 6 (в 2 раза больше, чем заряд). Значит формула соединения 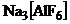 Названиенатрия гексафтороалюминат (+3). Правильный ответ 3.
Названиенатрия гексафтороалюминат (+3). Правильный ответ 3.
14. Между комплексным ионом и ионами внешней сферы связь полярная, приближается к ионной, поэтому в растворах комплексное соединение ведет себя как сильный электролит и диссоциирует нацело на комплексный ион и ионы внешней среды.
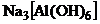
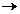

Правильный ответ 4.
15. Между комплексообразователем и лигандами связь менее полярная образуется по донорно- акценторному механизму. Комплексные ионы ионизируют обратимо и ступенчато.
Комплексные ионы ионизируют обратимо и ступенчато.
I ступень 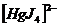
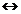
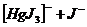
II ступень 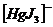
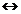
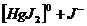
III ступень 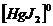
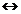
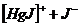
IV ступень 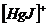
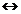
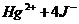
Суммарно: 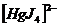
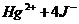 Третья ступень ионизации отражает уравнение
Третья ступень ионизации отражает уравнение 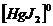
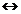
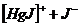
Правильный ответ 4.
16. Рассмотрим поведение 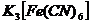 в растворе. Сначала происходит диссоциация комплексного соединения на комплексный ион и ионы внешней среды
в растворе. Сначала происходит диссоциация комплексного соединения на комплексный ион и ионы внешней среды 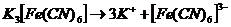 это необратимый процесс. Комплексные ионы в отличие от комплексных соединений ионизируют обратимо и ступенчато. В растворах устанавливается равновесие между комплексными ионами, ионами – комплексообразователями и свободными лигандами. Запишем уравнение ионизации комплексного иона
это необратимый процесс. Комплексные ионы в отличие от комплексных соединений ионизируют обратимо и ступенчато. В растворах устанавливается равновесие между комплексными ионами, ионами – комплексообразователями и свободными лигандами. Запишем уравнение ионизации комплексного иона 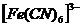 - всего 6 ступеней.
- всего 6 ступеней.
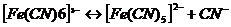
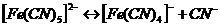
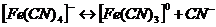
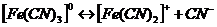
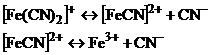
Суммарно: 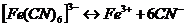
Константа равновесия
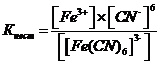 называется константой нестойкости комплексного иона. Правильный ответ 3.
называется константой нестойкости комплексного иона. Правильный ответ 3.
17. Запишем уравнение диссоциации комплексного соединения 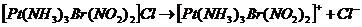 В качестве анионов образуется
В качестве анионов образуется 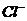 . Правильный ответ 1.
. Правильный ответ 1.
18. Запишем суммарное уравнение ионизации комплексного иона 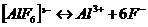 и выражение константы нестойкости
и выражение константы нестойкости 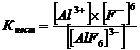 Концентрация лиганда входит в степени 6. Правильный ответ 3.
Концентрация лиганда входит в степени 6. Правильный ответ 3.
19. Чем меньше константа нестойкости 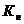 тем меньше степень расхода соответствующего иона, тем он следовательно более устойчив. Из этих четырех комплексных ионов наиболее устойчив
тем меньше степень расхода соответствующего иона, тем он следовательно более устойчив. Из этих четырех комплексных ионов наиболее устойчив 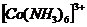 , т.к.
, т.к. 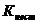 данного иона имеет наименьшую величину. Правильный ответ 4.
данного иона имеет наименьшую величину. Правильный ответ 4.
20. Процесс ионизации комплексного иона – процесс обратимый 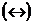 . Уравнения 2,3,4 отражают ионизацию комплексного иона
. Уравнения 2,3,4 отражают ионизацию комплексного иона 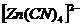 по первым трем стадиям и записаны верно. Ошибка была сделана при написании первого уравнения, т.к. процесс диссоциации комплексного соединения процесс необратимый
по первым трем стадиям и записаны верно. Ошибка была сделана при написании первого уравнения, т.к. процесс диссоциации комплексного соединения процесс необратимый 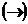 и должен быть изображен так:
и должен быть изображен так:
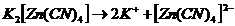 . Правильный ответ 1.
. Правильный ответ 1.
ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ XI. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
1.В формуле серной кислоты проставим известные степени окисления. У водорода степень окисления +1, у кислорода -2.
У серы обозначим степень окисления х.
H+12SхO-24
Пользуясь правилом, что сумма всех степеней окисления в молекуле равна нулю, составляем уравнение:
2·(+1) + х + 4·(-2) = 0
2 + х – 8 = 0
х = +6
Правильный ответ 4.
2. В формуле иона аммония проставим известные степени окисления. У водорода степень окисления +1. У азота обозначим степень окисления х.
NхH+14+
Пользуясь правилом, что сумма всех степеней окисления в ионе равна заряду иона, т.е.1 (у иона NH4+ заряд +1) составляем уравнение
х + 4·(+1) = 1
х + 4 = 1
х = -3
Правильный ответ 3.
3.1;4.4;5.3;6.4.
7. Посчитаем степени окисления у элементов, входящих в состав данных веществ. В Fe+2Cl-2 и катион и анион находятся в низшей степени окисления. Это вещество не может быть окислителем. Mgо – это простое вещество металл, может быть только восстановителем. H+Cl+7O-24 – хлорная кислота, содержит хлор в степени окисления +7. Это максимальная степень окисления для данного элемента. HClO4 может быть только окислителем. Правильный ответ 4.
8. Определим степени окисления у элементов, входящих в состав данных веществ:
K+2Cr+6O-24 – хромат калия содержит хром в степени окисления +6. Это максимальная степень окисления для данного элемента. K2CrO4 может быть только окислителем. Fe+3Cl-3 – хлорид железа (III) содержит катион железа в максимально возможной степени окисления +3, - тоже только окислитель. Оксид алюминия Al2 +3O-23 , содержит алюминий в степени окисления +3 – максимальная и единственно возможная степень окисления для алюминия. Тоже только окислитель. Fe+2Cl-2 – хлорид железа (II), содержит катион железа в низшей степени окисления +2. Это вещество не может быть окислителем, может быть только восстановителем. Правильный ответ 3.
9. Определим степени окисления у элементов, входящих в состав данных веществ. H+N+5O-23 – азотная кислота содержит азот в максимальной степени окисления +5 – только окислитель. Fe+2S-2 – сульфид железа (II) содержит катион Fe2+ в низшей степени окисления +2 и анион S2- тоже в низшей степени окисления серы – только восстановитель. К+Вr- – бромид калия содержит Br- в низшей степени окисления – только восстановитель. SO2 – оксид серы (IV), содержит серу в промежуточной степени окисления +4 (максимальная степень окисления, характерная для серы +6, минимальная -2) – обладает окислительно-восстановительной двойственностью, может быть и окислителем и восстановителем. Правильный ответ 3.
10. Окислители – это вещества, в составе которых есть атомы,
способные присоединять электроны. Определим степени окисления у элементов, входящих в состав данных веществ.
K+N+3O-22 + K+Cl+5O-23 → K+Cl- + K+N+5O-23
Запишем электронные уравнения:
N+3- 2е → N+5 (азот отдает 2е, значит является восстановителем)
Cl+5 +6е → Cl- (хлор принимает 6е, значит является окислителем) Cl+5 входит в состав KClO3, значит он выполняет роль окислителя. Правильный ответ 2.
11. Восстановители – вещества, в составе которых есть атомы, способные отдавать электроны. Определим степени окисления у элементов, входящих в состав данных веществ.
Ро +K+Cl+5O-23 → P2+5O-25 + K+Cl-
Запишем электронные уравнения:
2Ро- 10е → 2Р+5 (фосфор отдает электроны, значит является восстановителем)
Cl+5 +6е → Cl- (хлор принимает электроны, значит является окислителем). Р выполняет роль восстановителя.
Правильный ответ 1.
12. В данной реакции: S + H2SO4 (конц.) → SO2 +H2O, участвуют S в степени окисления 0 и серная кислота, содержащая серу в максимальной степени окисления +6. Следовательно, H2SO4 выполняет роль окислителя. Правильный ответ 4.
13. Определим степени окисления у элементов, входящих в состав данных веществ.
Mn+4O-22 + H+Cl- → Mn+2Cl-2 + Clо2 + H2O
Запишем электронные уравнения:
2Cl- - 2е → Clо2 (отдает электроны, значит является восстановителем)
Mn+4+ 2е → Mn+2 (принимает электроны, значит является окислителем)
Cl- входит в состав соляной кислоты, значит HCl выполняет роль восстановителя. Правильный ответ 2.
14. Определим степени окисления элементов, входящих в состав веществ, участвующих в реакции:
Na+N+5O-23 → Na+N+3O-22 + Oо2.Изменяются степени окисления у N +5 и у O-2. N +5 – окислитель и O-2 – восстановитель.Это два разных элемента в составе одной и той же молекулы. Тип реакции – внутримолекулярная. Правильный ответ 1.
15. Определим степени окисления элементов, входящих в состав веществ, участвующих в реакции:
CН3С+2НО + Аg+2О → CН3С+4ООН +2Аgо
Изменяются степени окисления у углерода (восстановитель) и серебра (окислитель). Это два разных элемента, входящих в состав разных молекул. Тип реакции – межмолекулярная. Правильный ответ 2.
16. Определим степени окисления элементов, входящих в состав веществ, участвующих в реакции:
C1о2 + KOH = KC1 -1 + KC1+5O + H2O
Изменяется степень окисления только у одного элемента – хлора. Это один и тот же элемент C1о, в одной и той степени окисления, входящий в состав одной и той же молекулы C1о2, является одновременно и окислителем и восстановителем. Тип реакции – диспропорционирования. Правильный ответ 3.
17.3; 18.2
19. Расставим коэффициенты в уравнении методом ионно-электронного баланса. Молекулярная схема реакции:
Cr2(SO4)3 + NaBiO3 +NaOH+ H2O →Na2CrO4 + Bi(OH)3 +Na2SO4
Ионно-молекулярная схема реакции:
2Cr3+ +3SO42- + Na+ + BiO3- + Na+ + OH-+ H2O → Na+ + 2CrO42- + Bi(OH)3↓ +2 Na++2SO42-
Краткая ионно-молекулярная схема реакции:
2Cr3+в-ль + Bi+5O3-oк-ль + OH- + H2O → 2Cr+6O42-продуктт ок-ния+ Bi+3(OH)3↓ продукт вос-ния
Составим уравнение полуреакции процесса окисления:
2Cr3+ → 2CrO42-
Среда щелочная, т.к. в левой части уравнения есть NaOH. Воду ставим в ту сторону уравнения, где избыток атомов «О». Разница в 8 атомов «О». Следовательно в правую часть уравнения ставим в два раза больше, т.е. 16 ионов OH-:
2Cr3+ + 16OH- → 2CrO42- + 8 H2O
Считаем заряды у левой и правой частей уравнения. Слева: 2·(+3) + 16·(-1) = -10. Справа: 2·(-2) + 8·0 = -4. чтобы из -10 перейти в -4 надо отнять 6е:
2Cr3+ + 16OH- - 6е → 2CrO42- + 8 H2O процесс окисления
Составим уравнение полуреакции процесса восстановления:
BiO3- → Bi(OH)3
Атомы кислорода уравнены, атомы водорода нет. На каждый лишний атом «Н» в правой части уравнения полуреакции ставим столько же групп OH- т.е. 3. В левой части уравнения ставим 3 молекулы H2O:
BiO3- + 3H2O → Bi(OH)3 +3OH-
Считаем заряды у левой и правой частей уравнения. Слева: -1 + 3·0 = -1. Справа: 0 + 3· (-1) = -3. Чтобы из -1 перейти в -3 надо 2е:
BiO3- + 3H2O +2е → Bi(OH)3 +3OH- процесс восстановления
Напишем оба уравнения полуреакций. Учтем, что число электронов, отданных восстановителем равно числу электронов принятых окислителем. НОК=6
2Cr3+ + 16OH- - 6е → 2CrO42- + 8 H2O │1 ок-ние
BiO3- + 3H2O +2е → Bi(OH)3 +3OH- │3вос-ние
__________________________________
2Cr3++16OH- + 3BiO3- + 9H2O ® 2CrO42- + 8 H2O + Bi(OH)3 +9OH- (ионно-молекулярное уравнение).
Сокращаем одинаковые ионы ОН- и молекулы воды:
2Cr3++7OH- + 3BiO3-+ H2O ® 2CrO42- + 2H2O + 3Bi(OH)3 (краткое ионно-молекулярное уравнение)
В молекулярной форме уравнение имеет вид
Cr2(SO4)3 + 3NaBiO3 + 7NaOH+ H2O →2Na2CrO4 + 3Bi(OH)3 +3Na2SO4
Перед окислителем NaBiO3 стоит коэффициент 3.
Правильный ответ 3.
20. Расставим коэффициенты в уравнении методом ионно-электронного баланса Молекулярная схема реакции: MnO2 + H2O2 + H2SO4 → MnSO4 + O2 + H2O
Ионно-молекулярная схема реакции:
MnO2 + H2O2 +2H+ + SO42- → Mn2+ +SO42- + O2 + H2O
Меняет степень окисления кислород и марганец. Составляем уравнения полуреакций с учетом того, что среда кислая.
MnO2 +4H+ + 2е → Mn2+ + 2 H2O │1 вос-ние
H2O2 -2е → O2 + 2H+ │1 ок-ние
____________________________________________________
MnO2 +4H+ + H2O2 → Mn2+ + 2 H2O +O2 + 2H+ (ионно-молекулярное уравнение).
MnO2 +2H+ + H2O2 → Mn2+ + 2 H2O +O2 (краткое ионно-молекулярное уравнение)
В молекулярной форме уравнение имеет вид
MnO2 + H2O2 + H2SO4 → MnSO4 + O2 + 2H2O
H2O2 – восстановитель, коэффициент перед ним 1.
п равильный ответ 1.
21. Расставим коэффициенты в уравнении методом ионно-электронного баланса Молекулярная схема реакции: HClO3 + H2S → HCl +S
Меняет степень окисления хлор и сера. Составим уравнения полуреакций с учетом того, что среда кислая
HClO3 + 6H+ + 6е → НСl + 3H2O │1 вос-ние
H2S -2е → S + 2H+ │3 ок-ние
____________________________________________________
HClO3 + 6H+ + 3H2S → НСl + 3H2O +3S + 6H+
HClO3 + 3H2S → НСl + 3H2O + 3S
Cчитаем сумму коэффициентов в левой части уравнения 3 (перед H2S) и 1 (перед HClO3). Итого 4.
Правильный ответ 3.
22. Расставим коэффициенты в уравнении методом ионно-электронного баланса. Молекулярная схема реакции:
KMnO4 + С6Н12О6 + H2SO4 ® MnSO4 + СО2 + H2O + K2SO4
Ионно-молекулярная схема реакции:
K+ + MnO 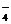 + С6Н12О6 +2H++ SO
+ С6Н12О6 +2H++ SO 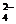 ® Mn2+ + SO
® Mn2+ + SO 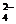 + СО2 + H2O + 2K+ +SO
+ СО2 + H2O + 2K+ +SO 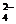 .
.
Краткая ионно-молекулярная схема реакции:
MnO 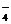 + С6Н12О6 +2H+® Mn2+ + СО2 + H2O
+ С6Н12О6 +2H+® Mn2+ + СО2 + H2O
oк-ль в-ль продукт в-ния продукт ок-ия
Составим уравнения полуреакций с учетом того, что среда кислая. В уравнении полуреакции с глюкозой надо поставить 6 перед молекулой СО2, чтобы в первую очередь уравнять атомы углерода:
MnO 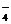 + 8H+ + 5e- ® Mn2+ + 4H2O │24 вос-ние
+ 8H+ + 5e- ® Mn2+ + 4H2O │24 вос-ние
С6Н12О6 +6 H2O -24е® 6СО2+ 24H+ │5 ок-ние
____________________________________________________
24MnO 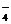 +192H++ 5С6Н12О6 +30H2O ® 24Mn2+ + 96H2O + 30СО2 + 120H+
+192H++ 5С6Н12О6 +30H2O ® 24Mn2+ + 96H2O + 30СО2 + 120H+
24MnO 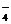 +72H++ 5С6Н12О6 ® 24Mn2+ + 66H2O + 30СО2
+72H++ 5С6Н12О6 ® 24Mn2+ + 66H2O + 30СО2
24KMnO4 +5С6Н12О6 + 36H2SO4 ® 24MnSO4 + 30СО2 + 66H2O + 12K2SO4
Сумма всех коэффициентов в уравнении реакции равна 197. Правильный ответ 3.
23. Расставим коэффициенты в уравнении методом ионно-электронного баланса Молекулярная схема реакции:
Na2SO3 + KIO3 + H2SO4→ I2+ Na2SO4 + К2SO4+Н2О
Ионно-молекулярная схема реакции:
2Na+ + SO32- + K+ + IO3- +2H++ SO 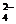 ® I2 + 2Na+ + SO
® I2 + 2Na+ + SO 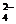 +2K+ +SO
+2K+ +SO 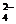 + H2O
+ H2O
Краткая ионно-молекулярная схема реакции:
SO32- + IO3- +2H+ ® I2 + SO 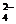 + H2O
+ H2O
Меняет степень окисления сера и йод. Учтем, что среда кислая.
SO32- + H2O -2е ® SO 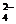 + 2H+ │5 ок-ние
+ 2H+ │5 ок-ние
2IO3- +12H+ +10е® I2 + 6H2O │1 вос-ние
__________________________
5SO32- + 5H2O +2IO3- +12H+ ® 5SO 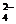 + 10H+ + I2 + 6H2O
+ 10H+ + I2 + 6H2O
5SO32- +2IO3- +2H+ ® 5SO 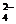 + I2 + H2O
+ I2 + H2O
5Na2SO3 +2 KIO3 + H2SO4→ I2+ 5Na2SO4 + К2SO4+Н2О
Восстановителем в данной реакции является Na2SO3. Следовательно, коэффициент перед молекулой восстановителя 5.
Правильный ответ 1.
24. Расставим коэффициенты в уравнении методом ионно-электронного баланса Молекулярная схема реакции:
K2S + KMnO4 + H2SO4→S + MnSO4 + K2SO4 +H2O
Ионно-молекулярная схема реакции:
2K+ +S2- + K+ + MnO 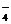 +2H++ SO
+2H++ SO 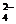 ® S + Mn2+ + SO
® S + Mn2+ + SO 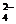 + 2K+ +SO
+ 2K+ +SO 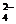 + H2O
+ H2O
Краткая ионно-молекулярная схема реакции:
S2- + MnO 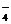 +2H+ ® S + Mn2+ + H2O
+2H+ ® S + Mn2+ + H2O
Меняет степень окисления сера и марганец. Учтем, что среда кислая.
MnO 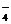 + 8H+ + 5e- ® Mn2+ + 4H2O │2 вос-ние
+ 8H+ + 5e- ® Mn2+ + 4H2O │2 вос-ние
S2- -2е ® S │5ок-ние
_______________________________
2MnO 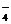 +16H+ + 5S2- ® 2Mn2+ + 8H2O + 5S
+16H+ + 5S2- ® 2Mn2+ + 8H2O + 5S
5K2S + 2KMnO4 + 8H2SO4→5S + 2MnSO4 + 6K2SO4 +8H2O
Окислителем в данной реакции является KMnO4. Следовательно, коэффициент перед молекулой окислителя 2. Правильный ответ 4.
25. Расставим коэффициенты в уравнении методом ионно-электронного баланса.
Молекулярная схема реакции:
С2Н4 + KMnO4 + H2O→MnO2 + С2Н4(ОH)2 + КОН
Ионно-молекулярная схема реакции:
С2Н4 + K+ + MnO 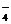 + H2O ® MnO2 + С2Н4(ОH)2 +K+ + ОН-
+ H2O ® MnO2 + С2Н4(ОH)2 +K+ + ОН-
Краткая ионно-молекулярная схема реакции:
С2Н4 + MnO 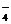 + H2O ® MnO2 + С2Н4(ОH)2 + ОН-
+ H2O ® MnO2 + С2Н4(ОH)2 + ОН-
Меняет степень окисления углерод и марганец. Составим уравнения полуреакций с учетом того, что среда щелочная.
С2Н4 + 2ОН--2е ® С2Н4(ОH)2 │3 ок-ние
MnO 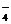 + 2H2O + 3е® MnO2 + 4 ОН-│2 вос-ние
+ 2H2O + 3е® MnO2 + 4 ОН-│2 вос-ние
__________________________________
3С2Н4 + 6ОН- + 2MnO 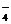 + 4H2O ® 3С2Н4(ОH)2 + 2MnO2 + 8ОН-
+ 4H2O ® 3С2Н4(ОH)2 + 2MnO2 + 8ОН-






