Подставим численные значения концентраций ионов:
ПК = 1,5 ×10-3 ×(3 ×10-3)2 = 13,5 ×10-9 = 1,35 ×10-8 ~ 1,4 ×10-8.
Сравним ПК с ПР = 1,4 ×10-8. ПК ~ ПР, следовательно, раствор насыщенный. Правильный ответ: 1.
9. Запишем условие задачи.
Дано:

 ПР -?
ПР -?
| Решение:
Запишем уравнение гетерогенного равновесия для осадка фосфата свинца:
 Запишем выражение ПР и возьмем его значение по данным таблицы произведения растворимости:
Запишем выражение ПР и возьмем его значение по данным таблицы произведения растворимости:
|
 .
.
Запишем выражение ПК:  .
.
Подставим численные значения концентраций ионов:  .
.
ПК < ПР – раствор ненасыщенный, осадка нет. Правильный ответ: 4.
10. Запишем условие задачи. Дополнительно определим, будет ли выпадать осадок. Для этого из справочных таблиц выпишем значение ПР.
Дано:
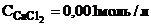


 ПК -?
ПК -?
| Решение:
Сначала запишем уравнение реакции ионного обмена:
 Для возможного осадка сульфата кальция запишем уравнение гетеро- генного равновесия:
Для возможного осадка сульфата кальция запишем уравнение гетеро- генного равновесия:

|
Запишем выражение ПР: 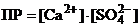 .
.
Запишем выражение ПК:  .
.
Чтобы найти произведение концентраций ионов надо рассчитать концентрации ионов в растворе, полученном при смешивании двух исходных растворов.
Запишем уравнение диссоциации  :
: 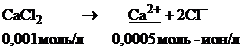
Исходная концентрация раствора  была 0,001 моль/л, при диссоциации 1 моль
была 0,001 моль/л, при диссоциации 1 моль  образуется 1 моль ионов
образуется 1 моль ионов  . В первый момент после сливания растворов молярные концентрации взятых реагентов понизятся вдвое (при смешивании равных объемов исходных растворов их общий объем стал в 2 раза больше, чем исходный объем каждого реагента). Следовательно, концентрация ионов
. В первый момент после сливания растворов молярные концентрации взятых реагентов понизятся вдвое (при смешивании равных объемов исходных растворов их общий объем стал в 2 раза больше, чем исходный объем каждого реагента). Следовательно, концентрация ионов  станет в 2 раза меньше, чем исходная концентрация соли
станет в 2 раза меньше, чем исходная концентрация соли  :
:
 .
.
Запишем уравнение диссоциации  :
:
 .
.
При диссоциации 1 моль  образуется 1 моль ионов
образуется 1 моль ионов  . Поскольку при смешивании исходных растворов общий объем раствора увеличивается в 2 раза, то концентрация ионов
. Поскольку при смешивании исходных растворов общий объем раствора увеличивается в 2 раза, то концентрация ионов  в 2 раза уменьшится.
в 2 раза уменьшится.
 .
.
Подставим найденные численные значения концентраций в выражение ПК:
 .
.
Сравним ПК и ПР:  .
.
Следовательно, раствор ненасыщенный, осадка не будет.
Правильный ответ: 1.
11. Запишем условие задачи. Дополнительно определим, будет ли выпадать осадок. Для этого из справочных таблиц возьмем значение ПР.
Дано:
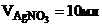

 ПК -?
ПК -?
| Решение:
Сначала запишем уравнение реакции ионного обмена:
 .
Для возможного осадка хлорида серебра запишем уравнение гетерогенного равновесия: .
Для возможного осадка хлорида серебра запишем уравнение гетерогенного равновесия:

|
Запишем выражение ПР:  .
.
Запишем выражение ПК:  .
.
Чтобы найти произведение концентраций ионов надо рассчитать концентрации ионов в растворе, полученном при смешивании двух исходных растворов. Общий объем раствора стал 15 мл.
Запишем уравнение диссоциации 
 .
.
Из 1 моль  образуется 1 моль ионов
образуется 1 моль ионов  . Молярная концентрация
. Молярная концентрация  в первый момент после смешивания понизится, и концентрация ионов
в первый момент после смешивания понизится, и концентрация ионов  станет равна:
станет равна:

Запишем уравнение диссоциации КСl:  .
.
Из 1 моль КСl образуется 1 моль ионов  . Молярная концентрация КСl в первый момент после смешивания понизится, и концентрация ионов
. Молярная концентрация КСl в первый момент после смешивания понизится, и концентрация ионов  станет равна:
станет равна:

Подставим найденные численные значения концентраций ионов в выражение ПК:
 .
.
Сравним ПК и ПР:  .
.
Следовательно, раствор пересыщенный, будет выпадать осадок. Правильный ответ: 3.
12. Запишем условие задачи.
Дано:

 -? -?
| Решение:
Запишем уравнение гетерогенного равновесия для хромата серебра  : :
|

Запишем выражение ПР:  .
.
Выразим концентрацию хромат-ионов  через концентрацию ионов серебра
через концентрацию ионов серебра  . По уравнению гетерогенного равновесия при ионизации
. По уравнению гетерогенного равновесия при ионизации  ионов
ионов  получается в 2 раза меньше, чем ионов
получается в 2 раза меньше, чем ионов  , т.о.
, т.о.  . Подставим найденную концентрацию хромат-ионов в произведение растворимости:
. Подставим найденную концентрацию хромат-ионов в произведение растворимости:

Правильный ответ: 2.
13. Запишем условие задачи. Не забудьте, что концентрация ионов в насыщенном растворе – это равновесная концентрация, обозначаемая квадратными скобками: 
Дано:
 ПР -?
ПР -?
| Решение:
Запишем уравнение гетерогенного равновесия:

|
Запишем выражение ПР: 
Выразим концентрацию сульфид-ионов  через концентрацию ионов железа
через концентрацию ионов железа  . По уравнению гетерогенного равновесия при ионизации FeS ионов
. По уравнению гетерогенного равновесия при ионизации FeS ионов  и ионов
и ионов  получается одинаковое количество, т.о.
получается одинаковое количество, т.о. 
Выражая в произведении растворимости  через
через  ,получаем:
,получаем:

Правильный ответ: 4.
14. Рассчитаем концентрацию ионов  для каждого из веществ, приведенных в задаче. ПР возьмем из приложения (таблица 5).
для каждого из веществ, приведенных в задаче. ПР возьмем из приложения (таблица 5).
1) Дано:

 -? -?
| Решение:
Запишем уравнение гетерогенного равновесия:

|
Запишем выражение ПР: 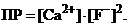
Выразим 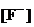 через
через  . По уравнению гетерогенного равновесия при ионизации
. По уравнению гетерогенного равновесия при ионизации  ионов
ионов  получается в 2 раза меньше, чем инов
получается в 2 раза меньше, чем инов  , т.о.:
, т.о.: 
Подставим найденную 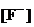 в ПР:
в ПР:

2) Дано:

 -? -?
| Решение:
Запишем уравнение гетерогенного равновесия:

|
Запишем выражение ПР: 
Выразим концентрацию оксалат-ионов 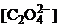 через
через  . По уравнению гетерогенного равновесия при ионизации
. По уравнению гетерогенного равновесия при ионизации  ионов
ионов  и ионов
и ионов  получается одинаковое количество, т.о.
получается одинаковое количество, т.о. 
Выражая в произведении растворимости 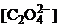 через
через  ,получаем:
,получаем:
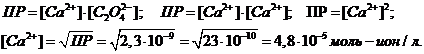
3) Дано:
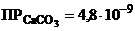
 -? -?
| Решение:
Решение этой задачи аналогично решению задачи № 2.
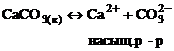
|

4) Дано:

 -? -?
| Решение:
Решение этой задачи аналогично решению задачи № 2 и № 3.

|

Сравним концентрацию ионов  в моль-ион/л:
в моль-ион/л:
1)  2)
2)  3)
3)  4)
4) 
Больше всего концентрация ионов кальция в задаче № 4.
Правильный ответ: 4.
15. Запишем уравнение гетерогенного равновесия:

Запишем выражение ПР: 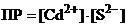 .
.
Обозначим молярную концентрацию в насыщенном растворе через S (моль/л). В растворе сульфид кадмия полностью диссоциирован на ионы. Поэтому молярные концентрации каждого иона – и  и
и  равны молярной концентрации содержащегося в растворе сульфида кадмия и также могут быть обозначены через S:
равны молярной концентрации содержащегося в растворе сульфида кадмия и также могут быть обозначены через S:
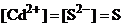
Подставим S в выражение  :
:

Можно посчитать значение растворимости, взяв ПР(CdS) из справочника.

Правильный ответ: 2.
16. Все эти соли состоят из двух ионов. Поэтому растворимость каждой из них может быть найдена по формуле:  , т.е. растворимость будет тем меньше, чем меньше величина ПР. Выпишем данные из таблицы произведений растворимости:
, т.е. растворимость будет тем меньше, чем меньше величина ПР. Выпишем данные из таблицы произведений растворимости:

Сравним значения ПР:

Т.к.  имеет наименьшее значение, значит
имеет наименьшее значение, значит  менее растворимо. Правильный ответ: 4.
менее растворимо. Правильный ответ: 4.
17. Запишем условие задачи.
Дано:

 -? -?
| Решение:
Запишем уравнение гетерогенного равновесия:

|
Запишем выражение ПР: 
Обозначим молярную концентрацию в насыщенном растворе через S (моль/л). В растворе сульфид серебра полностью диссоциирован на ионы. Но ионов  образуется в 2 раза больше, чем ионов
образуется в 2 раза больше, чем ионов  . Поэтому молярная концентрация
. Поэтому молярная концентрация  равна молярной концентрации содержащегося в растворе сульфида серебра и может быть обозначена через S:
равна молярной концентрации содержащегося в растворе сульфида серебра и может быть обозначена через S: 
 , а молярная концентрация ионов серебра в 2 раза больше молярной концентрации
, а молярная концентрация ионов серебра в 2 раза больше молярной концентрации  и может быть обозначена как 2S:
и может быть обозначена как 2S: 
Подставим полученные выражения в уравнение ПР:

Правильный ответ: 3.
18. Запишем уравнение гетерогенного равновесия:

Запишем выражение ПР: 
Обозначим молярную концентрацию в насыщенном растворе через S (моль/л). В растворе гидроксид хрома (Ш) полностью диссоциирован на ионы. Но ионов  образуется в 3 раза больше, чем ионов
образуется в 3 раза больше, чем ионов  . Поэтому молярная концентрация
. Поэтому молярная концентрация  равна молярной концентрации содержащегося в растворе гидроксида хрома (Ш) и может быть обозначена через S:
равна молярной концентрации содержащегося в растворе гидроксида хрома (Ш) и может быть обозначена через S: 
 , а молярная концентрация ионов
, а молярная концентрация ионов  в 3 раза больше молярной концентрации
в 3 раза больше молярной концентрации  и может быть обозначена как 3S:
и может быть обозначена как 3S: 
Подставим полученные выражения в уравнение ПР:

Правильный ответ: 1.
19. Все соли кальция приведенных в задании кислот растворимы. поэтому причиной смещения гетерогенного равновесия вправо не может быть образование менее растворимого вещества. Причина в образовании более слабого электролита – фосфорной кислоты  Выпишем из приложения (таблица 3) константы ионизации:
Выпишем из приложения (таблица 3) константы ионизации: 

 - сильная кислота, у нее нет константы ионизации. Из всех приведенных кислот только
- сильная кислота, у нее нет константы ионизации. Из всех приведенных кислот только  сильнее
сильнее  следовательно, именно в ней будет растворяться осадок
следовательно, именно в ней будет растворяться осадок 
 Схема поведения осадка:
Схема поведения осадка:
Уравнение реакции:  .
.
Ионы насыщенного раствора связываются с образованием слабого электролита – фосфорной кислоты. Гетерогенное равновесие смещается вправо. Осадок  растворяется в азотной кислоте. Правильный ответ: 3.
растворяется в азотной кислоте. Правильный ответ: 3.
20.Возможная причина растворения в образовании менее растворимого осадка, ПР которого меньше. 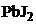 не растворится в NaJ и
не растворится в NaJ и 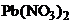 , т.к. в данных случаях не возникают условия для связывания ионов насыщенного раствора. Образование осадков возможно при добавлении NaCl и
, т.к. в данных случаях не возникают условия для связывания ионов насыщенного раствора. Образование осадков возможно при добавлении NaCl и  . Выпишем ПР возможных осадков из приложения таблица 5.
. Выпишем ПР возможных осадков из приложения таблица 5.  Карбонат свинца менее растворимое соединение.
Карбонат свинца менее растворимое соединение. 
 Схема поведения осадка:
Схема поведения осадка:
Уравнение реакции:  .
.
Ионы насыщенного раствора связываются с образованием осадка, ПР которого меньше. Гетерогенное равновесие смещается вправо. Осадок 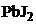 переходит в осадок
переходит в осадок 
Правильный ответ: 2.
21.При добавлении  произойдет образование осадков, ПР которых меньше.
произойдет образование осадков, ПР которых меньше.

 Гетерогенное равновесие не сместится только при добавлении
Гетерогенное равновесие не сместится только при добавлении  , т.к. в данном случае не образуется малорастворимого соединения. Правильный ответ: 2.
, т.к. в данном случае не образуется малорастворимого соединения. Правильный ответ: 2.
22. Осадок  не будет растворяться в NaOH, т.к. это основание, а не амфотерный гидроксид. В
не будет растворяться в NaOH, т.к. это основание, а не амфотерный гидроксид. В  данный осадок также не будет растворяться, т.к. продуктами реакции с добавленным к осадку раствору соли будут сильные электролиты, и связывание ионов насыщенного раствора не произойдет.
данный осадок также не будет растворяться, т.к. продуктами реакции с добавленным к осадку раствору соли будут сильные электролиты, и связывание ионов насыщенного раствора не произойдет.
В случае добавления раствора  возможно образование осадка. Сравним значения ПР:
возможно образование осадка. Сравним значения ПР:

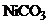 более растворимое вещество. Связывание ионов насыщенного раствора не произойдет. А вот в НС1 гидроксид никеля растворится.
более растворимое вещество. Связывание ионов насыщенного раствора не произойдет. А вот в НС1 гидроксид никеля растворится.
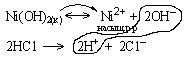 Схема поведения осадка:
Схема поведения осадка:
Уравнение реакции: 
Ионы насыщенного раствора связываются с образованием слабого электролита – воды. Гетерогенное равновесие смещается вправо. Осадок  растворяется в соляной кислоте.
растворяется в соляной кислоте.
Правильный ответ 3.
23. Охарактеризуем константами диссоциативного типа все вещества, участвующие в равновесии: иодид серебра и уксусную кислоту:
AgI(тв) ↔ Ag+ + I– (насыщ р-р);
ПР(AgI) = 1,5·10-16
CH3COOH ↔ H+ + CH3COO–;
K(CH3COOH) = [H+] ∙[CH3COO-]/[ CH3COOH]=1,74·10–5
Запишем уравнения реакций взаимодействия иодида серебра с уксусной кислотой.
AgI (тв) + CH3COOH ⇄ CH3COOAg + HI
AgI (тв) + CH3COOH ⇄ Ag+ +CH3COO– + H+ + I-
Запишем общую константу совмещенного равновесия для реакции исходя из определения.
Кравн= ПР(AgI)∙.К(CH3COOH) = 1,5·10-16∙1,74 ∙ 10-5=2,61 ∙ 10-21
Kравн < 1 и K равн < 1·10–5 иодид серебра в уксусной кислоте не растворяется, равновесие невозможно протекает только обратная реакция. Правильный ответ 2.
ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ VIII. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. АДСОРБЦИЯ
1. Чем полярнее жидкость, тем больше у нее поверхностное натяжение. Из рассмотренных жидкостей наибольшую полярность имеет вода, т.к. спирты содержат гидрофобную часть:  . По мере увеличения длины углеводородного радикала полярность жидкости уменьшается, и поверхностное натяжение увеличивается.
. По мере увеличения длины углеводородного радикала полярность жидкости уменьшается, и поверхностное натяжение увеличивается.
Среди указанных ответов есть раствор КСl, имеется в виду водный раствор хлорида калия. КСl по своей способности изменять поверхностное натяжение относится к ПИАВ (поверхностно-инактивным веществам) и увеличивает σ воды. Т.о. вещества располагаются в ряд: 
наибольшее значение σ имеет раствор КС1.
Правильный ответ: 3
2. Факторы, от которых зависит σ:
· температура;
· природа жидкости;
· наличие примесей;
· природа граничащих фаз.
Факторы, от которых не зависит σ:
· масса жидкости;
· объем жидкости;
· площадь поверхности жидкости;
· количество вещества жидкости.
Если взять одну и ту же жидкость различного объема (1 мл, 1 л, 1 м3 и т.д.) ее σ при этом не изменится. Правильный ответ: 2
3. ПАВ – поверхностно-активные вещества – уменьшают поверхностное натяжение той жидкости, к которой добавлены. Эти вещества обычно дифильные по своей природе, т.е. их молекулы состоят из двух частей: гидрофильной и гидрофобной. например, стеарат натрия:  Гидрофобная часть – углеводородный радикал – содержит неполярные или малополярные связи С–С; С–Н. Гидрофильная часть – карбоксильная группа – содержит сильно электроотрицательные атомы О, которые поляризуют связь.
Гидрофобная часть – углеводородный радикал – содержит неполярные или малополярные связи С–С; С–Н. Гидрофильная часть – карбоксильная группа – содержит сильно электроотрицательные атомы О, которые поляризуют связь.
ПАВ – это обычно вещества органические, хотя обратное утверждение неверно. Не все органические вещества являются ПАВ.
ПИАВ – поверхностно-инактивные вещества. Увеличивают σ той жидкости, к которой добавлены. Обычно это вещества неорганические: минеральные кислоты, щелочи, соли.
 – это неорганические соли – ПИАВ.
– это неорганические соли – ПИАВ.
Среди приведенных веществ к ПАВ относится только стеарат натрия (Na-мыло)  .
.
Правильный ответ 3.
4.  – неорганические соли, увеличивают поверхностное натяжение мочи, по своей поверхностной активности относятся к ПИАВ. соли желчных кислот – ПАВ, органические дифильные вещества. Правильный ответ 1.
– неорганические соли, увеличивают поверхностное натяжение мочи, по своей поверхностной активности относятся к ПИАВ. соли желчных кислот – ПАВ, органические дифильные вещества. Правильный ответ 1.
5. Правильный ответ: добавка ПИАВ увеличивает поверхностное натяжение воды. Следовательно, 
Правильный ответ 3
6. Правильный ответ: поверхностное натяжение σ – это избыточная поверхностная энергия единицы площади поверхности. Ключевое слово – энергия. Правильный ответ 1.
7. При увеличении длины углеводородного радикала увеличивается гидрофобная часть молекулы, поверхностное натяжение снижается, а поверхностная активность вещества увеличивается в 3-3,5 раза. Правильный ответ 1.
8. Правило Дюкло-Траубе характеризует адсорбцию ПАВ.
Рис. 1 содержит изотерму σ и ПАВ  и ПИАВ (NaCl). Рис. 2 показывает изменение поверхностного натяжения веществ, не относящихся к одному гомологическому ряду. Рис. 3 – изотермы поверхностного натяжения расположены неправильно: чем длиннее углеводородный радикал, тем ниже и круче идет изотерма. Только рис. 4 соответствует правилу Дюкло-Траубе: вещества относятся к одному гомологическому ряду, и графики располагаются в нужном порядке.
и ПИАВ (NaCl). Рис. 2 показывает изменение поверхностного натяжения веществ, не относящихся к одному гомологическому ряду. Рис. 3 – изотермы поверхностного натяжения расположены неправильно: чем длиннее углеводородный радикал, тем ниже и круче идет изотерма. Только рис. 4 соответствует правилу Дюкло-Траубе: вещества относятся к одному гомологическому ряду, и графики располагаются в нужном порядке.
Правильный ответ 4.
 1.
1.  1. 2.
1. 2.

 3. 4.
3. 4.
9. Величина адсорбции на поверхности жидкой фазы рассчитывается по уравнению Гиббса:  , где
, где  - поверхностная активность. Правильный ответ 3.
- поверхностная активность. Правильный ответ 3.
10. Проанализируем знак адсорбции ПАВ по изотерме поверхностного натяжения.
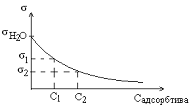 Выберем две концентрации
Выберем две концентрации  и
и  так, чтобы
так, чтобы  . Т.к. с увеличением концентрации ПАВ σ уменьшается, то
. Т.к. с увеличением концентрации ПАВ σ уменьшается, то  . Определим знак поверхностной активности:
. Определим знак поверхностной активности:
 , значит Г – адсорбция, найденная по уравнению Гиббса
, значит Г – адсорбция, найденная по уравнению Гиббса  будет положительная Г > 0. Следовательно, величина адсорбции принимает только положительные значения. Это возможно на рис. 1 и 2, но рис. 2 не отражает, что при образовании мономолекулярного слоя наблюдается насыщение – предельная адсорбция, как на рис. 1, когда предельному насыщению соответствует прямая часть графика, параллельная оси Х.
будет положительная Г > 0. Следовательно, величина адсорбции принимает только положительные значения. Это возможно на рис. 1 и 2, но рис. 2 не отражает, что при образовании мономолекулярного слоя наблюдается насыщение – предельная адсорбция, как на рис. 1, когда предельному насыщению соответствует прямая часть графика, параллельная оси Х.






