1. Фактор эквивалентности  - это величина, показывающая какая доля реальной частицы вещества, соответствует одному иону водорода в кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции. Во всех кислотно-основных реакциях одному иону водорода соответствует один ОН-, входящий в состав однокислотного основания КОН. Фактор эквивалентности КОН равен 1.
- это величина, показывающая какая доля реальной частицы вещества, соответствует одному иону водорода в кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции. Во всех кислотно-основных реакциях одному иону водорода соответствует один ОН-, входящий в состав однокислотного основания КОН. Фактор эквивалентности КОН равен 1.
Правильный ответ 3.
2. Во всех кислотно-основных реакциях одной молекуле НСl соответствует один ион водорода. Фактор эквивалентности НСl равен 1. Правильный ответ 1.
3. Первые две реакции относятся к кислотно-основным реакциям ионного обмена, в которых фактор эквивалентности НNO3 всегда равен 1, т.к. одной молекуле кислоты соответствует один ион водорода. Третья и четвертая реакция относятся к ОВР. В этом случае фактор эквивалентности  – это величина, показывающая какая доля реальной частицы вещества, соответствует одному электрону в окислительно-восстановительной реакции. Рассчитаем изменение степени окисления атома азота в азотной кислоте. В реакции 3: N+5 + 1e → N+4. Фактор эквивалентности азотной кислоты равен 1. В реакции 4: N+5 + 4e → N+1. Фактор эквивалентности азотной кислоты равен 1/4.
– это величина, показывающая какая доля реальной частицы вещества, соответствует одному электрону в окислительно-восстановительной реакции. Рассчитаем изменение степени окисления атома азота в азотной кислоте. В реакции 3: N+5 + 1e → N+4. Фактор эквивалентности азотной кислоты равен 1. В реакции 4: N+5 + 4e → N+1. Фактор эквивалентности азотной кислоты равен 1/4.
Правильный ответ 4.
4. Все приведенные реакции относятся к кислотно-основным реакциям ионного обмена. Фактор эквивалентности  – это величина, показывающая, какая доля реальной частицы вещества соответствует одному иону водорода в кислотно-основной реакции. В реакциях первой: Н3РО4+ 3NaОН→Na3РО4 + 3Н2О, и третьей Н3РО4 + 3NH3→ (NH4)3PО4
– это величина, показывающая, какая доля реальной частицы вещества соответствует одному иону водорода в кислотно-основной реакции. В реакциях первой: Н3РО4+ 3NaОН→Na3РО4 + 3Н2О, и третьей Н3РО4 + 3NH3→ (NH4)3PО4  , т.к. одной молекуле кислоты в данной кислотно-основной реакции соответствует 3 иона водорода. В четвертой реакции: Н3РО4 + NaОН → NaН2РО4 + Н2О
, т.к. одной молекуле кислоты в данной кислотно-основной реакции соответствует 3 иона водорода. В четвертой реакции: Н3РО4 + NaОН → NaН2РО4 + Н2О  , т.к. одной молекуле кислоты в данной кислотно-основной реакции соответствует 1 ион водорода. И только во второй реакции Н3РО4 + 2NH3 → (NH4)2HPО4 фактор эквивалентности
, т.к. одной молекуле кислоты в данной кислотно-основной реакции соответствует 1 ион водорода. И только во второй реакции Н3РО4 + 2NH3 → (NH4)2HPО4 фактор эквивалентности  , т.к. одной молекуле кислоты в данной кислотно-основной реакции соответствует 2 иона водорода.
, т.к. одной молекуле кислоты в данной кислотно-основной реакции соответствует 2 иона водорода.
Правильный ответ 2.
5.Молярная масса эквивалента кислоты рассчитывается как молярная масса кислоты, деленная на число атомов водорода в молекуле кислоты, способных замещаться на металл с образованием соли.

Рассчитаем молярные массы эквивалента каждой кислоты:




Наибольшее значение молярной массы эквивалента получилось для НNО3. Правильный ответ 4.
6. Молярная масса эквивалента оксида рассчитывается как молярная масса оксида, деленная на число атомов кислорода, умноженное на 2 (валентность атома кислорода)
Мэоксида= Моксида/ число атомов «О» * 2
Рассчитаем молярные массы эквивалента каждого оксида
1.Мэ CuO = 79,5/1*2= 39,75 г/моль экв
2.Мэ Al2O3= 102/3*2=17 г/моль экв
3.Мэ со= 28/1*2= 14 г/моль экв
4.МэР2О5= 142/5*2=14,2 г/моль экв
Наибольшее значение молярной массы эквивалента получилось для CuO.
Правильный ответ 1.
7. Правильный ответ 2.
8. Молярная концентрация совпадает с молярной концентрацией эквивалента в том случае, если фактор эквивалентности вещества равен 1. Это возможно только для гидроксида натрия.
Правильный ответ 1.
9. Дано:  10 % = 0,1, mр-ра = 2г. Найти: mр.в.-?
10 % = 0,1, mр-ра = 2г. Найти: mр.в.-?
Запишем формулу для массовой доли растворенного вещества
 ,
,
выразим  .
.
Правильный ответ 1.
10. Дано: Vр-ра = 100мл = 0,1л; mглюкозы. = 18 г. Найти: С-?
Запишем формулу для молярной концентрации и подставим значения (объем раствора берется в литрах)
 ;
; 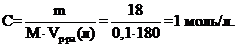
Правильный ответ 2.
11. Дано: VHCl = 20 мл = 0,02 л; VКОН = 8 мл; ТКОН = 0,035 г/мл. Найти: СэHCl-?
1) запишем уравнение реакции: HCl + КОН → КCl + Н2О
2) закон эквивалентов в общем виде:νэHCl= νэKOH
3) выразим число моль эквивалентов соляной кислоты по формуле (2), т.к. надо найти молярную концентрацию эквивалента Сэ:
νэHCl= СэHCl .VHCl(л)
Выразим число моль эквивалентов гидроксида калия по формуле (3), т.к. дан титр раствора щелочи Т: 
4) составим выражение состояния эквивалентности при взаимодействии растворов соляной кислоты и гидроксида калия:

5) выразим неизвестную величину СэHCl:

МэКОН = 56/1 = 56 г/моль экв. Правильный ответ 3.
12. Дано:  = 65 мл; VNaОН = 16,25мл; CэNaОН = 0,1моль экв/л. Найти:
= 65 мл; VNaОН = 16,25мл; CэNaОН = 0,1моль экв/л. Найти: 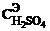 -?
-?
1) запишем уравнение реакции: H2SO4 + 2NaОН → Na2SO4 + 2Н2О
 2) запишем закон эквивалентов в общем виде:
2) запишем закон эквивалентов в общем виде:
3) выразим число моль эквивалентов серной кислоты по формуле (2), т.к. надо найти молярную концентрацию эквивалента Сэ: 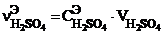 . Выразим число моль эквивалентов гидроксида натрия также по формуле (2), т.к. дана молярная концентрация эквивалента раствора щелочи Сэ:
. Выразим число моль эквивалентов гидроксида натрия также по формуле (2), т.к. дана молярная концентрация эквивалента раствора щелочи Сэ:
ν эNaОН = СэNaОН.VNaОН
4) Составим выражение состояния эквивалентности при взаимодействии растворов серной кислоты и гидроксида натрия:
 СэNaОН.·VNaОН
СэNaОН.·VNaОН
5) выразим неизвестную величину 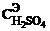 :
:

Правильный ответ 1.
13. Дано:  = 5 мл; VNaОН = 4,78 мл = 0,00478; CэNaОН = 0,1012 моль экв/л. Найти:
= 5 мл; VNaОН = 4,78 мл = 0,00478; CэNaОН = 0,1012 моль экв/л. Найти:  -?
-?
1) запишем уравнение реакции: H2SO4 + 2NaОН → Na2SO4 + 2Н2О
2) запишем закон эквивалентов в общем виде: 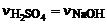
3) выразим число моль эквивалентов серной кислоты по формуле (3), т.к. надо найти титр раствора серной кислоты Т:
|

выразим число моль эквивалентов гидроксида натрия по формуле (2), т.к. дана молярная концентрация эквивалента раствора щелочи Сэ:
ν эNaОН = СэNaОН.·VNaОН
4) составим выражение состояния эквивалентности при взаимодействии растворов серной кислоты и гидроксида натрия
 =. СэNaОН·.VNaОН (л)
=. СэNaОН·.VNaОН (л)
5) выразим неизвестную величину  :
:


 = 98/2 = 49 г/моль экв.
= 98/2 = 49 г/моль экв.
Правильный ответ 3.
14. Дано: mКCl = 7,45г;  = 0,3 моль экв/л.
= 0,3 моль экв/л.
Найти:  -?
-?
1) запишем уравнение реакции: AgNO3 + КCl → AgCl + KNO3
2) запишем закон эквивалентов в общем виде: 
3) выразим число моль эквивалентов нитрата серебра по формуле (2), т.к. дана молярная концентрация эквивалента
Сэ:  .
.
 Выразим число моль эквивалентов хлорида калия по формуле (1),
Выразим число моль эквивалентов хлорида калия по формуле (1),
т.к. дана масса:
4) составим выражение состояния эквивалентности при взаимодействии растворов нитрата серебра и хлорида калия:

5) выразим неизвестную величину  :
:

МэKC l = 74,5/1·1 = 74,5 г/моль экв.
Правильный ответ 3.
15.Дано: ω (Н2SО4конц) = 36,8%, ρ(Н2SО4конц) = 1,25г/мл
Сэ(Н2SО4разб) = 0,1 моль экв/л, V(Н2SО4разб) = 100мл = 0,1 л
Найти: V(Н2SО4конц)-?
Обозначим индексами «к» и «р» величины для концентрированного и разбавленного растворов, соответственно.
Масса вещества в концентрированном растворе:

Масса вещества в разбавленном растворе:
mp = CЭ р·Vp(л)·Мэ (Н2SО4). Т.к. раствор приготовлен путем разбавления массы веществ в концентрированном и разбавленном растворе равны

Отсюда:  =
= 
Правильный ответ 2 ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ II. ТЕРМОДИНАМИКА
1.Процесс, протекающий при постоянной температуре, называется изотермическим, при постоянном давлении – изобарным, при постоянном объеме – изохорным.
Правильный ответ: 1г; 2в;3б.
2. Изолированными называют такие системы, которые не обмениваются массой и энергией с окружающей средой. Открытыми называются системы, которые обмениваются массой и энергией с внешней средой. К закрытым относятся системы, обменивающиеся с окружающей средой лишь энергией, но не веществом.
Правильный ответ:1в;2а;3б.
3. Возможны два различных способа передачи энергии от системы к внешним телам. Это работа и теплота. Для описания состояния термодинамических систем используютсятермодинамические параметры и функции состояния. Термодинамические параметры – это те свойства системы, которые можно измерить на практике. Для описания простых систем обычно используются давление (Р), объем (V), концентрация (С) и температура (Т). Функции состояния - это величины не зависящие от пути процесса и определяемые только начальным и конечным состоянием системы. К ним относятся внутренняя энергия ∆U, энтальпия ∆Н, энтропия S, энергия Гиббса или изобарно-изотермический потенциал ∆G.
Правильный ответ 2.
4. Правильный ответ 1.
5. Гомогенные – это такие системы, внутри которых свойства меняются непрерывно при переходе от одного места к другому, другими словами, свойства которых одинаковы в любой точке. Это физически однородные системы, имеющие одинаковые физические свойства в любых произвольно выбранных частях, равных по объему. Например, смеси различных газов и растворы как жидкие, так и твердые.
Гетерогенными называются системы, которые состоят из нескольких физически однородных или гомогенных частей, отделенных поверхностью раздела, при переходе через которую скачком изменяются какие-либо свойства. Другими словами, которые имеют границу раздела фаз.
Термодинамическая система – это тело или группа тел, мысленно или физически выделяемая из окружающей среды.
Правильный ответ: 1в;2а;3б.
6. Реакция экзотермическая - тепло выделяется в окружающую среду (Q > 0, ΔН < 0). Реакция эндотермическая – тепло поглощается из окружающей среды (Q < 0,ΔН > 0).
Правильный ответ 4.
7. Уравнения реакций, в которых указаны тепловые эффекты (Q), называются термохимическими. Уравнения реакций, в которых указано изменение энтальпии (ΔН), называются термодинамическими. Правильный ответ 2.
8. Полная формулировка первого закона термодинамики – закона сохранения энергии: тепло, подводимое к системе, расходуется на увеличение внутренней энергии и на совершение работы против внешних сил. Правильный ответ 2.
9.Физический смысл первого закона термодинамики. Первый закон термодинамики дает нам один из критериев самопроизвольности: самопроизвольному протеканию реакции способствует уменьшение энергии. Если реакция экзотермическая, то говорят, что энтальпийный фактор способствует протеканию прямой реакции (ΔН < 0). Если реакция эндотермическая, то говорят, что энтальпийный фактор вызывает обратную реакцию (ΔН > 0). Правильный ответ 2.
10.∆H = ∆U + p∆V или Qp = ΔH - это математическое выражение первого закона термодинамики в изобарном процессе. Правильный ответ 3.
11.QV = ΔU –это математическое выражение первого закона термодинамики в изохорном процессе. Правильный ответ 4.
12. В системе цилиндр с поршнем,заполненный идеальным газом, энтальпия равна сумме внутренней энергии и потенциальной энергии поднятого поршня, т.е. общей энергии расширенной системы (физический смысл энтальпии.
Внутренняя энергия состоит из энергии разных видов движения и взаимодействия входящих в систему частиц: энергия поступательного и вращательного движений молекул и колебательного движения атомов, энергия молекулярного взаимодействия, внутриатомная энергия заполненных электронных уровней, внутриядерная энергия и др.(физический смысл внутренней энергии).
Для описания степени беспорядка используется особая термодинамическая функция, называемая энтропией и обозначаемая S («эс») (физический смысл энтропии - мера беспорядка).
G – функция состояния, определяемая равенством ΔG = ΔH - T ΔS, называется изобарно-изотермическим потенциалом (т.к. Т и Р являются постоянными) или свободной энергией при постоянном давлении. Физический смысл энергии Гиббса – это функция состояния, отражающая влияние двух тенденций: энергетической (энтальпийный фактор) и статистической (энтропийный фактор).
Правильный ответ 3:1в;2в;3г;4а.
13. Величина ΔНоf 298- стандартная энтальпия образования используется во 2-м следствии из закона Гесса, математическое выражение которого ΔНор-и = Σνi ΔНоf 298 прод. - Σνi ΔНоf 298 исх.в-в
Правильный ответ 2.
14. Величина ΔНосгор- стандартная энтальпия сгорания используется в 3-м следствии из закона Гесса, математическое выражение которого ΔНор-и = Σνi ΔНосгор. исх. в-в - Σνi ΔНосгор. прод.
Правильный ответ 3.
15. ΔНоf 298 – стандартная энтальпия образования – это энтальпия образования 1 моля данного соединения из простых веществ, отвечающих наиболее устойчивому состоянию элементов при стандартных условиях.
ΔНосгор. 298 – стандартная энтальпия сгорания – это энтальпия окисления 1 моля данного вещества кислородом с образованием высших оксидов соответствующих элементов при стандартных условиях. Правильный ответ 2.
16. Важнейшим постулатом термохимии является закон Гесса, формулировка которого:
Нореакции или тепловой эффект химических реакций, протекающих при постоянном объеме или давлении, не зависит от числа промежуточных стадий, а определяется лишь начальным и конечным состоянием системы.
Правильный ответ 3.
17. ΔНоf 298 – стандартная энтальпия образования – это энтальпия образования 1 моля данного соединения из простых веществ, отвечающих наиболее устойчивому состоянию элементов при стандартных условиях.
Необходимо выбрать уравнение, где данное вещество, т.е. Al2О3, образуется из простых веществ и при этом должен образоваться 1 моль данного вещества. Это возможно только в 1-м уравнении: 2Al + 3/2О2 = Al2О3. Правильный ответ 1.
18. ΔНосгор. 298 – стандартная энтальпия сгорания – это энтальпия окисления 1 моля данного вещества кислородом с образованием высших оксидов соответствующих элементов при стандартных условиях. Высшие оксиды – это оксиды, вкоторых элемент проявляет максимальную степень окисления, равную номеру группы, в которой находится элемент.
Необходимо найти уравнение, где данное вещество, т.е. НСНО, сгорает (окисляется кислородом) с образованием высших оксидов и при этом сгорает 1 моль данного вещества. Это возможно в 3-ей реакции: НСНО + О2 = СО2 + Н2О. Правильный ответ 3.
19. В задаче дана ΔНоf 298- стандартная энтальпия образования аммиака. Стандартная энтальпия простых веществ – водорода и азота равна нулю. Решаем задачу по второму следствию из закона Гесса: (исходные в-ва)3Н2 + N2 =2NН3(продукты реакции)
ΔНор-и = Σνi ΔНоf 298 прод. - Σνi ΔНоf 298 исх.в-в= ΔНор-и = 2.ΔНоf 298 NН3 – (3.ΔНоf Н2+ ΔНоf N2)=
=2. (-46,2) + (3*0+0)=-92,4 кДж/моль. Правильный ответ 3.
20.Физический смысл второго закона термодинамики: самопроизвольно система стремится к увеличению беспорядка.
ΔS > 0 – реакция протекает самопроизвольно; энтропийный фактор вызывает прямую реакцию.
ΔS < 0 – реакция самопроизвольно не протекает; энтропийный фактор вызывает обратную реакцию. Правильный ответ 1.
21.Формулировка второго закона термодинамики: энтропия изолированной системы в самопроизвольном процессе возрастает, т.е. изменение ΔS больше нуля (ΔS > 0 - математическое выражение второго начала термодинамики для изолированной системы).
Правильный ответ 3.
22. В химических реакциях об изменении энтропии можно качественно судить по изменению числа моль газов. Посчитаем изменение числа моль газов в реакции
(исходные в-ва) 4NH3(г) + 5О2(г) = 4NO(г) + 6Н2О(ж) (продукты реакции)
Δνгазов= νгазообр.прод - νгазообр.исх.в-в.= 4- (4+5)=-5<0
Δνгазов < 0 ==> ΔS < 0.
Реакция протекает с уменьшением числа моль газов, следовательно, с уменьшением энтропии.
Правильный ответ 2.
23. В химических реакциях об изменении энтропии можно качественно судить по изменению числа моль газов. Посчитаем изменение числа моль газов в реакции
(исходные в-ва) 2Н2О2(ж) = 2H2O(ж) + О2(г) (продукты реакции)
Δνгазов= νгазообр.прод - νгазообр.исх.в-в.=1-0 = 1 > 0
Δνгазов > 0 ==> ΔS > 0
Реакция протекает с увеличением числа моль газов, следовательно, с увеличением энтропии.
Правильный ответ 1.
24. Критерий самопроизвольности реакции выражают через изменение энергии Гиббса системы:
Δ G < 0 – самопроизвольная реакция;
Δ G = 0 – реакция находится в состоянии равновесия;
Δ G > 0 – в данных условиях реакция невозможна (самопроизвольна обратная реакция). Правильный ответ 2.
25. Реакция будет возможна при любой температуре, если оба фактора и энтальпийный и энтропийный вызывают прямую реакцию.
ΔS > 0, следовательно, энтропийный фактор способствует протеканию прямой реакции.
ΔН < 0 – реакция экзотермическая, энтальпийный фактор способствует протеканию прямой реакции. Правильный ответ 1.
26. Реакция будет возможна при низкой температуре, если энтальпийный фактор вызывает прямую реакцию, а энтропийный фактор вызывают обратную реакцию. В этом случае в уравнении ΔG = ΔН – ТΔS энтальпийный фактор ΔН, имеющий отрицательное значение перевешивает при низких температурах энтропийный фактор ΔS < 0 ==> -ТΔS > 0. Поэтому при низких температурах значение энергии Гиббса будет меньше нуля
∆G < 0 и будет протекать прямая реакция.
ΔS < 0, следовательно, энтропийный фактор способствует протеканию обратной реакции.
ΔН < 0 – реакция экзотермическая, энтальпийный фактор способствует протеканию прямой реакции. Правильный ответ 3.
27. Реакция будет возможна при высокой температуре, если энтропийный фактор вызывает прямую реакцию, а энтальпийный фактор вызывают обратную реакцию. В этом случае в уравнении ΔG = ΔН – ТΔS энтропийный фактор ΔS > 0 → -ТΔS < 0, имеющий отрицательное значение перевешивает при высоких температурах энтальпийный фактор, имеющий положительное значение. Поэтому при высоких температурах значение энергии Гиббса будет меньше нуля ∆G < 0, и будет протекать прямая реакция.
ΔS > 0, следовательно, энтропийный фактор способствует протеканию прямой реакции.
ΔН > 0 – реакция экзотермическая, энтальпийный фактор способствует протеканию обратной реакции. Правильный ответ 2
28. а) В задании известен знак энтальпийного фактора:
∆Нор-и > 0, следовательно, энтальпийный фактор вызывает обратную реакцию.
Качественно оценим изменение энтропии по изменению числа моль газообразных веществ
в реакции N2O4(г) ↔ 2NO2(г),
Δνгазов= νгазообр.прод - νгазообр.исх.в-в.= 2-1 = 1> 0
Δνгазов > 0 → ΔS > 0, следовательно, энтропийный фактор вызывает прямую реакцию. Энтальпийный и энтропийный фактор действуют в разных направлениях, значит в системе возможно равновесие.
б) В задании известен знак энтальпийного фактора:
∆Нор-и< 0, следовательно, энтальпийный фактор вызывает прямую реакцию.
Качественно оценим изменение энтропии по изменению числа моль газообразных веществ
в реакции 2О3(г) → 3О2(г),
Δνгазов= νгазообр.прод - νгазообр.исх.в-в.= 3-2 = 1 > 0
Δνгазов > 0 → ΔS > 0, следовательно, энтропийный фактор вызывает прямую реакцию. Энтальпийный и энтропийный фактор действуют в одном направлениях и вызывают прямую реакцию, значит в системе не возможно равновесие.
в) В задании известен знак энтальпийного фактора:
∆Нор-и > 0, следовательно, энтальпийный фактор вызывает обратную реакцию.
Качественно оценим изменение энтропии по изменению числа моль газообразных веществ
в реакции N2 + 2O2 = 2NO2
Δνгазов= νгазообр.прод - νгазообр.исх.в-в.= 2-3 = -1 < 0
Δνгазов < 0 → ΔS < 0, следовательно, энтропийный фактор вызывает обратнуюреакцию. Энтальпийный и энтропийный фактор действуют в одном направлениях и вызывают обратную реакцию, значит в системе не возможно равновесие. Правиль-
ный ответ 1а; 2б;3в
ОТВЕТЫ К ТЕСТОВЫМ ЗАДАНИЯМ ПО ТЕМЕ III. ХИМИЧЕСКАЯ КИНЕТИКА. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
1. Закон действующих масс в общем виде: для реакции
аА + вВ → С 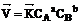 ,
,
Перепишем для данной реакции. В математическое выражение закона действующих масс входят концентрации газов или жидкостей. Т.к. реакция 2NО г + О2 г = 2NО2 г протекает в газовой фазе, то вещество А - это NО, а В – это О2, a и b- коэффициенты в уравнении реакции перед соответствующими веществами a=2 b=1. Закон действующих масс применительно к данной реакции запишется как  . Правильный ответ 3.
. Правильный ответ 3.
2. Запишем закон действующих масс для данной реакции А г + 2В г → АВ2 г:
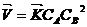 , подставим численные значения константы скорости реакции к = 4 л2/моль2, концентрации веществ СА= 0,05 моль/л,
, подставим численные значения константы скорости реакции к = 4 л2/моль2, концентрации веществ СА= 0,05 моль/л,
СВ = 0,2 моль/л. Возведем в квадрат СВ:
V = 4∙0,05∙(0,2)2 = 0,008. Правильный ответ 2.
3. Запишем закон действующих масс для данной реакции 2SO2г + О2г = 2SO3ж до изменения давления  .
.
При увеличении давления в 2 раза давление каждого газа увеличится в 2 раза


Скорость реакции увеличится в 8 раз. Правильный ответ 1.
4. Запишем выражение закона действующих масс для реакции3Н2 г + N2 г = 2NH3 г до изменения концентрации водорода:
 .
.
При увеличении концентрации водорода скорость реакции возрастет в 33 раз:

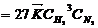
Скорость реакции увеличилась в 27 раз. Правильный ответ 4.






