На основании теоретических исследований показана возможность регенерации и утилизации растворов концентрированной азотной кислоты и оксидов азота, содержащих ингибиторы коррозии. Рассчитаны термодинамические константы и концентрации компонентов в условиях химического равновесия возможных реакций, протекающих при взаимодействии азотнокислых солей алюминия и кальция в системе НNO3-N2O4-H2O-HF-H3PO4. Определены условия практически полного извлечения фтористого водорода из растворов.
Фторид водорода обладает специфической особенностью к комплексообразованию. Он энергично взаимодействует не только с основными, но и со многими кислотными оксидами, кислородными кислотами и их солями, образуя комплексные соединения. Диссоциация чистого HF незначительна, а при наличии воды она резко усиливается вследствие образования иона гидроксония. Аналогичную роль играет азотная кислота. В этом случае диссоциация HF усиливается за счет сольватации иона водорода молекулами HNO3. В системе HNO3–N2O4–H2O–HF–H3PO4 устанавливаются равновесия по схеме:
2HF+H2O ↔ H3O++HF2-, (1)
2HF+HNO3 ↔ H2NO3++HF2-, (2)
2HF+H2NO3+ ↔ NO2++H3O++HF2-. (3)
При взаимодействии с ортофосфорной кислотой фторид водорода образует монофторофосфорную кислоту по уравнению:
HF+H3PO4=H3PO3F+H2O. (4)
Кроме того, известно [1, 2], что фторид водорода и ортофосфорная кислота образуют комплексные соединения типа MeFn(H2O)n, где лигандами являются группы (FnOH2)n. В таких ацидокомплексах существует электростатическое взаимодействие положительно заряженного центрального атома с отрицательно заряженными гидроксоионами.
Следует также отметить, что HF, HNO3 и H3PO4 образуют прочные гидраты, а оксиды азота и азотная кислота - соединения типа сольватов.
Таким образом, вследствие многообразия протекающих процессов в водных растворах азотной кислоты и оксидов азота, содержащих HF и H3PO4, система является многокомпонентной, и извлечение фтористого водорода является непростой задачей, для решения которой необходимо проведение теоретических, физико-химических и технологических исследований.
Фтористый водород имеет самую низкую температуру кипения по сравнению с другими компонентами, входящими в систему HNO3–N2O4–H2O–HF–H3PO4. При атмосферном давлении температура кипения HF составляет 19,54 оС и, следовательно, его извлечение возможно путем испарения при определенных условиях, способствующих разрушению комплексов и гидратов. Однако, вследствие достаточно близкой температуры кипения оксида азота (IV), равной 21,5 оС, паровая фаза будет насыщена HF и N2O4, разделение которых весьма затруднительно, и создание процесса выделения HF на основе испарения, ректификации и конденсации целесообразно с точки зрения регенерации некондиционных растворов.
Полная утилизация растворов HNO3–N2O4–H2O–HF–H3PO4 может быть достигнута после предварительного извлечении фтористого водорода путем связывания его в нерастворимые соли, которые с помощью различных технологических приемов (центрифугирование, фильтрация, отстаивание) выделяют из системы. Исходя из физико-химических свойств соединений фтора, дешевизны и доступности реагентов, способных связать HF, были проведены теоретические исследования [3].
Склонность фторидов к образованию гидратносольватных соединений, которые медленно растворяются, свидетельствует о том, что характер связей в них является ковалентным и нет непосредственной зависимости между полярностью связи и степенью электролитической диссоциации. Ион фтора очень сильно электростатически взаимодействует с другими ионами, так как его радиус равен 0,133 нм, что значительно меньше по сравнению с другими ионами галогенидов. Комплексы с ионами фтора в качестве центрального атома встречаются редко и обладают малой устойчивостью, а содержащие фтор в качестве адденда комплексы распространены более широко. На термодинамическую устойчивость комплексных ионов сильное влияние оказывает гидратация. Вследствие малого радиуса иона фтора, энергия его гидратации значительно выше, чем других однозарядных анионов. Фтор является универсальным аддендом. Он образует фторокомплексы почти со всеми элементами периодической системы Д.И. Менделеева. [4]
Алюминий образует устойчивые в водных растворах комплексы, в которых преобладает электростатический характер связи. Моно- и дифторофосфорные кислоты и их соли являются также устойчивыми комплексами, но связи ковалентны. Многие металлы малорастворимые и слабодиссоциированные фториды или аквафторокомплексы. Наименьшей растворимостью обладают фториды висмута, лантана, тория и щелочноземельных металлов [5, 6]. Образование аквафторокомплексов присуще для ионов бериллия, алюминия, трехвалентного железа и других трех- и четырехвалентных элементов. Устойчивость смесей с общим анионом определяется зарядом и радиусом катиона.
На основании вышеизложенного можно отметить, что наиболее эффективными и доступными химическими соединениями для полного извлечения фторида водорода из водных растворов азотной кислоты и оксидов азота, содержащих ортофосфорную кислоту, являются нитраты алюминия и кальция.
Взаимодействие азотнокислого алюминия с фтористым водородом протекает по уравнению:
Al(NO3)3 + 3HF → AlF3 + 3НNO3. (5)
Для безводного Al(NO3)3 отсутствуют стандартные значения изменения теплоты образования, свободной энергии и энтропии, что не дает возможности определить тепловой эффект реакции (5) и ее константу равновесия. Нитрат алюминия существует в виде девятиводного кристаллогидрата (Al(NO3)3·9H2O), теплота образования которого составляет 3769 кДж/моль. Реакция:
Al(NO3)3×9Н2О + 3HF = AlF3 + 3НNO3 + 9Н2О + 26 кДж (6)
протекает с выделением тепла (Q = +26 кДж/моль). В водных средах при невысоких концентрациях фтористого водорода образуются комплексы фторалюминатов [7, 8]. В работе [9] показано, что при 15 оС равновесие реакции (5) устанавливается в течение суток. Прочные фторалюминаты образуются при мольном соотношении реагентов больше 2 [10]. Подтверждением образования фторалюминатов служит повышение растворимости фторидов в солях алюминия.
При введении в систему HNO3–N2O4–H2O–HF–H3PO4 кристаллогидратного азотнокислого алюминия, часть высвободившейся воды будет связываться в гидраты азотной и ортофосфорной кислот с выделением тепла и, следовательно, понижение температуры будет смещать равновесие реакции (6) вправо.
Наряду с реакцией (6) будет происходить взаимодействие азотнокислого алюминия с присутствующей в системе H3PO4 по уравнению:
Al(NO3)3×9Н2О + H3PO4 = AlPO4 + 3НNO3 + 9Н2О – 178 кДж. (7)
Равновесие эндотермической реакции (7) с понижением температуры будет смещаться влево, что является благоприятным фактором с точки зрения уменьшения соотношения вводимой соли к фтористому водороду.
Взаимодействие нитрата кальция с фторидом водорода происходит по уравнению (в скобках указано значение изменения свободной энергии Гиббса):
Ca(NO3)2 + 2HF = CaF2 + 2НNO3 - 390 кДж/моль (–38 кДж/моль·К) (8)
Эндотермическая реакция (8) имеет отрицательное значение изменения стандартной свободной энергии, равное –38 кДж/моль·К, что свидетельствует о смещении равновесия вправо. Повышение температуры будет приводить к смещению равновесия вправо. Константы равновесия при 25, 30 и 40 оС соответственно равны 3,58×106, 4,72×107 и 6,45×109, а степень образования CaF2 при достижении равновесия составляет 99,35, 99,72 и 99,95 %. Фторид кальция является мелкодисперсным веществом, которое плохо отстаивается. Для полного извлечения фтористого водорода необходимо, прежде всего, не только повышение температуры процесса, но и проведение его при определенном избытке исходной соли. Кроме того, образующуюся суспензию следует фильтровать на элементах с малым диаметром пор.
Так как Ca(NO3)2 производится в виде четырехводного кристаллогидрата, то при введении соли в раствор HNO3–N2O4–H2O–HF–H3PO4 не исключено протекание реакции по уравнению:
Ca(NO3)2×4Н2О + 2HF = CaF2 + 2НNO3 + 4Н2О – 445 кДж/моль (–26 кДж/моль·К) (9)
Реакция (9) протекает с поглощением тепла и ее равновесие смещено в право, так как изменение свободной энергии, равное –26 кДж/моль·К, имеет отрицательное значение. Константы равновесия при 25, 30 и 40 оС соответственно равны 3,04×104, 5,82×105 и 1,61×108, то есть с ростом температуры равновесие смещается вправо.
Присутствующая в системе H3PO4 будет также реагировать с нитратом кальция по уравнениям:
Ca(NO3)2 + 2 H3PO4 = Ca(H2PO4)2 + 2 НNO3 + 32 кДж/моль (–18 кДж/моль·К), (10)
Ca(NO3)2 + H3PO4 = CaHPO4 + 2 НNO3 – 186 кДж/моль (+10 кДж/моль·К), (11)
3Ca(NO3)2 + 2H3PO4 = Ca3(PO4)2 + 6 НNO3 – 149 кДж/моль (+103 кДж/моль·К) (12)
Реакция (10) является экзотермической и ее равновесие смещено вправо, а реакции (11) и (12) протекают с поглощением тепла и их равновесия смещены в левую сторону. При температурах 25, 30 и 40 оС константы равновесия реакции (10) соответственно составляют 1,40×103, 1,13×103 и 7,52×102. Константы равновесия реакции (11) при этих же условиях равны 1,86×10-2, 6,42×10-2 и 6,75×10-1, а реакции (12) – 1,01×10-18, 2,7×10-18 и 1,77×10-17. Из значений констант равновесия видно, что преимущественно будет образовываться однозамещенный фосфат кальция, в меньшей степени – двухзамещенный и практически исключено образование Ca3(РO4)2. Степень образования Ca(H2PO4)2 при температурах 25, 30 и 40 оС равна 91,79, 91,24 и 90,09 %, а CaHPO4 – 2,47, 3,50 и 7,85 %.
Применение четырехводного нитрата кальция приведет к выделению воды по реакциям, протекающим по уравнениям:
Ca(NO3)2×4Н2О+2H3PO4=
=Ca(H2PO4)2+2НNO3+4Н2О –22кДж/моль (+4,5кДж/моль·К) (13)
Ca(NO3)2×4Н2О+H3PO4=CaHPO4+2НNO3+4Н2О –240 кДж/моль (+23 кДж/моль·К) (14)
Эндотермическая реакция (13) смещена вправо, а реакция (14), которая также эндотермическая – влево. Константы равновесия реакции (13) при 25, 30 и 40 оС, соответственно, равны 5,99, 6,91 и 9,06, а реакции (14) – 7,98×10-5, 3,98×10-4 и 8,05×10-3. Сопоставляя константы равновесия реакций образования фосфатов из безводного и четырехводного нитрата кальция, видно, что во втором случае они на 2÷3 порядка меньше. Это говорит о том, что степень образования Ca(H2PO4)2 и CaHPO4 должна заметно снижаться с понижением избытка исходной соли. Однако, это не означает, что избыток исходной соли может быть существенно понижен. На основании термодинамических расчетов показано, что степень образования Ca(H2PO4)2 при 25÷40 оС составляет 64,5÷67,6 %, а CaHPO4 – 0,41÷1,87 %. Для полного извлечения фтористого водорода с помощью нитрата кальция необходимо поддерживать мольные соотношения соли к HF не менее 2.
Образование фторидов и фосфатов алюминия и кальция в водных растворах азотной кислоты и оксидов азота не исследовалось и поэтому не ясно, каким образом будут протекать процессы и какое оптимальное исходное соотношение солей к фтористому водороду следует поддерживать.
Таким образом, на основании теоретических исследований определены пути и способы регенерации и утилизации растворов азотной кислоты и оксидов азота, содержащих фтористый водород и ортофосфорную кислоту. Установлено, что взаимодействие азотнокислого алюминия с фтористым водородом протекает с выделением тепла, а азотнокислого кальция – с его поглощением. Показано, что при установлении химического равновесия степень извлечения фтористого водорода с помощью Ca(NO3)2 достигает при различных температурах 99,35÷99,95 %, а для полного его выделения с учетом побочных реакций необходимо проводить процесс при мольном соотношении соли к HF не менее 2.
Список литературы:
1. Пилипенко А.Г. Комплексные соединения. – М.: Химия, 1963. – 320 с.
2. Некрасов Б.В. Основы общей химии. – М.: Химия, 1968. – 620 с.
3. Рябин В.А., Остроумов М.А., Свит Т.Ф. Термодинамические свойства веществ. – Л: Химия, 1977. – С.35-41.
4. Гринберг А.А. Введение в химию комплексных соединений. – М - Л.: Химия, 1966. – 632 с.
5. Рысс И.Г. Химия фтора и его неорганических соединений. – М.: Госхимиздат, 1956. – 718 с.
6. Саймонс Д. Фтор и его соединения. М.: Госхимиздат, 1953. – 320 с.
7. Синельникова В.С., Подергин В.А., Речкин В.Н. Алюминиды. – К.: Наукова думка, 1965. – 2467 с.
8. Яцимирский К.Б. Термохимия комплексных соединений. М.: Изд-во АН СССР, 1951. – 276 с.
9. Клейнер К.Е. Гидратные комплексные соединения // Журн. общей химии. – 1950. – Т. 20. – № 221. – С. 1747-1750.
10. Тананаев Н.В., Нахамкина Н.А. Комплексные соединения Al, Ca // Труды комиссии аналитхимии АН СССР. – 1951. – № 3. – С. 89-91.
УДК 539.192
Кравченко И.В.
ОКИСЛЕНИЕ n2 И n2o ОКСИДОМ АЗОТА (iv)
Исследованиями окисления N2O и N2 оксидом азота (IV) показано, что NO2 при фотохимическом окислении N2O до NO, N2, O2 не теряется, он превращается в NO, из которого вновь регенерируется. Установлено, что третье возбужденное состояние диоксида азота NO2(2А'') не окисляет молекулярный азот. Табл.1. Ист.6.
Исследования процесса окисления N2 до NO при температурах около 1500К проводятся с целью поиска способа получения азотной кислоты без использования аммиака, а исследования окисления N2O до NO направлено на снижение потерь азотной кислоты в производствах азотной и адипиновой кислот. При этом одновременно решается задача снижения загрязнения атмосферы парниковой и озоноразрушающей закисью азота.
В термохимическом способе получения оксидов азота [1] в качестве окислителя молекулярного азота при 1033К на тугоплавком катализаторе предложено использовать пары азотной кислоты. Конечные продукты газофазного разложения азотной кислоты – NO2, O2 и Н2О не окисляют N2, следовательно, его могут окислить только промежуточные продукты этого процесса, образующиеся по реакции: N2O5« . Менее инертная, чем N2, закись азота также окисляется до NO без катализатора промежуточными продуктами газофазного разложения азотной кислоты при 873-1023К [2].
. Менее инертная, чем N2, закись азота также окисляется до NO без катализатора промежуточными продуктами газофазного разложения азотной кислоты при 873-1023К [2].
Оксид азота (VI) - 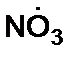 при облучении с длиной волны 662 нм переходит во второе возбужденное состояние NO3(2B2). Это метастабильное соединение диссоциирует на NO и возбужденный атом кислорода конфигурации О('D), который способен окислить N2 до N2O и далее до NO (подобно процессам в стратосфере) [3]. Излучение с длиной волны 662 нм в процессе исходит и передается оксиду азота (VI) от нагретых поверхностей в реакторе.
при облучении с длиной волны 662 нм переходит во второе возбужденное состояние NO3(2B2). Это метастабильное соединение диссоциирует на NO и возбужденный атом кислорода конфигурации О('D), который способен окислить N2 до N2O и далее до NO (подобно процессам в стратосфере) [3]. Излучение с длиной волны 662 нм в процессе исходит и передается оксиду азота (VI) от нагретых поверхностей в реакторе.
Квантово-химическим DFT расчетом (GAUSSIAN-92) определяется, что и оксид азота (IV) третьего возбужденного состояния NO2(2A'') способен окислить N2 до N2O и далее до NO [4]. Это метастабильное состояние может быть образовано из основного состояния облучением с длиной волны 430 нм [5]. Исходя из справочных данных по излучению абсолютно черного тела [6], для образования излучения с такой длиной волны от нагретого вещества необходима температура выше 1200К (в контактном аппарате не достигается).
Для подтверждения возможности фотохимического окисления закиси азота оксидом азота (ІV) использовали лабораторную проточную установку, состоящую из узла непрерывного получения оксидов азота (ІІ) и (ІV), окисления оксида азота (ІІ) до оксида азота (ІV), улавливания NO2 щелочным раствором.
Образование оксидов азота (ІІ) и (IV) происходит в сосуде поз.1 путем приливания концентрированной серной кислоты из мерной емкости поз.2 к насыщенному раствору нитрита натрия:
H2SO4+2NaNO2®Na2SO4+H2O+NO+NO2 (1)
Окисление NO до NO2 происходит непосредственно в сосуде поз.1 и в доокислителе поз.4, заполненном насадкой из стекла, а облучение источником поз.6 – в кварцевой трубке поз.5.

Установка фотохимического окисления закиси азота оксидом азота (IV):
1 – сосуд образования оксидов азота (ІІ) и (IV); 2 – мерная емкость серной кислоты; 3 – насадка из стекла; 4 – доокислитель; 5 – кварцевая трубка; 6 – источник излучния; 7 – щелочная ловушка; 8 – холодильник; 9 – водоструйный насос; 10 – байпасный проход газа на ловушку.
Смесь оксидов азота (ІІ), (IV) и воздуха просасывается водоструйным насосом поз.9 через облучаемую источником поз.6 кварцевую трубку поз.5 и далее щелочную ловушку поз.7 и водяной холодильник поз.8. Процесс ведут до исчезновения бурого цвета в системе поз.1, поз.4, и поз.7, определяемого визуально.
В результате холостого опыта выяснялось несоответствие теоретического количества образующихся оксидов азота (IV) по реакции (1) и практически определяемого количества улавливаемых оксидов азота (IV) анализом в щелочной ловушке поз.7.
Окисление закиси азота проводили на этой же проточной установке. Для этого насыщенный раствор нитрита натрия в сосуде поз.1 заменяли новым и весь объем установки поз.1, поз.4, поз.5 и поз.7 заполняли газом N2O. После этого придавали заданное количество концентрированной серной кислоты из мерной емкости поз.2, включали источник облучения поз.6, водоструйный насос поз.9 и открывали кран подачи воздуха в сосуд поз.1. Процесс вели до исчезновения бурого цвета аналогично холостому опыту (около 1 часа). По окончании опыта анализировали концентрацию щелочи в ловушке поз.7. Большее снижение концентрации щелочи в сравнении с анализом холостого опыта свидетельствовало о протекании реакции окисления N2O:
NO2+N2O  3NO (2)
3NO (2)
NO2+N2O  N2+O2+NO (3)
N2+O2+NO (3)
В щелочной ловушке поз.7 нитрозные газы улавливались
NO+NO2+2NaOH®H2O+NaNO3+NaNO2 (4)
Степень улавливания оксидов азота в поз.7 определялась в сравнении с расходом NaOH по реакции:
H2SO4+2NaOH®Na2SO4+H2O (5)
В опыте с добавлением N2O, где дополнительно должны пройти реакции (2,3) следует ожидать увеличения степени улавливания оксидов азота, определяемой с помощью реакции (5).
На основании количеств образующейся и расходуемой азотной кислоты вычисляли степень её участия в окислении закиси азота в опыте. Для исследования влияния облучения реагирующей смеси на выход NO2 использовали ртутную лампу РПК-4 (фиолетово-сине-зеленый цвет, диапазон длин волн l=370-570 нм). Условия и усредненные результаты (по трем опытам) обнаружения фотохимического окисления N2O и N2 оксидом азота (IV) представлены в таблице.
Результаты опытов фотохимического окисления N2O и N2 оксидом азота (IV)
| № опыта | Раствор NaOH в поз.7 | Степень улавливания оксидов азота, % | Наличие N2O в системе | Источник излучения | |||
| до опыта | после опыта | ||||||
| вес, г | содержание NaOH, % | вес, г | содержание NaOH, % | ||||
| 311,75 | 23,53 | 312,15 | 22,30 | 33,25 | нет | нет | |
| 303,70 | 22,30 | 304,10 | 21,20 | 28,90 | есть | нет | |
| 297,10 | 22,90 | 298,20 | 20,70 | 56,00 | есть | РПК-4 | |
| 300,00 | 22,90 | 300,90 | 22,38 | 12,06 | нет | РПК-4 |
Исследованиями показано, что в условиях опытов 1,2 без облучения газа (N2+O2+NO2+NO+N2O) и (N2+O2+NO2+NO) в сосуде поз.1 и кварцевой трубке поз.5 не произошло возбуждения оксида азота (IV), поскольку не произошло увеличения степени улавливания щелочным раствором оксидов азота более 33,25%. Такого результата следовало ожидать. Энергии возбуждения перехода  отвечает длина волны 430 нм видимого света [5].
отвечает длина волны 430 нм видимого света [5].
Из сравнения результатов опытов 2,3 видно, что при всех равных условиях в опыте 3, где аналогичная опыту 2 газовая смесь облучалась ртутной лампой, степень извлечения оксидов азота возросла до 56,0% (в 1,94 раза), что связано с протеканием превращения
 , hn=278,21 кДж, l=430 нм (6)
, hn=278,21 кДж, l=430 нм (6)
В опыте 4 с работающей байпасной линией поз.10 и с облучением газовой смеси ртутной лампой степень поглощения NO2 не только не увеличилась, а даже практически в 3 раза снизилась. Этот отрицательный результат вызывает ряд вопросов. Возможно, предположим, время пребывания реагентов в кварцевой трубке поз.5 было недостаточным для их взаимодействия, однако при снижении скорости просасывания воздуха насосом поз.9 и, соответственно, увеличении времени пребывания в 4 раза, степень поглощения оксидов азота (IV) практически не изменилась, что свидетельствует об отсутствии корреляции между временем пребывания (в интервале 1-4 ч ) и степенью окисления N2O и N2 до NO.
Необходимо отметить, что в облучаемой трубке поз.5 при закрытой байпасной линии поз.10 газы бесцветные, а во втором доокислителе вплоть до ловушки поз.7 газ снова приобретает бурый цвет, при этом степень поглощения NO2 приближается к значению опыта 1.
Можно предположить, что молекулы NO2 хоть и возбуждаются, но не способны образовать возбужденные атомы О('D), тогда наиболее реакционноспособным окислителем может оказаться только диоксид азота третьего возбужденного состояния NO2(2A''), который будет расходоваться по реакциям:
- на окисление N2O
NO2+N2O  3NO (2)
3NO (2)
NO2+N2O  N2+O2+NO (3)
N2+O2+NO (3)
- на окисление N2
NO2(2A'')+N2®N2O+NO (7)
NO2+N2O  3NO (2)
3NO (2)
NO2+N2O  N2+O2+NO (3)
N2+O2+NO (3)
- на рекомбинацию по бимолекулярному взаимодействию
2NO2(2A'')®2NO+O2 (8)
Анализ представленных реакций приводит к следующим выводам:
1) поскольку в исходной газовой смеси опыта 4 закиси азота нет, то и реакции (2,3) не протекают;
2) NO2(2A'') в условиях опыта 4 не окисляет молекулярный азот, т.к. протекание реакции (7) в свою очередь вызвало бы образование N2O и, соответственно, последующие реакции (2,3) с образованием удвоенного количества NO и далее NO2;
3) протекание реакции (8) наиболее вероятно, т.к. в этом случае после реактора поз.5 должна выходить газовая смесь, состоящая из N2, O2 и NO, а из-за небольшой скорости тримолекулярной реакции 2NO+O2®2NO2 на участке от поз.5 до поз.7 при работающей байпасной линии поз.10 степень улавливания NO2 обнаруживается почти в 3 раза меньшей, чем в опыте без облучения.
Такой вариант механизма реакций дает убедительное объяснение отрицательного результата опыта 4 и приводит к выводу о том, что диоксид азота третьего возбужденного состояния NO2(2A'') не окисляет молекулярный азот. Экспериментально выявляется, что реакция (7) окисления N2 диоксидом азота NO2(2A'') хоть и разрешена термодинамически, все же запрещена по симметрии.
Оксид азота (IV) является наиболее доступным, и, вероятно, экономически целесообразным реагентом для фотохимического окисления N2O до NO, N2, O2 при облучении газовой смеси ртутной лампой (l=430 нм).
Таким образом, проведенными исследованиями показано, что оксид азота (IV) при фотохимическом окислении N2O до NO, N2, O2 не теряется, он превращается в NO, из которого вновь регенерируется. Установлено, что третье возбужденное состояние диоксида азота NO2(2А'') не окисляет молекулярный азот.
Список литературы:
1. Патент 2156730 Россия, МКИ С1 С01 В21/30. Способ получения оксидов азота / Иванов Ю.А., Караваев М.М. (Россия). Заявл. 27.01.2000.
2. Патент 55946 Україна, МКВ С01В21/00. Спосіб отримання оксидів азоту. / Кравченко І.В., Тюльпінов К.О., Дишловий В.І., Тюпало М.Ф., Тюльпінов О.Д., Саломахіна С.О. (Україна). Заявл.19.07.2010. Опубл. 27.12.2010, Бюл. №24.
3. Кравченко И.В. Некаталитическое окисление молекулярного азота и закиси азота промежуточными продуктами распада азотной кислоты // Матеріали І Української конференції «Реакції окиснення. Наука і технології», м.Рубіжне, ІХТ СНУ ім.В.Даля, 2010. – С.31-34.
4. Захаров И.И. О возможности нового автокаталитического процесса связывания молекулярного азота его окислами / И.И.Захаров, И.В.Кравченко, В.И.Дышловой, О.И.Захарова // Материалы V международной научно-технической конференции по катализу «Укркатализ-V», Киев, 2006. – С.53-55.
5. John N. Crowley. OH Formation in the Photoexcitation of NO2 beyond the Dissociation Threshold in the Presence of, Water Vapor / John N. Crowley and Shaun A.Carl //J.Phys. Chem. A 1997, 101, 4178-4184.
6. Кошкин Н.И., Ширкевич М.Г. Справочник по элементарной физике. – М.: Наука, 1972. – 256с.
УДК 678.074:678.01
Єрешко В.П., Кравченко К.А.






