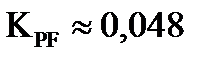Изложены данные, доказывающие, что причиной зависимости выхода дипентаэритрита и биспентаэритритформаля от концентрации формальдегида являются реакции образования полуацеталей пентаэритрита и формальдегида. Оценены кинетические характеристики реакций образования дипентаэритрита и биспентаэритритформаля. Рис. 3, Табл.1, Ист. 12.
Дипентаэритрит - ценный продукт, в частности, используемый для производства высококачественных смазок и лакокрасочных покрытий. Его можно получить наряду с пентаэритритом конденсацией формальдегида с ацетальдегидом [1] или с акролеином [2] в присутствии гидроксида натрия, а также термической дегидратацией пентаэритрита в присутствии катализатора [3].
Последний способ сложен – реакция проводится в твердой фазе при высокой температуре, получается трудно разделимая смесь дипентаэритрита и полипентаэритритов. Первые два способа представляют один и тот же процесс. Причем замена в нем ацетальдегида на акролеин к существенным изменениям результатов не приводит, но значительно усложняет технологический процесс.
При совместном получении дипентаэритрита и пентаэритрита процесс конденсации альдегидов необходимо проводить в таких условиях, когда одновременно достигается максимальный общий выход продуктов и максимальное содержание дипентаэритрита в их смеси. Выбор таких условий упрощается, если имеются необходимые данные, касающиеся механизма и кинетики реакций, приводящих к дипентаэритриту.
Основные черты этого механизма выявлены. Известно, что простая эфирная связь формируется при взаимодействии спирта и ненасыщенного альдегида [4]. В рассматриваемом процессе в качестве спирта могут выступать пентаэритрит, промежуточные оксиальдегиды целевой реакции и другие побочные продукты, а в качестве ненасыщенных альдегидов – только продукты дегидратации оксиальдегидов целевой реакции. При внесении в реакционную смесь до начала процесса конденсации различных спиртов увеличивается выход их простых эфиров, и если вносится пентаэритрит, то увеличивается выход дипентаэритрита [5]. При внесении пентаэритрита с меченным атомом углерода образуется дипентаэритрит с таким же атомом, следовательно, спиртовым компонентом является пентаэритрит, а оксиальдегиды только источником ненасыщенных альдегидов [6], что связано с обратимостью реакций.
Отмеченные данные показывают, что увеличить выхода дипентаэритрита можно, проводя процесс при повышенной концентрации пентаэритрита в реакционной смеси. Это условие все же не являются исчерпывающим - выход дипентаэритрита зависит также от мольного отношения формальдегида и ацетальдегида, и от степени разбавленности реакционных растворов [7].
Частично характер этих зависимостей обусловлен побочной реакцией ацетальдегида [8]. Однако, выход дипентаэритрита сильно снижается и в условиях, когда побочная реакция ацетальдегида практически не влияет на результаты процесса, например, при большом мольном отношении формальдегида и ацетальдегида, особенно в концентрированных реакционных растворах [7]. В ранее выполненных нами исследованиях рассматривались возможные причины такого влияния: ускорение целевой реакции с увеличением избытка формальдегида [9], и образование формаля пентаэритрита в реакции его формальдегидных полуацеталей (далее – полуацеталей) и ненасыщенных альдегидов [10]. Данная работа является продолжением этих исследований.
Экспериментальная часть. Использовали: водный раствор ацетальдегида (20 масс.%), формалин (37 масс.% формальдегида и 2 масс.% метанола), гидроксид натрия и пентаэритрит (98,7 масс.% основного вещества).
При изучении кинетики опыты проводились при начальных условиях: концентрация ацетальдегида 0,47 моль·л-1, мольное отношение: формальдегида и ацетальдегида 1:5 и 1:10, гидроксида натрия и ацетальдегида 1,4:1, пентаэритрита и ацетальдегида 0,5:1, температура 20 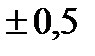 0С, при определении выхода пентаэритрита, дипентаэритрита и биспентаэритритформаля – при начальных условиях: концентрация ацетальдегида от 0,25 до 1,2 моль·л-1, мольное отношение: формальдегида и ацетальдегида от 1:4 до 1:10, гидроксида натрия и ацетальдегида 1,5:1, температура 20 и 45 0С.
0С, при определении выхода пентаэритрита, дипентаэритрита и биспентаэритритформаля – при начальных условиях: концентрация ацетальдегида от 0,25 до 1,2 моль·л-1, мольное отношение: формальдегида и ацетальдегида от 1:4 до 1:10, гидроксида натрия и ацетальдегида 1,5:1, температура 20 и 45 0С.
В термостатируемую стеклянную колбу с магнитной мешалкой и термометром вносили водный раствор гидроксида натрия и формалина, растворяли в нем пентаэритрит, а затем вносили водный раствор ацетальдегида. В течение процесса отбирали пробы реакционных растворов. Для определения концентрации гидроксида натрия и альдегидов в реакционной смеси, пробы сливали в колбы с известным количеством 0,1н раствора соляной кислоты, взятой с избытком, и титрованием 0,1н раствором гидроксида натрия в присутствии фенолфталеина определяли концентрацию гидроксида натрия. Затем в колбы вносили заданное количество водного раствора солянокислого гидроксиламина и титрованием 0,1н раствором щелочи в присутствии бромфенола синего определяли концентрацию формальдегида. Влияние концентрации формиата натрия учитывали по результатам измерения концентрации формальдегида в растворах смесей формальдегида и формиата натрия.
Концентрацию пентаэритрита, дипентаэритрита и биспентаэритритформаля в реакционной смеси определяли методом газо-жидкостной хроматографии силильных эфиров этих веществ [11]. Концентрацию пентаэритрита определяли также через дибензаль пентаэририта [12]. Концентрацию образовавшегося пентаэритрита, 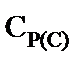 , моль·л-1, рассчитывали по уравнению
, моль·л-1, рассчитывали по уравнению
 (1)
(1)
где  ,
, 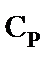 ,
, 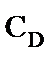
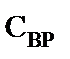 - соответственно, концентрация пентаэритрита начальная и текущая, дипентаэритрита и биспентаэритритформаля, моль·л-1. 3
- соответственно, концентрация пентаэритрита начальная и текущая, дипентаэритрита и биспентаэритритформаля, моль·л-1. 3
Концентрацию альдегидов в альдольной конденсации, рассчитывали по уравнению
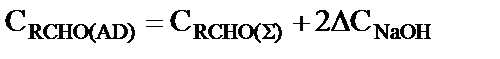 (2)
(2)
где  - общая концентрация альдегидов,
- общая концентрация альдегидов,  - расход гидроксида натрия, моль·л-1.
- расход гидроксида натрия, моль·л-1.
Результаты и их обсуждение. Сопоставить кинетику процесса конденсации в условиях, отличающихся только величиной мольного отношения формальдегида и ацетальдегида, позволяют данные, приведенные на рис. 1.
Характер изменения концентрации альдегидов в реакциях, не сопровождающихся расходом гидроксида натрия, свидетельствует о значительном различии скоростей альдольной конденсации и реакции Канниццаро, вследствие чего они разделены во времени.
Практически одинаковые в сравниваемых опытах экстремальные участки кривых зависимостей концентрации пентаэритрита от времени, относятся к периоду процесса, когда пентаэритрит еще не образуется, но протекает и практически завершается альдольная конденсация, в которой последовательно формируются метилол- и диметилолуксусный альдегиды, способные дегидратироваться с получением акролеина и метилолакролеина.
Экстремальные участки кривых фактически зеркально отражают изменения концентрации оксиальдегидов целевой реакции и продуктов их дегидратации, а переход экстремальных участков в обычные кинетические кривые совпадает с периодом максимального накопления триметилолуксусного альдегида и достижения предравновесного состояния в целевой реакции.
Полученные результаты показывают, что в процессе конденсации, наряду с пентаэритритом, образуются дипентаэритрит и биспентаэритритформаль. Так как предшественниками биспентаэритритформаля могут быть только полуацетали пентаэритрита, то в начальном периоде процесса с ненасыщенными альдегидами взаимодействуют и пентаэритрит и полуацетали, а экстремальные участки кривых являюся результирующими этих реакций – при определении концентрации пентаэритрита полуацетали распадаются и определить их концентрацию не удается.
Рассматриваемые результаты показывают также, что в условиях проведенных опытов достигается предравновесное состояние, а константы равновесия однотипных реакций с участием пентаэритрита и с участием полуацеталя практически не отличаются. Концентрации продуктов реакций пентаэритрита и полуацеталей с ненасыщенными альдегидами быстро проходят через максимум и сильно уменьшаются в момент достижения предравновесного состояния в целевой реакции процесса, когда, собственно, и начинают формироваться дипентаэритрит и биспентаэритритформаль. Это показывает, что экстремальный характер участка кривой определяют, в основном, цепи реакций от акролеина, а выход продуктов - цепи реакций от метилолакролеина, причем произведение констант равновесия первой цепи реакций практически на порядок больше произведения констант равновесия второй цепи реакций.
 , моль·л-1 , моль·л-1
|
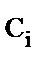 , моль·л-1 , моль·л-1
|
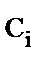 , моль·л-1 , моль·л-1
|
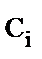 , моль·л-1 , моль·л-1
|
 , моль·л-1 , моль·л-1
|
 ,моль·л-1 ,моль·л-1
|
1 – пентаэритрит, 2 – расход гидроксида натрия, 3 – пентаэритрит синтезированный (расчет), 4 – дипентаэритрит, 5 – биспентаэритритформаль, 6 – концентрация альдегидов в альдольной конденсации, 7 – общая концентрация альдегидов; температура 20 0С, начальные концентрации, моль·л-1: ацетальдегида 0,47, формальдегида а) 2,35, б) 4,7, гидроксида натрия 0,66
Рис. 1. Кинетика процесса
Известные данные, касающихся механизмов альдольной конденсации, дегидратации оксиальдегидов, ионизации спиртов и гидратации альдегидов [4] и полученные данные приводят к механизму реакций образования дипентаэритрита и биспентаэритритформаля, схема которого приведена на рис. 2.
При взаимодействии пентаэритрита с формальдегидом могут образоваться последовательно четыре полуацеталя
 (3)
(3)
где  – общая и равновесная концентрация пентаэритрита, моль·л-1;
– общая и равновесная концентрация пентаэритрита, моль·л-1;  - равновесная концентрация формальдегида, моль·л-1.
- равновесная концентрация формальдегида, моль·л-1.
| HOCH2OCH2C(CH2OH)4-n(CH2OCH2OH)n-1
|
| -OCH2OCH2C(CH2OH)4-n(CH2OCH2OH)n-1 + H+
|
| HOCH2C(CH2OH)4-n(CH2OCH2OH)n-1
|
| -OCH2C(CH2OH)4-n(CH2OCH2OH)n-1 +H+
|
| (R)3CC H2-OCH2O-C H2C(R)3
|
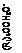
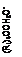
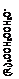

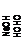
Рис. 2. Схема, поясняющая механизм реакций образования пентаэритрита, дипентаэритрита и биспентаэритритформаля
Эффективная константа равновесия этих реакций  , л·моль-1, равна
, л·моль-1, равна
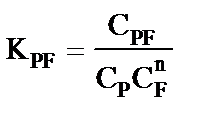 , (4)
, (4)
где  – эмпирический показатель степени (
– эмпирический показатель степени (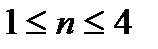 );
);
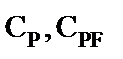 - эффективные равновесные концентрации пентаэритрита и полуацеталей, моль·л-1.
- эффективные равновесные концентрации пентаэритрита и полуацеталей, моль·л-1.
Уравнение материального баланса
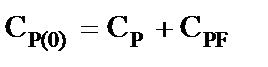 (5)
(5)
Решая систему уравнений (4) и (5) можно найти эффективные концентрации
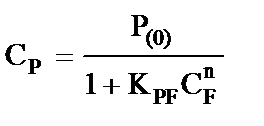 ,
, 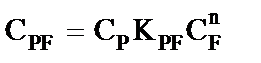 (6)
(6)
Реакции образования биспентаэритритформаля и дипентаэритрита протекают параллельно в предравновесных условиях, поэтому отношение скоростей реакций Канниццаро, завершающих формирование биспентаэритритформаля и дипентаэритрита, составляет (обозначения по рис. 2)
 , (7)
, (7)
а отношение выходов биспентаэритритформаля и дипентаэритрита
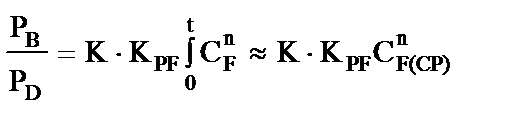 , (8)
, (8)
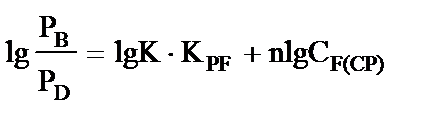 (9)
(9)
где 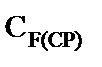 - средняя концентрация формальдегида в период формирования биспентаэритритформаля и дипентаэритрита, моль·л-1
- средняя концентрация формальдегида в период формирования биспентаэритритформаля и дипентаэритрита, моль·л-1
Графическое решение уравнения (9) с использованием экспериментальных данных (таблица 1) приведено на рис. 3.
Рис. 3. Графическое решение уравнения (9)
Наблюдаемая линейность зависимости свидетельствует о корректности принятых допущений. Найдены:  л·моль-1,
л·моль-1, 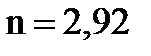 .
.
Параллельные реакции, приводящие к биспентаэритритформалю и дипентаэритриту, проходят последовательно через одинаковые стадии взаимодействия одинаковых групп молекул реагирующих веществ. Судя по однотипному строению молекул, их реакционная способность не должна сильно отличаться. Поэтому вполне вероятно, что  и
и 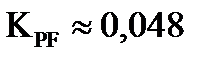
Таблица 1
Экпериментальные данные к решению уравнения (9)
| Начальные
концентрации,
моль·л-1
| Выход продуктов, %
| Начальные
концентрации,
моль·л-1
| Выход продуктов, %
|
| CH3CHO
| HCHO
| P
| D
| B
| CH3CHO
| HCHO
| P
| D
| B
|
| Температура 20 0С
|
| 0,25
| 2,50
| 78,2
| 3,92
| 1,120
| 0,75
| 7,50
| 80,3
| 1,13
| 9,580
|
| 0,25
| 1,25
| 67,6
| 5,10
| 0,053
| 0,75
| 3,75
| 70.6
| 9,12
| 1,920
|
| 0,45
| 4,50
| 82,3
| 2,80
| 4,980
| 0,75
| 3,00
| 65.8
| 10,50
| 0,407
|
| 0,45
| 2,25
| 72,1
| 7,73
| 0,411
| 1,20
| 12,00
| 75,4
| 0,29
| 7,430
|
| 0,45
| 1,80
| 68,6
| 7,85
| 0,072
| 1,20
| 4,80
| 59,8
| 6,71
| 1,115
|
| Температура 45 0С
|
| 0,45
| 4,50
| 81,6
| 2,87
| 4,680
| 0,75
| 7,50
| 77,6
| 1,03
| 9,120
|
| 0,45
| 2,25
| 73,2
| 7,61
| 0,386
| 0,75
| 3,75
| 69,2
| 8,84
| 1,630
|
| 0,45
| 1,80
| 69,8
| 7,94
| 0,062
| 0,75
| 3,00
| 67.1
| 9,37
| 0,345
|
| Примечание: P - пентаэритрит, D – дипентаэритрит, B - биспентаэритритформаль
|
Выводы. Зависимость выхода дипентаэритрита и биспентаэритритформаля от концентрации формальдегида обусловлена образованием полуацеталей пентаэритрита и формальдегида.
Список литературы:
1. Пат. 2441597 США, МКИ C07C 31/24. Manufacture of pentaerythritol / Remensnyder J.P., Bowman P.I., Bart R.H. - Заявл. 24.04.1943: Опубл. 18.05.1948.
2. Авторск. свид. 387959 СССР, МПК С07С 31/24. Способ получения ди- и трипентаэритрита /Лунев С.Е., Одиноков В.Н., Епимахова О.В., Образцов А.Е.-Заявл.26.02.1971:Опубл.22.06.1973.3.
3. Пат. 3000901 США, МПК B28D 1/00. Dehydration of pentaerythritol / Wyler J.A.- Заявл. 04.05.1959: Опубл.19.09.1961.
4. Ингольд К. Теоретические основы органической химии. М.:Мир,1969.С.848. Ingold C.K. Structure and mechanism in organic chemistry.L.:Cornell university press,1969.
5. Wawzonek S., Rees D.A. Formation of ether in the preparation of pentaerythritol // J. Amer. Chem. Soc. – 1948. – Vol. 70. – Р. 2433-2435.
6. Trevoy L.M., Muers M.E. Pentaerythritol derivatives. Mechanism of formation of dipentaerythritol // Canad. J. Chem. -1963.- Vol. 41.- P. 770-776.
7. Белкин Д.И. Исследование зависимости выхода пентаэритрита и дипентаэритрита от начальных условий реакции конденсации формальдегида и ацетальдегида // Ж. прикл. химии. 1979. -Т.52. – С. 237-239.
8. Белкин Д.И. Побочные реакции, ацетальдегида и промежуточных альдегидов // Ж. прикл. химии. 1986. - Т. 59. – С. 379-384.
9. Белкин Д.И. Анализ структуры системы реакций процесса на основе интегральных характеристик // Ж. прикл. химии. 1986. - Т. 59. – С. 374-378.
10. Белкин Д.И. Кинетика конденсации формальдегида и ацетальдегида // Ж. прикл. химии. 1990. - Т. 63. – С. 2312-2320.
11. Sporek K., Williams A.F. The termination of pentaerythritol // Analyst. – 1955. – Vol. 80 - P. 29 – 36.
12. Mleziva J. Poznámka k přpravě čistého pentaerythritu a jeho atanoveni // Chem listy. - 1954. -T. 48, № 9.-L. 1418-11419.
УДК 661.546.175.323
Шевченко В.Ю. Гринь Г.И., Роменский А.В., Созонтов В.И., Колесникова Т.Б.
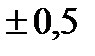 0С, при определении выхода пентаэритрита, дипентаэритрита и биспентаэритритформаля – при начальных условиях: концентрация ацетальдегида от 0,25 до 1,2 моль·л-1, мольное отношение: формальдегида и ацетальдегида от 1:4 до 1:10, гидроксида натрия и ацетальдегида 1,5:1, температура 20 и 45 0С.
0С, при определении выхода пентаэритрита, дипентаэритрита и биспентаэритритформаля – при начальных условиях: концентрация ацетальдегида от 0,25 до 1,2 моль·л-1, мольное отношение: формальдегида и ацетальдегида от 1:4 до 1:10, гидроксида натрия и ацетальдегида 1,5:1, температура 20 и 45 0С.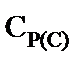 , моль·л-1, рассчитывали по уравнению
, моль·л-1, рассчитывали по уравнению (1)
(1) ,
, 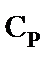 ,
, 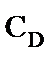
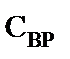 - соответственно, концентрация пентаэритрита начальная и текущая, дипентаэритрита и биспентаэритритформаля, моль·л-1. 3
- соответственно, концентрация пентаэритрита начальная и текущая, дипентаэритрита и биспентаэритритформаля, моль·л-1. 3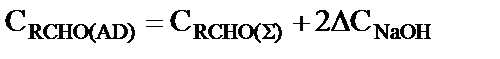 (2)
(2) - общая концентрация альдегидов,
- общая концентрация альдегидов,  - расход гидроксида натрия, моль·л-1.
- расход гидроксида натрия, моль·л-1.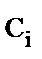 , моль·л-1
, моль·л-1
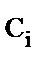 , моль·л-1
, моль·л-1
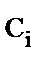 , моль·л-1
, моль·л-1
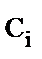 , моль·л-1
, моль·л-1
 , моль·л-1
, моль·л-1
 ,моль·л-1
,моль·л-1
 (3)
(3) – общая и равновесная концентрация пентаэритрита, моль·л-1;
– общая и равновесная концентрация пентаэритрита, моль·л-1;  - равновесная концентрация формальдегида, моль·л-1.
- равновесная концентрация формальдегида, моль·л-1.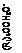
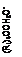
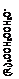

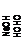
 , л·моль-1, равна
, л·моль-1, равна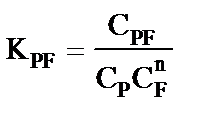 , (4)
, (4) – эмпирический показатель степени (
– эмпирический показатель степени (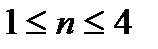 );
);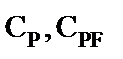 - эффективные равновесные концентрации пентаэритрита и полуацеталей, моль·л-1.
- эффективные равновесные концентрации пентаэритрита и полуацеталей, моль·л-1.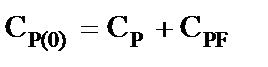 (5)
(5)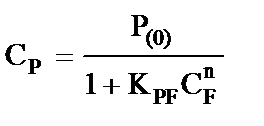 ,
, 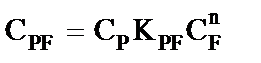 (6)
(6) , (7)
, (7)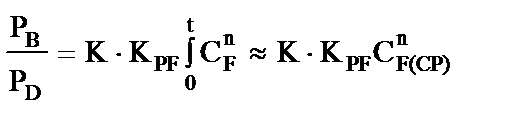 , (8)
, (8)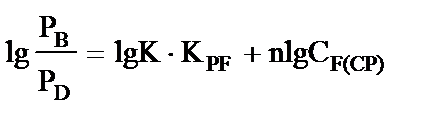 (9)
(9)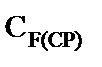 - средняя концентрация формальдегида в период формирования биспентаэритритформаля и дипентаэритрита, моль·л-1
- средняя концентрация формальдегида в период формирования биспентаэритритформаля и дипентаэритрита, моль·л-1 л·моль-1,
л·моль-1, 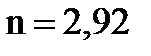 .
. и
и