Сообщение І
Проведено исследование процесса каталитического окисления водного раствора формальдегида озоном в присутствии солей металлов переменной валентности. Установлено, что заметную каталитическую активность в этом процессе проявляют сульфат ванадила, сульфат и пирофосфат марганца (ІІ). Наибольшей каталитической активностью обладает сульфат марганца, в присутствии которого можно достигнуть полное окисление формальдегида до СО2 и Н2О. Полученные экспериментальные данные согласуются с предложенным представлениями о механизме катализа, включающем быструю реакцию озона с металлом и реакцию окисленной формы металла с формальдегидом.
Озонирование питьевых и сточных вод является одним из самых эффективных методов их очистки от токсичных органических примесей. Особую актуальность исследования процессов озонирования воды приобрели в настоящее время в связи с тяжелой экологической ситуацией, сложившейся в больших городах и промышленных регионах. В крупнейшем химическом регионе Украины в городах Рубежное, Северодонецк, Лисичанск, а также в Луганске состояние с обеспечением питьевой водой приближается к катастрофическому. Прогрессирует загрязнение воды фенолами, ароматическими аминами, нитропродуктами и другими соединениями, поступающими в подземные источники из промышленных накопителей и с промывными водами. Кроме того, в питьевых водах обнаружены полициклические ароматические углеводороды, в частности, бензпирен, как полагают, угольного происхождения.
Известно [1,2], что большинство вышеуказанных соединений обладают высокой реакционной способностью в реакциях с озоном, поэтому их деструктивное разрушение в водных растворах протекает легко и позволяет достигнуть значительного снижения их концентраций при относительно малых расходах озона. Характер продуктов озонолиза определяется строением исходного органического соединения, природой растворителя, кислотностью среды. Так при озонолизе водных растворов ароматических соединений основными продуктами их озонолитической фрагментации являются низшие алифатические спирты, альдегиды, кетоны, моно- и дикарбоновые кислоты [2]. В реакциях с озоном эти соединения по сравнению с аренами обладают пониженной реакционной способностью (константы скорости озонной деструкции алифатических карбоновых, дикарбоновых кислот, спиртов, альдегидов лежат в пределах 10-2÷10-5 л/моль∙с [1]), что приводит к их накоплению в концентрациях, превышающих ПДК.
Таким образом, в результате озонирования не только не достигается полная минерализация воды, но и возможно увеличение концентраций вредных веществ. Это дает основание предположить, что качество воды после озонирования не всегда удовлетворяет санитарно-гигиеническим нормам.
Наиболее трудным представляется удаление формальдегида, который в водных растворах очень устойчив к действию озона за счет гидратации и образования стабильных полимерных форм. В связи с этим в качестве модели для исследования процессов исчерпывающего окисления органических соединений озоном нами выбраны водные растворы формальдегида.
Одним из путей решения этой задачи является каталитическое гомогенное и гетерогенное окисление озоном, которое может протекать как с сохранением углерод-углеродных структур органических соединений, так и с количественным образованием диоксида углерода и воды [3].
Экспериментальная часть. Окисление водных растворов формальдегида озонокислородной смесью проводили при стандартной температуре в реакторе идеального смешения с турбинной мешалкой (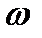 =30÷40 с-1), обеспечивающей высокую интенсивность размешивания и большую поверхность контакта газовой и жидкой фаз (рис.1).
=30÷40 с-1), обеспечивающей высокую интенсивность размешивания и большую поверхность контакта газовой и жидкой фаз (рис.1).

|

|
| а) | б) |
| Рис.1.а) Реактор с турбинной самовсасывающей мешалкой: 1 - реактор; 2 – барботер для подачи озонокислородной смеси; 3 – турбинная мешалка; 4 – пробоотботник; 5 – газоотводная трубка. б) Продольный разрез мешалки. |
За ходом окисления следили по изменению концентрации озона и формальдегида: концентрацию озона на входе и выходе из реактора спектрофотометрически при длине волны 300 нм [4], а концентрацию формальдегида определяли цветной реакцией с хромотроповой кислотой [5] по калибровочному графику, представленному на рис.2. В качестве катализаторов нами испытаны сульфат ванадила (IV), сульфат марганца (II) и пирофосфат марганца (II).
Обсуждение результатов. Основные результаты проведенных в настоящей работе исследований представлены на рис.3.
При озонировании формальдегид в водном растворе в течение трех часов практически не расходуется (кривая 1), что указывает на его высокую стабильность к действию озона.

1 – кювета 10 мл;
2 – кювета 50 мл.
Рис.2. Зависимость оптической плотности раствора формальдегида от концентрации
Известно [6], что соли металлов переменной валентности (МПВ) являются катализаторами жидкофазных процессов окисления многих органических соединений озоном. В настоящей работе нами изучено окисление водных растворов формальдегида в присутствии сульфата марганца (II),
сульфата ванадила (IV) и пирофосфата марганца (II) (рис.3). Эти соединения часто используются только как катализаторы окисления, и, учитывая их реакционную способность к озону и окислительную активность, могут служить моделью для разработки методов и технологии очистки сточных вод от вредных органических соединений.
Как видно из рис.3. из выбранных соединений МПВ наибольшей каталитической активностью в этом процессе обладает сульфат марганца (ІІ), при использовании которого уже за два часа достигается полупревращение формальдегида (кривая 4). Значительно наименьшей активность обладают сульфат ванадила (кривая 2) и пирофосфат марганца (кривая 3). Полученные экспериментальные данные хорошо согласуются с известными представлениями о механизме окисления органических соединений в присутствии солей металлов переменной валентности [3]. Согласно этим представлениям каталитический цикл включает две основные стадии – окисление озоном МПВ до высших окисленных форм и окисление последними органических субстратов. Таким образом, скорость каталитического окисления озоном зависит от скорости реакции озона с МПВ, значения окислительно-восстановительного потенциала окисленной формы катализатора и скорости окисления последней органического соединения.
В соответствии с этими представлениями наблюдаемое изменение каталитической активности МПВ в исследуемой здесь системе VOSO4<Mn2P2O7 <MnSO4 можно объяснить следующими факторами:
1. Высокая каталитическая активность MnSO4 связана, во-первых, с высокой скоростью его реакций с озоном (при рН5 k=1,2∙104÷4∙103 [6] л/моль∙с) и, во-вторых, значения окислительно-восстановительных потенциалов окисленных форм, т.е. пар MnIII/MnII, MnIV/MnII и MnVII/MnII составляют соответственно 1,51 В,

Т=298 К; Vж=400 мл; [О3]о=1,5∙10-3 моль/л; [СН2О]о=1∙10-3 моль/л; [Н2О2]о=1∙10-3 моль/л; [VOSO4]о=[Mn2P2O7 ]о=[ MnSO4]о=0,044 моль/л.
Рис.3. Кинетические кривые расходования формальдегида при озонировании его водного раствора
без катализаторов – 1, в присутствии VOSO4 - 2,
в присутствии Mn2P2O7 - 3, в присутствии MnSO4 - 4.
1,58 В и 1,51 В [7,8], т.е. все они являются сильными окислителями, способными окислять как по одноэлектронному механизму, так и с многоэлектронными переходами.
2. Пирофосфат марганца реагирует с озоном также с высокой скоростью: найденная нами по методике, описанной в [9], бимолекулярная константа скорости составляет 9∙103 л/моль∙с. В результате этой реакции образуется очень устойчивый пирофосфатный комплекс MnIII, структура которого неописана и, по нашему мнению, может представлять собой дигидроксипирофосфат (НОMnIIIРО3-РО3MnIIIОН) или гидратированный комплексный ион [(Н2О)4MnIIIРО3-О-РО3MnIII(Н2О)4]2+. Окислительно-восстановительный потенциал пирофосфатного комплекса MnIII не известен, но можно полагать, что за счет стабилизации металла прочным лигандным окружением он ниже, чем потенциал любой из указанных выше форм марганца.
3. Низкая каталитическая активность сульфата ванадила обусловлена как низкой скоростью его реакции с озоном (k=13,3 л/моль∙с [6]), так и низким значением окислительно-восстановительного потенциала, составляющего 0,044 В [8].
Таким образом, полученные экспериментальные данные свидетельствуют о высокой каталитической активности сульфатных и пирофосфатных комплексов марганца при окислении водных растворов формальдегида озоном. Вместе с тем, механизм катализа остается невыясненным и требует дополнительных исследований.
Автор выражает благодарность профессору Тюпало Н.Ф. за помощь в организации эксперимента и обсуждении результатов.
Список литературы:
1. Разумовський С.Д., Галстян Г.А., Тюпало М.Ф. Озон та його реакції з аліфатичними сполуками: Монографія. – Луганськ: видавництво СУДУ, 2000.- 318с. ISBN 866-590-241-5
2. Галстян Г.А., Тюпало Н.Ф., Разумовский С.Д. Озон и его реакции с ароматическими соединениями в жидкой фазе: Монография. – Луганск: издательство ВНУ им. В.Даля, 2004.- 272с. ISBN 966-590-458-2
3. Якоби В.А. Окислениие ароматических соединений озоном: Дис… д-ра хим. наук: 05.17.05. –М., 1982. – 330с. –машинопись.
4. Тюпало Н.Ф., Ведерников В.В., Заика Р.Г., Семенюк Т.Н. Прибор для непрерывного спектрофотометрического определения озона// Химия и технология воды. – 1990. – т.12, № 5, с.459-461.
5. Лурье Ю.Ю. Аналитическая химия промышленных сточных вод. – М.: Химия, 1984. - 448с.
6. Галстян Г.А., Тюпало Н.Ф. Рідкофазне каталітичне окиснення ароматичних сполук озоном: Монографія. – Луганськ: видавництво СНУ ім. В.Даля, 2007.- 415с. ISBN 978-966-590-751-0
7. Лурье Ю.Ю. Справочник по аналитической химии. – М.: Химия, 1971. -467с.
8. Турьян Я.И. Окислительно-восстановительные реакции и потенциалы в аналитической химии. – М.: Химия, 1989. – 248 с. ISBN 7245-0343-3
9. Тюпало Н.Ф. Реакции гетаренов с озоном: Дис… д-ра хим. наук: 05.17.05. –М., 1987. – 330с. – машинопись.
УДК 541.127: 542.943
Седых А.А., Галстян Г.А., Галстян А.Г., Манде Гарба
КИНЕТИКА И МЕХАНИЗМ ОКИСЛЕНИЯ ГИДРОКСИТОЛУОЛОВ ОЗОНОМ В УКСУСНОМ АНГИДРИДЕ В ПРИСУТСТВИИ АЦЕТАТА МАРГАНЦА
Гидрокситолуолы взаимодействуют с озоном по двум конкурирующим направлениям: по ароматическому кольцу и метильной группе. Соотношение продуктов окисления зависит от условий озонирования. Установлено, что селективность окисления по метильной группе значительно повышается в присутствии солей переходных металлов. Доказано, что реакция протекает по ионно-радикальному механизму. Рис.1, Табл. 1, Лит. 10.
Ранее [1] было показано, что в уксусном ангидриде в присутствии серной кислоты гидрокситолуолы ацилируются и участвуют в реакции с озоном в виде ацетокситолуолов. Окисление, в основном, развивается по двойным связям ароматического кольца и характеризуется низкой селективностью образования продуктов окисления по метильной группе. В качестве продуктов окисления с сохраненной ароматической структурой идентифицированы ацетоксибензилацетаты (9,5%) и ацетоксибензилидендиацетаты (3,5 %) – продукты ацилирования соответствующих ацетоксибензиловых спиртов и ацетоксибензальдегидов.
В продолжении данной работы была исследована реакция ацетокситолуолов с озоном в присутствии ацетата марганца и серной кислоты в среде уксусного ангидрида.
При озонировании ацетокситолуолов в растворе уксусного ангидрида при 278К в присутствии минеральной кислоты и ацетата марганца (II) в значительной степени предотвращается озонолиз бензольного кольца, и реакция проходит в направлении оксисления метильной группы с образованием преимущественно ацетоксибензилацетатов и, в меньшей мере, ацетоксибензилидендиацетатов (табл.1). При исчерпывающем окислении в системе появляются ацетоксибензойные кислоты. Ацетоксигруппа в положении 2 вызывает стерические осложнение, в следствие чего селективность окисления снижается на 11,0-12,0%.
Начальная скорость окисления ацетокситолуолов линейно зависит от концентрации реагентов в первой степени и не зависит от концентрации молекулярного кислорода в газовой смеси. В системе практически с самого начала (5-9 мин.) марганец (II) переходит в марганец (III), что по времени совпадает с достижением максимальной скорости накопления продуктов реакции (рис.1). Торможение реакции вплоть до полного расхода субстрата в условиях опытов не наблюдается. Если ацетокситолуол вводится в систему, в которой марганец находится в окисленной форме, образование продуктов реакции начинается сразу с максимальной скоростью. Прекращение подачи озона в зону реакции ведет к полной остановке окисления со скоростью восстановления окисленной формы марганца (рис.1).
Селективность окисления максимальна в условиях соизмеримых концентраций катализатора и субстрата и при низких температурах (275-278К). Расход озона на образование продуктов реакции составляют 110,0-114,0 % от теории. Серная кислота в условиях реакции является катализатором ацилирования: в ее присутствии уксусный ангидрид количественно гетеролизуется с образованием ацилий-иона, являющегося активным ацилирующим агентом (Н3С–С+=О) [2].
Таблица 1
Окисление ацетокситолуолов озоном в присутствии ацетата марганца (II) при 278К. [АсОArCH3]o= 0,4; [Mn(OАc)2]o= 0,18; [Н2SO4]o= 1,2; [O3]o= =4,0·10-4 моль∙л -1; Vр. = 0,01 л; τ = 0,83 ч. (для о-изомера τ = 1,3 ч.).
| Соединение | Продукты реакции, моль∙ л -1 | Селективность окисления по метильной группе, % | |
| Ацетоксибензил- ацетат | Ацетокси-бензилиден-диацетат | ||
| 2-ацетокситолуол | 0,221 | 0,040 | 65,3 |
| 3-ацетокситолуол | 0,251 | 0,054 | 76,3 |
| 4-ацетокситолуол | 0,253 | 0,056 | 77,2 |

1 – ацетокситолуол; 2 – ацетоксибензилацетат; 3 – ацетоксибензилидендиацетат; 4 – ацетоксибензойная кислота; 5 – ацетат марганца (III)
[АсОArCH3]o= 0,4; [Mn(OАc)2]o= 0,18; [Н2SO4]o= 1,2; [O3]o= 4,0·10-4 моль∙л -1; Vр. = 0,01 л; τ = 1 ч.; стрелкой показано прекращение подачи озона в систему.
.
Рис.1 Кинетика окисления 4-ацетокситолуола озоном в уксусном ангидриде в присутствии ацетата марганца (II) при 278К
Согласно полученным экспериментальным и литературным данным [3-5] рассмотрена следующая схема окисления ацетокситолуолов:
АсОArCH3 + O3 → АсОAr  H2 + HO· + O2, H2 + HO· + O2,
| (1) |
| АсОArCH3 + O3 → АсОArCH2OH + O2, | (2) |
| АсОArCH3 + O3 → озониды, | (3) |
| Mn2+ + O3 + H+ ® Mn3+ + HO· + О2, | (4) |
АсОArCH3 + Mn3+ ® АсОAr  H2 + Mn2+ + Н+, H2 + Mn2+ + Н+,
| (5) |
АсОAr  H2 + O2 ® АсОArCH2O2·, H2 + O2 ® АсОArCH2O2·,
| (6) |
АсОArCH2O2· + АсОArCH3 → АсОArCH2О2Н + АсОАr  Н2, Н2,
| (7) |
| АсОArCH2O2· + Mn2+ + Н+ → АсОArCH2О2Н + Mn3+, | (8) |
| АсОArCH2O2· + О3 → АсОArCH2O· + 2О2, | (9) |
| АсОArCH2О2Н → АсОArCH2О · + НО·, | (10) |
| АсОArCH2О2Н + Mn2+ → АсОArCH2О¯ + Mn3+ + HO·, | (11) |
| 2АсОArCH2O2· ® 2АсОArCH2O· + O2, | (12) |
| АсОArCH2O· + Mn2+ ® АсОArCH2О¯ + Mn3+, | (13) |
| АсОArCH2O¯ + О=С+-СН3 ® АсОArCH2ОСОСН3, | (14) |
| 2 АсОArCH2O2· ® АсОArCH2ОН + АсОArCHО + О2, | (15) |
| АсОArCH2ОН + О=С+-СН3 ® АсОArCH2ОСОСН3 + Н+, | (16) |
| АсОArCHО + (СН3СО)2О ® АсОArCH(ОСОСН3)2 | (17) |
При температуре 278–288К в условиях некаталитического окисления основным направлением является озонолиз (р.3), и лишь около 20% ацетокситолуолов окисляются по метильной группе. В этих условиях механизм процесса, по-видимому, сводиться к известной схеме нецепного окисления (р.1–2–3–6–15), а роль озона ограничивается его участием в реакциях (1), (2) и (3) [3-6]. Преимущественное образование спиртов вытекает из предположения о том, что они накапливаются по – реакциям (2), (14) и (15), а альдегиды лишь по реакции (15) с последующим ацилированием по реакции (17).
В условиях катализа ацетатом марганца озон расходуется, в основном, по реакции (4) с образованием активной формы катализатора Мn(III) (при [АсОАrСН3]0 = 0,4; [Мn(ОАс)2]0 = 0,18; [О3]0 = 4,0·10-4 моль·л-1, К1-3 = 0,59; К4= 19,2 л·моль-1·с-1; W4= 1,4·10-3; W1 - 3 = 9,5·10-5 моль·л-1·с-1, т.е. W4:W1-3 = 15:1), которая инициирует окисление ацетокситолуолов по метильной группе с образованием ацетоксибензильных радикалов по реакции (5) (W5=10,0·10-3·0,4·0,18=7,2·10-4 моль·л-1·с-1). Образующиеся в условиях окисления по реакции (6) ацетоксипероксидные радикалы, далее могут расходоваться по реакциям (7,8,9) (реакции продолжения цепи) либо рекомбинировать по реакциям (12) – (15).
В условиях, когда Т=278К; [АсОАrСН3]о=0,4; [Мn(ОАс)2]о=0,18; [АсОArCH2OО·]=10-6 моль·л-1 и К7=0,23 [7]; К 8= 10,0 [7]; К9 =103 [9]; К15 = 108 [7] л·моль-1·с-1, W7 = 9·10-8; W8 = 1,7·10-6; W9 = 4·10-7; W12 ≈ W15 ≈1,6·10-4 моль· л -1 (расчет выполнен для толуола). Рассчитанные скорости показывают, что реакции (7), (8) и (9) протекают значительно медленнее, чем реакция инициирования (5) и реакция рекомбинации радикалов (12) или (15), т.е. окисление по метильной группе осуществляется, по-видимому, по ионно-радикальному нецепному механизму. Формальным признаком нецепной реакции является длина цепи ν = W8 · W12-1<<1. В пользу нецепного пути также свидетельствуют следующие факты: селективность окисления по метильной группе достигает своего максимального значения при соизмеримых концентрациях субстрата и катализатора – ацетата марганца (II); расход озона на один моль ацетокситолуола близок к теоретическому; прекращение подачи озона в зону реакции приводит к полной остановке процесса с переходом Мn(III) в Мn(II).
Образующийся по реакции (6) ацетоксипероксидный радикал, в соответствии с нецепным механизмом окисления может рекомбинировать по реакции (12), или по реакции (15) [7]. С точки зрения кинетики процесса более привлекательным является образование продуктов реакции по схеме реакций (12)–(13)–(14) через стадию рекомбинации пероксидных радикалов (р.12) с образованием алкоксильных радикалов. Поскольку алкоксильные радикалы сильные окислители [10], то в объеме жидкой фазы естественно ожидать, по аналогии с пероксидными радикалами [9], их взаимодействие с восстановленной формой марганца (II) с образованием аниона (р.13), который далее реагирует с ацилий-катионом (р.14), образуя ацетоксибензилацетат – достаточно устойчивое к действию озона соединение.
Образование спирта и альдегида по реакции (15) с последующим их ацилированием маловероятно, поскольку спирт и альдегид должны накапливаться в системе по реакции (15) параллельно с образованием приблизительно равных количеств. Однако это противоречит экспериментальным данным, в соответствии с которыми в результате окисления образуется преимущественно спирт.
Таким образом, окисление ацетокситолуолов в присутствии ацетата марганца (II) представляет следующую последовательность реакций: (4) – (5) – (6) – (12) – (13) – (14). Материальный баланс процесса, включающий эти реакции, приводит к уравнению:
АсОАrСН3 + Мn2+ + О3 → АсОАrСН2О¯ + Мn3+ + НО· +1/2О2 (26)
которое соответствует кинетическому уравнению для скорости каталитической нецепной реакции, найденному из экспериментальных данных:
r = Кэф[АсОАrСН3]0[Мn(ОАс)2]0[О3] (27)
Образование в условиях катализа ацетоксибензилидендиацетатов, вероятнее всего, происходит при дальнейших окислениях ацетоксибензилацетатов по аналогичной схеме:
АсОArCH2OСОСН3 +Мn2+ ® АсОAr  HOСОСН3 + Мn3+ + Н+, (28)
HOСОСН3 + Мn3+ + Н+, (28)
АсОAr  HOСОСН3 + О2 ® АсОAr
HOСОСН3 + О2 ® АсОAr  OСОСН3, (29)
OСОСН3, (29)
2АсОAr  OСОСН3 ® 2 АсОAr
OСОСН3 ® 2 АсОAr  OСОСН3 + О2, (30)
OСОСН3 + О2, (30)
АсОAr  OСОСН3 + Мn2+ ® АсОAr
OСОСН3 + Мn2+ ® АсОAr 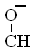 OСОСН3 + Мn3+, (31)
OСОСН3 + Мn3+, (31)
АсОAr 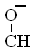 OСОСН3 + О=С+-СН3 ® АсОArCH(OСОСН3)2 (32)
OСОСН3 + О=С+-СН3 ® АсОArCH(OСОСН3)2 (32)
В соответствии с рассматриваемой схемой реакций селективность окисления по метильной группе определяется, например, для 4-ацетокситолуола, соотношением скоростей реакций:
 (33)
(33)
где а – селективность окисления по метильной группе в условиях некаталитического окисления 4-ацетокситолуола; при 278К (а=0,205; К1+2+3=0,59; K5 =10,0∙10-3л·моль-1·с-1; [АсОArCH3]o=0,4; [Mn(OAc)2]o=0,18; [O3]o=4·10-4 моль∙л-1). Рассчитанная селективность окисления по метильной группе равна 89,4 %, что несколько выше экспериментальной (77,2%).
Выводы. Предлагаемая схема каталитического окисления ацетокситолуолов озоном, несмотря на отсутствие кинетических данных по многим реакциям, в целом, отвечает общим закономерностям и позволяет на практике, по крайней мере, на качественном уровне прогнозировать селективность каталитического окисления ацетокситолуолов без затрагивания ароматического кольца и осуществить управление отдельными стадиями каталитического цикла.
Уксусный ангидрид в присутствии серной кислоты является источником ацилий-катиона – мощной ацилирующей частицы, в присутствии которой окисление приостанавливается на стадии образования соответствующих спиртов в виде ацетоксибензилацетатов (55,3–63,3%) и в меньшей мере альдегидов, в виде ацетоксибензилидендиацетатов (10,0–14,0%).
Список литературы:
1. Седых А.А. Окисление п-крезола озоном в уксусном ангидриде / А.А. Седых, А.Г. Галстян // Журнал прикладной химии. – 2006. – Т.79, №1. – С. 125 – 128.
2. Галстян Г.А. Кинетика и механизм каталитической реакции озона с метилбензолами в уксусной кислоте / Г.А. Галстян, Т.М. Галстян, Л.И. Микуленко // Кинетика и катализ. – 1994. – Т.35, №2. – С. 255–260.
3. Нейланд О.Я. Органическая химия / Нейланд О.Я. – М.: Высшая школа, 1990. – 751 с.
4. Галстян Г.А. Озон и его реакции с ароматическими соединениями в жидкой фазе / Галстян Г.А., Тюпало Н.Ф., Разумовский С.Д. – Луганськ: ВУНУ, 2004. – 272 с.
5. Galstyan G.A. The kinetics and reaction mechanism with alkilbenzoles in liquid phase / G.A. Galstyan, E.V. Potapenko, I.M. Pluzhnik, A.G. Romanenko, A.G. Galstyan // Regional Conference on Ozone Generation and Application to Water and Waster Treatment. – Moscow. – 1998. – P. 667 – 694.
6. Галстян Г.А. Кинетика и механизм реакции озона с метилбензолами в уксусной кислоте / Г.А. Галстян, Т.М. Галстян, С.М. Соколова // Кинетика и катализ. – 1992.– T.35, №4. – C. 779 – 877.
7. Денисов Е.Т. Механизм жидкофазного окисления кислородсодержащих соединений / Денисов Е.Т., Мицкевич И.И., Агабеков В.Е. – Минск: Наука и техника, 1975. – 336 с.
8. Захаров И.В. Механизм и параметры окисления алкилароматических угле-водородов в присутствии ионов кобальта и брома / И.В. Захаров, Ю.В. Галетой // Нефтехимия. – 1978. – Т.18, № 4. – С. 615 – 621.
9. Эмануэль Н.М. Цепные реакции окисления углеводородов в жидкой фазе / Эмануэль Н.М., Денисов Е.Т., Майзус З.К. – М.: Наука, 1965. – 375 с.
10. Денисов Е.Т. Константы скорости гомолитических жидкофазных реакций / Денисов Е.Т. – М.: Наука, 1971. – 711 с.
УДК 547.657+547.541.112
Погорєлова І.П., Андреєв П.Ю., Потапенко Е.В.






