В роботі досліджено вплив каталізаторів на швидкість реакції синтезу сульфурвмісних олігоестерів на основі діетиленгліколю, малеїнового ангідриду та себацинової кислоти і натрієвої солі пропанхлоргідринсульфокислоти. Визначено кількісні показники швидкості реакції поліконденсації в присутності каталізаторів за двох температур. Табл. 2, Джерел 4.
За нашого часу в період гострої нестачі енергетичних ресурсів розвиток світової економіки значно залежить від створення енергозберігаючих технологій. У зв'язку з цим створення технологічних процесів, що дозволяють інтенсифікувати існуючі процеси, зокрема, процеси поліконденсації, є актуальною задачею. Скорочення тривалості високотемпературних процесів поліконденсації можна досягти, використовуючи каталізатори.
Для прискорення реакції поліконденсації на практиці широко застосовуються такі ж речовини, які каталізують типові реакції конденсації (мінеральні кислоти, кислі солі, органічні сульфокислоти, галогеніди металів, луги, тощо) [1]. За поліестерифікації роль сильних кислот полягає в тому, що вони активують карбоксильну групу за рахунок попередньої протонізації за наступним механізмом:

В даній роботі досліджено вплив каталізатороів (сульфанілової та сульфамінової кислот) на кінетичні характеристики синтезу сульфурвмісних олігоестерів [2].


сульфанілова кислота сульфамінова кислота
Експериментальна частина. Синтези сульфурвмісних олігоестерів здійснено згідно з правилом В.В. Коршака за еквімолекулярного співвідношення основних мономерів: суміші діетиленгліколю (ДЕГ) і натрієвої солі пропанхлоргідринсульфокислоти (Na-ПХГСК) та кислотних мономерів: суміші малеїнового ангідриду (МА) з себациновою кислотою (СК) [3].
Визначення кінетики і впливу на неї каталізаторів здійснено методом кінцевих груп, а саме вимірюванням концентрації карбоксильних груп протягом процесу поліконденсації. Константи швидкості поліконденсації в присутності (0,04 % мас.) та за відсутності каталізаторів було визначено за двох температур (160 0С та 180 0С), щоб мати інформацію про її залежність від температури.
За поліконденсації мономерів відбувається взаємодія карбоксильних груп з гідроксильними:
R – COOH + R` – OH → R – COO – R` + H2O
За утворення естерної групи спостерігається зменшення концентрації карбоксильних та гідроксильних груп, що було контрольоване визначенням кислотного числа реакційної суміші через певні проміжки часу.
Відбір проб на визначення кислотного числа починали після гомогенізації реакційної маси, яка відбувалась приблизно через годину витримки системи за температури 150 0С. Відбір проб проведено через кожні 30 хвилин протягом 4 годин. Титруванням проби розчином їдкого калі визначено кислотне число суміші, а через нього концентрацію карбоксильних груп [4].
Кислотне число визначали за формулою:
К.Ч. =  , мг КОН/г, (1)
, мг КОН/г, (1)
де: V1 – об’єм 0,1 н розчину лугу, який витрачено на титрування робочої проби, мл;
V2 – об’єм 0,1 н розчину лугу, який витрачено на титрування контрольної проби, мл;
0,0056 – кількість г КОН в 1 мл 0,1 н розчину (титр), г/мл;
g – наважка реакційної суміші, г.
За результат аналізу прийнято середньоарифметичне значення результатів трьох паралельних випробувань.
Кількість молей КОН, що прореагувала з реакційної масою, дорівнює кількості молей карбоксильних груп: ν (COОH) = ν (КОН) = m (KOH) / M(KOH)
У таблиці 1 наведено вихідні дані та результати розрахунків концентрації карбоксильних груп.
Таблиця 1
Кінетика зміни концентрації карбоксильних груп
| Тривалість синтезу, хвилин | Маса проби, г | Об’єм 0,1н розчину КОН, мл | К.Ч., мг КОН/г | Концентрація карбоксильних груп, С, моль/кг | |
| Без каталізатора | |||||
| Температура 160 0С | |||||
| 0,3867 | 22,7 | 328,73 | 5,87 | ||
| 0,5125 | 27,4 | 5,35 |
Продовження таблиці 1
| 0,4329 | 21,2 | 274,24 | 4,90 | |
| 0,3963 | 17,9 | 252,94 | 4,52 | |
| 0,4360 | 18,3 | 235,05 | 4,20 | |
| 0,5021 | 18,7 | 219,72 | 3,92 | |
| 0,4174 | 15,3 | 205,27 | 3,67 | |
| Температура 180 0С | ||||
| 0,3541 | 17,1 | 270,43 | 4,83 | |
| 0,2578 | 8,1 | 176,09 | 3,14 | |
| 0,4228 | 9,6 | 127,15 | 2,27 | |
| 0,3954 | 6,9 | 97,72 | 1,75 | |
| 0,4529 | 6,4 | 79,13 | 1,41 | |
| 0,2197 | 2,6 | 66,27 | 1,18 | |
| 0,2873 | 2,9 | 56,53 | 1,01 | |
| Каталізатор – сульфамінова кислота - 0,04 % масових | ||||
| Температура 160 0С | ||||
| 0,3865 | 11,9 | 172,42 | 3,08 | |
| 0,2862 | 7,8 | 148,71 | 2,86 | |
| 0,5120 | 11,9 | 130,18 | 2,32 | |
| 0,4651 | 9,6 | 115,59 | 2,06 | |
| 0,4389 | 8,2 | 104,63 | 1,87 | |
| 0,3178 | 5,4 | 95,15 | 1,70 | |
| 0,2821 | 4,4 | 87,34 | 1,58 | |
| Температура 180 0С | ||||
| 0,2878 | 2,8 | 50,83 | 0,904 | |
| 0,1859 | 1,2 | 36,15 | 0,646 | |
| 0,2217 | 1,1 | 27,79 | 0,496 | |
| 0,1768 | 0,7 | 22,17 | 0,386 | |
| 0,4526 | 1,5 | 18,56 | 0,331 | |
| 0,6353 | 1,8 | 15,87 | 0,283 | |
| 0,0,3659 | 0,9 | 13,71 | 0,246 | |
| Каталізатор – сульфанілова кислота – 0,04 % масових | ||||
| Температура 160 0С | ||||
| 0,1987 | 6,1 | 171,92 | 3,07 | |
| 0,3511 | 9,3 | 148,33 | 2,65 | |
| 0,5386 | 12,5 | 129,97 | 2,32 | |
| 0,3128 | 6,4 | 114,58 | 2,05 |
Продовження таблиці 1
| 0,3561 | 6,6 | 103,79 | 1,85 | |
| 0,4687 | 7,9 | 94,39 | 1,69 | |
| 0,4018 | 6,2 | 86,45 | 1,54 | |
| Температура 180 0С | ||||
| 0,4053 | 1,9 | 26,25 | 0,469 | |
| 0,3616 | 1,4 | 21,68 | 0,387 | |
| 0,3345 | 1,1 | 18,42 | 0,329 | |
| 0,2797 | 0,8 | 16,02 | 0,286 | |
| 0,5964 | 1,5 | 14,08 | 0,252 | |
| 0,2677 | 0,6 | 12,55 | 0,224 | |
| 0,2476 | 0,5 | 11,31 | 0,202 |
Швидкість реакції залежно від кінетичного рівняння, якому вона підпоряковується, становить:
для першого порядку ∆C / ∆τ  (2)
(2)
для другого порядку ∆C / ∆τ  (3)
(3)
для третього порядку ∆C / ∆τ  (4)
(4)
де: kI, kII, kIII – константи швидкості реакцій певного порядку.
С – концентрація карбоксильних груп, моль/кг;
Якщо кожне з цих рівнянь представити у вигляді прямої лінії, одержимо:
у = a ∙x, (5)
де: x може дорівнювати залежно від порядку реакції С, С2 або С3.
Реакція матиме той порядок, для якого на графіку буде пряма лінія залежності швидкості реакції від x.
У таблиці 2 наведено розраховані концентрації карбоксильних груп, що прореагували (∆С), швидкості реакції (∆С/∆τ) та величини С, С2 і С3. Обробка на ПЕОМ результатів, одержаних для систем в присутності та за відсутності каталізатора, показала, що прямолінійна залежність та практично однакові значення констант швидкості спостерігаються за опису реакції кінетичним рівнянням другого порядку.
Таблиця 2
Швидкості реакції поліконденсації
| Тривалість синтезу, хвилин | Концентрація карбоксильних груп, С, моль/кг | Зміна концен-трації, ∆С, моль/кг | Про-міжок часу, ∆t, c | Швид-кість реакції, (∆С/∆τ) ∙ 104, моль/кг∙с | С2 | С3 | ||
| початко-ва | кін-цева | |||||||
| Без каталізатора | ||||||||
| Температура 160 0С | ||||||||
| 5,87 | 5,35 | 0,52 | 2,91 | 34,46 | 202,3 | |||
| 5,35 | 4,90 | 0,45 | 2,50 | 28,58 | 152,8 | |||
| 4,90 | 4,52 | 0,38 | 2,11 | 23,98 | 117,4 | |||
| 4,52 | 4,20 | 0,32 | 1,78 | 20,40 | 92,1 | |||
| 4,20 | 3,92 | 0,28 | 1,52 | 17,82 | 73.9 | |||
| 3,92 | 3,67 | 0,25 | 1,43 | 15,39 | 60,4 | |||
| 3,67 | ||||||||
| Температура 180 0С | ||||||||
| 4,83 | 3,14 | 1,69 | 9,36 | 23,33 | 112,7 | |||
| 3,14 | 2,27 | 0,87 | 4,85 | 9,89 | 31,1 | |||
| 2,27 | 1,75 | 0,52 | 2,92 | 5,15 | 11,7 | |||
| 1,75 | 1,41 | 0,34 | 1,84 | 3,04 | 5,3 | |||
| 1,41 | 1,18 | 0,23 | 1,28 | 2,00 | 2,8 | |||
| 1,18 | 1,01 | 0,17 | 0,97 | 1,40 | 1,6 | |||
| 1,01 | ||||||||
| Каталізатор – сульфамінова кислота (0,04 % масових) | ||||||||
| Температура 160 0С | ||||||||
| 3,08 | 2,66 | 0,42 | 2,35 | 9,47 | 29,2 | |||
| 2,66 | 2,32 | 0,34 | 1,84 | 7,05 | 18,7 | |||
| 2,32 | 2,06 | 0,26 | 1,45 | 5,40 | 12,5 | |||
| 2,06 | 1,87 | 0,19 | 1,09 | 4,26 | 8.8 | |||
| 1,87 | 1,70 | 0,17 | 0,94 | 3,49 | 6,5 | |||
| 1,70 | 1,56 | 0,14 | 0,78 | 2,89 | 4,9 | |||
| 1,56 | ||||||||
| Температура 180 0С | ||||||||
| 0,904 | 0,646 | 0,258 | 1,44 | 0,82 | 0,7 | |||
| 0,646 | 0,496 | 0,150 | 0,83 | 0,42 | 0,3 | |||
| 0,496 | 0,396 | 0,100 | 0,56 | 0,24 | 0,1 | |||
Продовження таблиці 3
| 0,396 | 0,331 | 0,065 | 0,36 | 0,16 | 0,06 | ||
| 0,331 | 0,283 | 0,048 | 0,27 | 0,10 | 0,04 | ||
| 0,283 | 0,246 | 0,037 | 0,21 | 0,08 | 0,02 | ||
| 0,246 | |||||||
| Каталізатор – сульфанілова кислота (0,04 % масових) | |||||||
| Температура 160 0С | |||||||
| 3,07 | 2,65 | 0,42 | 2,34 | 9,42 | 28,9 | ||
| 2,65 | 2,32 | 0,33 | 1,82 | 7,01 | 18,6 | ||
| 2,32 | 2,05 | 0,27 | 1,53 | 5,38 | 12,5 | ||
| 2,05 | 1,85 | 0,20 | 1,07 | 4,18 | 8,6 | ||
| 1,85 | 1,69 | 0,16 | 0,93 | 3,43 | 6,4 | ||
| 1,69 | 1,54 | 0,15 | 0,79 | 2,84 | 4,8 | ||
| 1,54 | |||||||
| Температура 180 0С | |||||||
| 0,469 | 0,387 | 0,082 | 0,453 | 0,22 | 0,103 | ||
| 0,387 | 0,328 | 0,059 | 0,324 | 0,15 | 0,058 | ||
| 0,328 | 0,286 | 0,042 | 0,238 | 0.11 | 0,035 | ||
| 0,286 | 0,252 | 0,034 | 0,192 | 0,08 | 0,023 | ||
| 0,252 | 0,224 | 0,028 | 0,152 | 0,06 | 0,015 | ||
| 0,224 | 0,202 | 0,022 | 0,123 | 0,05 | 0,011 | ||
| 0,202 |
Нижче наведено результати розрахунку констант швидкості поліконденсації для систем без каталізатора за температур 160 0С та 180 0С.
Константи швидкості реакції розраховано за формулою:
kII =  , кг/(моль·с) (6)
, кг/(моль·с) (6)
Без каталізатора
За температури 160 0С: За температури 180 0С:
k1 = 2,91 ∙ 10‾4 / 28,58 = 1,02 ∙ 10‾5 k1 = 9,36 ∙ 10‾4 / 9,89 = 9,47 ∙ 10‾5
k2 = 2,50 ∙ 10‾4 / 23,98 = 1,04 ∙ 10‾5 k2 = 4,85 ∙ 10‾4 / 5,15 = 9,42 ∙ 10‾5
k3 = 2,11 ∙ 10‾4 / 20,40 = 1,04 ∙ 10‾4 k3 = 2,92 ∙ 10‾4 / 3,04 = 9,59 ∙ 10‾5
k4 = 1,78 ∙ 10‾4 / 17,81 = 1,01∙ 10‾5 k4 = 1,84 ∙ 10‾4 / 2,00 = 9,24 ∙ 10‾5
k5= 1,52 ∙ 10‾4 / 15,39 = 9,88 ∙ 10‾6 k5 = 1,28 ∙ 10‾4 / 1,40 = 9,11 ∙ 10‾5
k6 = 1,43∙ 10‾4 / 13,43 = 1,07 ∙ 10‾5 k6 = 9,67 ∙ 10‾5 / 1,02 = 9,49 ∙ 10‾5
Середнє значення константи швидкості:
k160 оС = 1,03∙ 10‾5 кг/(моль∙с).
k180оС = 9,39∙ 10‾5 кг/(моль∙с)
Розраховані таким чином константи швидкості реакції з використанням сульфамінової кислоти та сульфанілової кислот як каталізатора дорівнюють:
Каталізатор – сульфамінова Каталізатор – сульфанілова кислота кислота
Температура 160 0С:
k1 = 3,34 ∙ 10‾5 k1 = 3,33 ∙ 10‾5
k2 = 3,41 ∙ 10‾5 k2 = 3,38 ∙ 10‾5
k3 = 3,39 ∙ 10‾4 k3 = 3,65 ∙ 10‾‾5
k4 = 3,12 ∙ 10-5 k4 = 3,12 ∙ 10-5
k5 = 3,25 ∙ 10‾5 k5 = 3,28 ∙ 10‾5
k6 = 3,18 ∙ 10‾5 k6 = 3,30 ∙ 10‾5
kсер = 3,28 ∙ 10‾5 kсер = 3,34 ∙ 10‾5
Температура 180 0С:
k1 = 3,45 ∙ 10‾4 k1 = 3,03 ∙ 10‾4
k2 = 3,37 ∙ 10‾4 k2 = 3,00 ∙ 10‾4
k3 = 3,55 ∙ 10‾4 k3 = 2,91 ∙ 10‾‾4
k4 = 3,26 ∙ 10‾4 k4 = 3,03 ∙ 10-4
k5 = 3,33 ∙ 10‾4 k5 = 3,03 ∙ 10‾4
k6 = 3,43 ∙ 10‾4 k6 = 3,02 ∙ 10‾4
kсер = 3,40 ∙ 10‾4 kсер = 3,00 ∙ 10‾4
Результатами експериментів показано, що і сульфанілова, і сульфамінова кислоти прискорюють поліконденсацію.
Ефективність дії сульфамінової кислоти складає:
за температури 160 0С: 3,28 ∙ 10‾5 / 1,03∙ 10‾5 = 3,18
за температури 180 0С: 3,40∙ 10‾4 / 9,38∙ 10‾5 = 3,62
Ефективність дії сульфанілової кислоти складає:
за температури 160 0С: 3,34 ∙ 10‾5 / 1,03∙ 10‾5 = 3,24
за температури 180 0С: 3,00∙ 10‾4 / 9,38∙ 10‾5 = 3,19
Практично однакові значення ефективності каталітичної дії пов’язані з хімічною будовою цих кислот. Наявність однакових функціональних груп, які завдяки полярному характеру орієнтують активні центри поліконденсації, забезпечує практично однакову ефективність каталітичної дії.
Температурний коефіцієнт реакції визначено з правила Вант-Гоффа:

Його значення складатимуть:
Без каталізатора  =
= 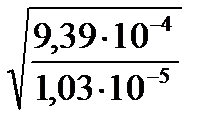 = 3,01
= 3,01
З сульфаміновою кислотою  =
=  = 3,21
= 3,21
З сульфаніловою кислотою  =
=  = 3,00
= 3,00
Температурний коефіцієнт швидкості реакції приблизно становить 3 в усіх випадках, що свідчить про подібність механізму реакції за наявності каталізатора і без нього, коли каталітичну виявляють кінцеві карбоксильні групи олігоестеру.
Висновки. Досліджено процес поліконденсації з утворенням сульфурвмісних олігоестерів без каталізатора та в присутності сульфанілової та сульфамінової кислот. Знайдено кінетичні характеристики процесу поліконденсації та показано, що реакція підкоряється кінетичному рівнянню другого порядку з температурним коефіцієнтом ~ 3.
Список літератури:
1. Кулезнев В.Н., Шершнев В.А. Химия и физика полимеров. – М.: Высшая школа, 1988. – 312 с.
2. Маслош В.З., Мякухина В.Т., акад. Литвиненко Л.М. Синтез и исследование водорастворимых олигоэфиров. - Доклады АН СССР, т.238, №4, 1978, с. 901-904
3. Соколов Л.Б. Основы синтеза полимеров методом поликонденсации. – М.: Химия, 1979. – 264 с.
4. Торопцева А.М., Белогородская К.В, Бондаренко В.М. Лабораторны й практикум по химии и технологии высокомолекулярных соединений. – Л.: Химия, 1972. – 416 с.
УДК 628.336.515:658.567
Островка В.І., Рубан Е.В., Чесновська О.С., Мороз В.О., Попов Є.В.






