Розподіл Максвела
Закон розподілу швидкостей Максвела
Розподіл молекул за абсолютними значеннями швидкостей
Характерні швидкості розподілу Максвела
Експериментальна перевірка розподілу Максвела
Література: [1] стор. 65-78, [2] стор. 63-83, [7] стор. 244-273.
- Накресліть криву максвеловського розподілу швидкостей. Яка швидкість характеризує середню кінетичну енергію молекул газу? Яка швидкість входить у вираз для середньої довжини вільного пробігу молекул?
- Як змінюється розподіл Максвела із зростанням температури?
- Розподіл Максвела допускає будь-які великі швидкості і кінетичні енергії молекул. Як це узгодити із конечною повною кінетичною енергією молекул газу?
- Накресліть схеми для перевірки розподілу Максвела.
ü Звідки випливає, що в стані рівноваги всі частини системи мають однакову температуру?
ü Який зв’язок між розподілами Максвела і Гауса?
В середині XIX ст. все більшого розвитку набувало уявлення про молекулярний рух в газі як про рух пружних вільно літаючих кульок, яке інтенсивно розвивалось Кренігом та Клаузіусом, яким за традицією приписується встановлення зв’язку внутрішньої енергія ідеального газу із температурою.
В архівах британської Королівської спілки лорд Релей знайшов роботи Вотерстона, які пролежали без жодної уваги 45 років (J. Waterston, 1843, 1846) і в яких розподіл Максвела вже містився. Сучасники просто ігнорували ці роботи – їх автор не мав достатнього авторитету. В теоретичну фізику, а потім і в практику, ввійшов саме розподіл Максвела 1860 р. (більш точно Джеймс Клерк Максвел зробив доповідь про статистичний розподіл за швидкостями  та
та  в 1859 р. на зборах Британської асоціації сприяння прогресу). Пізніше Больцман поширив цей розподіл на інші форми руху, а в 1971 році показав, що для трансляційного руху його структура є єдиною можливою!
в 1859 р. на зборах Британської асоціації сприяння прогресу). Пізніше Больцман поширив цей розподіл на інші форми руху, а в 1971 році показав, що для трансляційного руху його структура є єдиною можливою!
Розподіл Максвела – по суті перший розподіл за мікроскопічними станами. В поєднані з достатньо наочними уявленнями про молекулярний рух як про, поступальний рух пружинних кульок цей розподіл дозволив розглянути цілу низку задач, пов’язаних не тільки із систему типу газ, але і з деякими питаннями переносу. Це без сумніву, послужило стимулом для подальшого розвитку молекулярно-кінетичної теорії.
На попередній лекції ми поставили питання: знайти кількість молекул із швидкостями, які лежать у деякому інтервалі  поблизу заданої швидкості
поблизу заданої швидкості  ; інакше – яка ймовірність того, що будь-яка з молекул газу має швидкість, яка лежить у еякому інтервалі
; інакше – яка ймовірність того, що будь-яка з молекул газу має швидкість, яка лежить у еякому інтервалі  поблизу заданої швидкості
поблизу заданої швидкості  . І ми з вами отримали вираз для функції розподілу молекул за швидкостями
. І ми з вами отримали вираз для функції розподілу молекул за швидкостями
 ,
,
яка інтерпретується як густина ймовірності розподілу швидкісних точок молекул в просторі швидкостей. Наша з вами задача – визначити цю функцію.
Отже маємо газ із дуже великою кількістю частинок  тотожних між собою, і вони знаходяться в стані хаотичного теплового руху при певній температурі. Вважаємо, що силові поля відсутні.
тотожних між собою, і вони знаходяться в стані хаотичного теплового руху при певній температурі. Вважаємо, що силові поля відсутні.
Знайдемо ймовірність того, що  - компонента швидкості лежить в інтервалі
- компонента швидкості лежить в інтервалі  . Виходячи з наших попередніх міркувань, ця ймовірність дорівняє
. Виходячи з наших попередніх міркувань, ця ймовірність дорівняє
 ,
,
де  - функція розподілу, але вона характеризує розподіл молекул не за повною швидкістю, а тільки за проекцією
- функція розподілу, але вона характеризує розподіл молекул не за повною швидкістю, а тільки за проекцією  на вісь
на вісь  . Тобто
. Тобто  - об’ємна або тримірна функція розподілу в просторі швидкостей, а
- об’ємна або тримірна функція розподілу в просторі швидкостей, а  - одномірна або лінійна функція в тому ж просторі.
- одномірна або лінійна функція в тому ж просторі.
Відповідно для інших компонент
 .
.
- Чому позначено функції розподілу за різними компонентами однією буквою?
- Тому що напрямки всі рівноправні, а отже функції мають однаковий вигляд.
Позначимо попадання молекули в швидкості інтервали  ,
,  та
та  як події „1”, „2” та „3” відповідно. Знайдемо ймовірність того, що молекула пододає в елемент об’єму швидкісного простору
як події „1”, „2” та „3” відповідно. Знайдемо ймовірність того, що молекула пододає в елемент об’єму швидкісного простору
 ,.
,.
Це складна подія, яка є добутком подій „1”, „2” та „3”. Максвел припустив, що ці події незалежні! Тоді ймовірність такої події є добутком ймовірностей незалежних подій.
Це припущення, а з ним і перше виведення закону розподілу швидкостей, завдалось критиці фізиків і математиків. Зокрема мова йшла про те, що швидкості молекул після зіткнень не можуть бути незалежними від їх значень до зіткнення, оскільки вони пов’язані законам збереження енергії та імпульсу.
Подальші дослідження показали, що це положення вірне, але потребує обґрунтування. Ми приймаємо його на віру. Таким чином, ймовірність того, що швидкісна точка опиниться одночасно всередині трьох інтервалів  ,
,  та
та 
 .
.
Але ми раніше писали для тієї ж ймовірності  . З цього випливає, що функція
. З цього випливає, що функція  має вигляд
має вигляд
 . (1)
. (1)
Ще декілька слів про нашу функцію. Оскільки напрямки в просторі не виділенні
 .
.
Тобто  залежить тільки від модуля або, що еквівалентно, від квадрату
залежить тільки від модуля або, що еквівалентно, від квадрату  .
.
Аналогічно, внаслідок ізотропності, об’ємна функція не залежить від напрямку повної швидкості  , але від її квадрату. Замість квадратів швидкостей використаємо в якості аргументів відповідні кінетичні енергії
, але від її квадрату. Замість квадратів швидкостей використаємо в якості аргументів відповідні кінетичні енергії
 .
.
Тепер запишемо (1) у вигляді
 . (2)
. (2)
В (1) та (2) функції різні, але ми скористались тими ж позначеннями для простоти.
Рівняння (2) повністю визначає вигляд функції  , а отже й
, а отже й  . Розв’яжемо це функціональне рівняння наступним чином.
. Розв’яжемо це функціональне рівняння наступним чином.






Повернемося до наших позначень
 ,
,
 - знайдемо з умов нормування;
- знайдемо з умов нормування;
 , інакше
, інакше  , інакше
, інакше  буде нескінченно зростати, що фізично неможливо.
буде нескінченно зростати, що фізично неможливо.
Для функції розподілу маємо
 ,
,
де  - ця функція і виражає розподіл Максвела.
- ця функція і виражає розподіл Максвела.
Залишилось знайти постійні  та
та  . Розглянемо ще раз функцію розподілу за компонентою швидкості. Це гаусова крива. Площа елементарної полоски дає ймовірність того, що
. Розглянемо ще раз функцію розподілу за компонентою швидкості. Це гаусова крива. Площа елементарної полоски дає ймовірність того, що  -компонента лежить в інтервалі
-компонента лежить в інтервалі  . А повна площа - ймовірність того, молекула має певну компоненту швидкості. Це достовірна подія і інтеграл від
. А повна площа - ймовірність того, молекула має певну компоненту швидкості. Це достовірна подія і інтеграл від  до
до  повинен дорівнювати 1.
повинен дорівнювати 1.
 .
.
Зрозуміло, що  значення швидкостей молекул не можуть мати швидкість більше певного значення. Таке граничне значення задається швидкістю світла. Тому інтегрування від
значення швидкостей молекул не можуть мати швидкість більше певного значення. Таке граничне значення задається швидкістю світла. Тому інтегрування від  до
до  - лише математичний прийом. Але він не призводить до помилки, оскільки функція
- лише математичний прийом. Але він не призводить до помилки, оскільки функція  дуже швидко падає із зростанням
дуже швидко падає із зростанням  .
.
Робимо заміну  .
.
Це інтеграл Пуассона. Брати його частинами не треба – необхідно використати спеціальний прийом і перейти до полярних координат.
Це дасть 
 .
.
Нарешті знайдемо  . Давайте з допомогою функції
. Давайте з допомогою функції 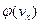 знайдемо середню кінетичну енергію теплового руху
знайдемо середню кінетичну енергію теплового руху
 .
.
Знову виконуємо ту ж саму заміну:
 .
.
Цей інтеграл вже береться частинами
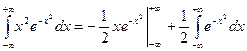
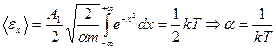 .
.
Остаточно маємо

 .
.

- остаточна формула, яка виражає максвелівський закон розподілу за швидкостями.
 Таким чином ми отримали функцію розподілу молекул за компонентами швидкості, тобто за величиною і за напрямками (
Таким чином ми отримали функцію розподілу молекул за компонентами швидкості, тобто за величиною і за напрямками ( задано в напрямку осі
задано в напрямку осі  ,
,  - осі
- осі  ,
,  - осі
- осі 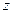 ). Графік функції розподілу молекул
). Графік функції розподілу молекул 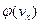 зображений на рис. 1. Легко побачити, що розподіл симетричний відносно початку координат і має максимум
зображений на рис. 1. Легко побачити, що розподіл симетричний відносно початку координат і має максимум  при проекції швидкості
при проекції швидкості  ,
,  - доля молекул із компонентами
- доля молекул із компонентами  . З підвищенням температури частина таких молекул зменшується. Позитивні і негативні значення
. З підвищенням температури частина таких молекул зменшується. Позитивні і негативні значення  мають однакову ймовірність, тому найбільш ймовірна проекція і середня проекція швидкості дорівнюють нулеві
мають однакову ймовірність, тому найбільш ймовірна проекція і середня проекція швидкості дорівнюють нулеві 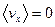 .
.






