Поняття процесу. Рівноважні і нерівноважні процеси.
Енергія, робота, теплота.
Перший закон термодинаміки.
Робота при ізопроцесах.
Література: [1] стор. 119-132, [2] стор. 95-103, [7] стор. 44-66.
- В чому сутність термодинамічного методу дослідження фізичних явищ?
- Як співвідносяться поняття „теплота” та „робота”?
- Сформулюйте перший початок термодинаміки і застосуйте його до різних ізопроцесів в газах?
- Чому нерівноважні процеси не можна зобразити на діаграмах стану?
Рівноважні і нерівноважні процеси
До цього ми вивчали деякі властивості газів або суміші газів, у яких параметри з часом не змінюються, тобто ми розглядали з вами лише рівноважний стан. Тепер ми переходимо до випадку, коли параметри – тиск, об’єм, температура – систем будуть змінюватись з часом. В цьому випадку ми будемо казати, що відбуваються процес:
- при зміні об’єму відбувається процес розширення системи,
- при зміні температури відбувається процес нагрівання.
Якщо параметри системи змінюються нескінченно мало, так що система в кожний момент часу залишається в стані термодинамічної рівноваги, то такий процес називають рівноважним або квазістатичним.
Як можна уявити собі такий процес. Візьмемо газ в циліндр із поршнем. Зверху на поршні знаходяться піщинки. Почнемо убирати по одній піщинці. Оскільки маса окремої частинки нескінченно мала, в порівняні із масою повного навантаження, то через дуже маленький проміжок часу система перейде в нове положення термодинамічної рівноваги, яке мало відрізняться своїми параметрами від вихідного стану. Коли всі піщинки уберуть, об’єм газу зміниться на конечну величину, але перехід відбудеться через ряд рівноважних станів.
В термодинаміці рівноважні процеси посідають особливе місце. По-перше, для описання рівноважного процесу в момент часу необхідно стільки ж параметрів, скільки і для описання рівноважного стану. (Для нерівноважного процесу необхідна нескінчена кількість параметрів). По-друге, при цих процесах такі важливі величини, як робота, коефіцієнт корисної дії, мають свої граничні, максимально можливі значення.
На практиці рівноважні процеси не реалізуються ніколи. Але достатньо велика кількість процесів, що відбуваються із конечними швидкостями, розглядаються як рівноважні. Навіть поширення звукової хвилі наближено можна розглядати як квазістатичний процес.
Ми найчастіше будемо мати справи із наступними процесами
·  – ізохорним,
– ізохорним,
·  – ізобарним,
– ізобарним,
· 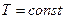 – ізотермічним.
– ізотермічним.
Кожний з них можна зобрази на діаграмах стану неперервною лінією.
Енергія, робота, теплота
В механіці ви познайомились із поняттям енергія тіла і з законом збереження механічної енергії. Тепер ми розширено дане поняття. Нехай система складається із величезної кількості частинок. Енергію цих частинок, що неперервно рухаються і взаємодіють одна з одною, і називають енергією системи. Повну енергію ділять на внутрішню і зовнішню.
Зовнішня енергія – являє собою суму енергії руху системи як цілою і потенційної енергії системи в полі зовнішніх сил. Інша частина енергії системи – внутрішня енергія.
В термодинаміці не розглядається рух системи як цілого, а отже маємо справу лише із внутрішньої енергією. Вона включає у себе енергію поступального і обертового руху молекул, енергію взаємодії молекул, енергію електронних рівнів і т.д.
В якості приклада розглянемо ідеальний газ. Його молекули не взаємодіють одна з одною і тому енергія частинки дорівнює кінетичній енергії поступального руху і рівна  . Якщо газ складається з
. Якщо газ складається з  молекул, то сумарна енергія
молекул, то сумарна енергія
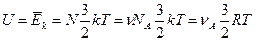
 А для одного моля ідеального газу внутрішня енергія
А для одного моля ідеального газу внутрішня енергія
 .
.
Як видно, внутрішня енергія ідеального газу залежить лише від  , і не залежить від а ні від
, і не залежить від а ні від  , а ні від
, а ні від  . Незалежність енергії газу від об’єму була експериментальна встановлена Джоулем і має місце лише для випадку ідеального газу. Якщо енергією взаємодії між молекулами не можна знехтувати (тобто
. Незалежність енергії газу від об’єму була експериментальна встановлена Джоулем і має місце лише для випадку ідеального газу. Якщо енергією взаємодії між молекулами не можна знехтувати (тобто  ), то, оскільки вона залежить від відстані між молекулами,
), то, оскільки вона залежить від відстані між молекулами,  .
.
Робота і теплота
Коли тіло взаємодіє із оточуючим середовищем, то відбувається обмін енергією. Він може проходити із зміною зовнішніх параметрів або без зміни зовнішніх параметрів.
Робота – спосіб передачі енергії системи із зміною її зовнішніх параметрів. Спосіб передачі енергії без зміни зовнішніх параметрів називається теплотою, а процес теплопередачі – теплообміном.
З молекулярно-кінетичного зору, теплота пов’язана із обміном енергії на молекулярному рівні, коли частинки більш нагрітого тіла під час зіткнень передають енергію частинкам менш нагрітого тіла.
Енергія, яка передається системі із зміною зовнішніх параметрів також називається роботою А. Енергія, яка передається системі без зміни зовнішніх параметрів, називається кількістю теплоти Q.
Теплота і робота як способи передачі енергії не еквівалентні. Як видно з означення, кількості теплоти Q безпосередньо може піти тільки на збільшення внутрішньої енергії. Робота А може піти на збільшення будь-якого виду енергії.
Якщо система не обмінюється з оточуючими тілами в формі теплоти, то вона називається адіабатно ізольованою або адіабатною.
Робота A і кількість теплоти Q не є видами енергії, хоча і мають розмірність останньої, вони характеризують лише процес енергообміну між системами. Робота A і кількість теплоти Q відрізняються від 0 лише при процесі.
Давайте знову розглянемо газ під поршнем і отримаємо вираз для елементарної роботи, яку виконує газ при квазістатичному розширені. Будемо вважати роботу пов’язану з розширенням газу, додатною величиною, а роботу зовнішніх сил над газом (пов’язану з його стискуванням) від’ємною.
 Сила тиску газу на поршень рівна
Сила тиску газу на поршень рівна  , де
, де  - площа поршня.
- площа поршня.
Якщо поршень зміститься на відстань  , то газ при цьому виконує роботу
, то газ при цьому виконує роботу
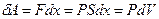 ,
,
Оскільки зміна об’єму  .
.
Цей вираз для елементарною роботи справедливий для будь-якої системи, яка знаходиться під тиском. Нехай газ знаходиться в еластичній оболонці і ця оболонка рівноважно розширюється. Роботу газу по переміщенню елементарної площадки 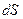 вздовж нормалі як і раніше
вздовж нормалі як і раніше
 ,
,
де  - елементарний об’єм.
- елементарний об’єм.
Щоб знайти елементарну роботу при переміщені всіх елементарних об’ємів, необхідно вираз  проінтегрувати по об’єму шара між двома близькими положеннями оболонки. Оскільки тиск постійний, то його можна винести за знак інтеграла
проінтегрувати по об’єму шара між двома близькими положеннями оболонки. Оскільки тиск постійний, то його можна винести за знак інтеграла
 .
.
У випадку, коли, крім об’єму змінюється також і інші параметри системи (електричні, магнітні тощо), треба враховувати і інші складові енергії (роботи) електричну, магнітну і т.д.

де  - робота, необхідна для намагнічування одиниці об’єму магнетика на
- робота, необхідна для намагнічування одиниці об’єму магнетика на  (для зміни індукції на
(для зміни індукції на 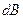 ).
).
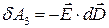
де  - робота, яку виконують над тілом у процесі зміни вектору електричного зміщення на величину
- робота, яку виконують над тілом у процесі зміни вектору електричного зміщення на величину 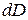 .
.
На прикладі розширення газу добре видно, що робота системи при нерівноважному процесі менша, ніж при переході за рівноважним шляхом
 .
.
 При нерівноважному розширені газу зовнішній тиск
При нерівноважному розширені газу зовнішній тиск  менший рівноважного тиску газу
менший рівноважного тиску газу  , тому
, тому  . При нерівноважному стиснені, навпаки, зовнішній тиск
. При нерівноважному стиснені, навпаки, зовнішній тиск  більше рівноважного, але оскільки робота в цьому випадку від’ємна, то
більше рівноважного, але оскільки робота в цьому випадку від’ємна, то  .
.
Якщо зміни параметрів, що характеризують стан тіла (газу), мають конечні значення, то

Чисельно робота дорівнює площі під графіком процесу на діаграмі 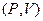 . Щоб обчислити роботу, треба знати залежність
. Щоб обчислити роботу, треба знати залежність 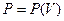 . Для будь-якого тіла у рівноважному стані існує зв’язок між параметрами системи
. Для будь-якого тіла у рівноважному стані існує зв’язок між параметрами системи  . Однак для складних систем це рівняння не завжди вдається записати в явному вигляді.
. Однак для складних систем це рівняння не завжди вдається записати в явному вигляді.
 Із стану 1 в стан 2 систему можна перевести різним шляхом. Відповідно робота також буде різною. Розглянемо випадок ідеального газу і розрахуємо роботу для двох випадків.
Із стану 1 в стан 2 систему можна перевести різним шляхом. Відповідно робота також буде різною. Розглянемо випадок ідеального газу і розрахуємо роботу для двох випадків.
1. Будемо потрошки зменшувати нагрузку поршня, щоб температура газу встигла вирівнятись і залишалась постійною. На діаграмі стану даний процес зображується гіперболою  . Тобто
. Тобто
 .
.
2. Не змінюючи навантаження поршня, підігріємо газ так, щоб об’єм його збільшився до  . При цьому газ виконає роботу
. При цьому газ виконає роботу  . Тепер закріпимо поршень і охолодимо його так, щоб тиск впав до
. Тепер закріпимо поршень і охолодимо його так, щоб тиск впав до 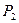 . Цей процес відбувається без виконання роботи. Отже система перейшла із стану 1 в стан 2, при цьому робота
. Цей процес відбувається без виконання роботи. Отже система перейшла із стану 1 в стан 2, при цьому робота
 .
.
Це дозволяє нам стверджувати, що робота не є функцією стану, а її приріст позначається  .
.
Нарешті, кількість теплоти  також залежить від того, яким способом ця теплота підводиться до тіла. Тобто кількість теплоти, як і робота, не є функцією стану тіла і залежить від способу переходу тіла з одного стану в інший. Тому нескінченно малий приріст енергії при теплопередачі позначається
також залежить від того, яким способом ця теплота підводиться до тіла. Тобто кількість теплоти, як і робота, не є функцією стану тіла і залежить від способу переходу тіла з одного стану в інший. Тому нескінченно малий приріст енергії при теплопередачі позначається  .
.
Перший закон термодинаміки
Хоч між поняттями роботи і теплоти існує суттєва різниця вони дуже близькі в тому сенсі, що виражають кількість енергії, що передається системі.
Досліді, виконані Джоулем, показали еквівалентність теплоти і роботи, тобто було доведено, що перетворення теплоти в роботу і роботу в теплоту здійснюється завжди лише в строго постійному співвідношенні.
Встановлення принципу еквівалентності було останнім етапом в формуванні кількісної сторони закону збереження і перетворення енергії, тому дата встановлення цього принципу пов’язується із датою відкриття першого закону термодинаміки.
Перший закон термодинаміки пов’язує між собою кількість теплоти, роботу і внутрішню енергію. Перший закон термодинаміки стверджує, що зміна внутрішньої енергії термодинамічної системи може бути здійснена двома шляхами
1) шляхом виконання роботи,
2) шляхом теплообміну
 В математичній формі це записується
В математичній формі це записується
 . (1)
. (1)
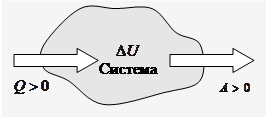 На рисунку умовно зображені енергетичні потоки між виділеною термодинамічною системою і навколишніми тілами. Величина
На рисунку умовно зображені енергетичні потоки між виділеною термодинамічною системою і навколишніми тілами. Величина  , якщо тепловий потік направлений убік термодинамічної системи. Величина
, якщо тепловий потік направлений убік термодинамічної системи. Величина  , якщо система здійснює роботу над навколишніми тілами.
, якщо система здійснює роботу над навколишніми тілами.
Цей закон є, по суті, закон збереження енергії в термодинаміці: збільшення внутрішньої енергії термодинамічної системи дорівнює сумі роботі зовнішніх сил над системою і енергії, переданій системі шляхом теплопередачі.
Закон (1) можна читати і так: Теплота, яку отримує система, йде на здійснення цією системою роботи  і зміну її внутрішньої енергії
і зміну її внутрішньої енергії 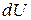 .
.
З (1) випливає:
1. Для теплоізольованої термодинамічної системи 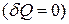
 , тобто робота виконується за рахунок внутрішньої енергії.
, тобто робота виконується за рахунок внутрішньої енергії.
Теплоізольованою або адіобатично ізольованою називається система, в якій зміни її стану можуть відбуватися тільки завдяки механічним переміщенням частин системи і її оболонок (навколишніх тіл) і не можуть відбуватися шляхом теплообміну з навколишніми тілами. Будь-яка зміна стану адіабатично ізольованої системи називають адіабатичним процесом, а оболонку навколо такої системи – адіабатичною оболонкою.
2. Якщо теплоізольована термодинамічна система 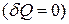 бере участь в круговому процесі
бере участь в круговому процесі  , то завжди
, то завжди  :
:
При відсутності взаємодії з навколишніми тілами неможливо провести процес, єдиним результатом якого було б отримання роботи.
Або інакше:
Вічний двигун (perpetuum mobile) першого роду неможливий. Тобто неможливо побудувати машину, яка б виконувала роботу без витрат зовнішньої енергії.
Дійсно, якщо до системи не підводиться кількість теплоти 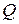 , то відповідно до (1) корисна робота А може бути здійснена тільки за рахунок зменшення внутрішньої енергії системи. А оскільки внутрішня енергія будь-якої системи обмежена, після вичерпання внутрішньої енергії здійснення системою корисної роботи припиниться, і двигун зупиниться.
, то відповідно до (1) корисна робота А може бути здійснена тільки за рахунок зменшення внутрішньої енергії системи. А оскільки внутрішня енергія будь-якої системи обмежена, після вичерпання внутрішньої енергії здійснення системою корисної роботи припиниться, і двигун зупиниться.
3. При  ,
,  , тобто вся теплота повністю перетворюється в роботу.
, тобто вся теплота повністю перетворюється в роботу.
Якщо зовнішня робота виконується лише за рахунок зміни одного параметру  , то перший закон термодинаміки матиме вигляд
, то перший закон термодинаміки матиме вигляд
 . (2)
. (2)
У більш загальних випадках, коли змінюються і інші параметри, перший закон термодинаміки має вигляд
 (3)
(3)
Формули (1)-(3) являють собою диференціальну форму запису першого закону термодинаміки.






