1. Рассчитайте, какую массу фенола С6Н5ОН следует растворить в 370 г диэтилового эфира (С2Н5)2О при постоянной температуре, чтобы понизить давление насыщенных паров растворителя от 90 кПа до 75 кПа.
Решение. Для решения этой задачи воспользуемся выражением первого закона Рауля  , где Р0 – давление насыщенных паров диэтилового эфира над чистым растворителем, равное 90 кПа; ΔР – разность давлений паров над растворителем и раствором, ΔР = 90 – 75 = 15 кПа; χ – молярная доля фенола в эфире, определяемая по уравнению
, где Р0 – давление насыщенных паров диэтилового эфира над чистым растворителем, равное 90 кПа; ΔР – разность давлений паров над растворителем и раствором, ΔР = 90 – 75 = 15 кПа; χ – молярная доля фенола в эфире, определяемая по уравнению 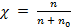 .
.
Определим вначале молярную долю фенола:  . Подставим найденное значение в уравнение для χ, преобразовав его относительно количества вещества фенола, и решим:
. Подставим найденное значение в уравнение для χ, преобразовав его относительно количества вещества фенола, и решим:
0,167n + 0,167n0 = n; n – 0,167n = 0,167n0 или 0,833n= 0,167n0 и окончательно n = 0,2n0.
В полученном выражении количества вещества фенола и эфира заменим их значениями через m и М и преобразуем уравнение относительно неизвестной массы растворенного в эфире фенола:  , откуда
, откуда
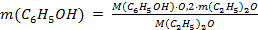 .
.
Подставим в найденное выражение физическую массу эфира и молярные массы фенола и эфира, предварительно рассчитав их, получим: М(С6Н5ОН) = 94 г/моль; М(С2Н5)2О = 74 г/моль;  .
.
Ответ: m(C6H5OH) = 94 г.
2. Определите температуру кипения 15 %-го водного раствора пропилового спирта С3Н7ОН.
Решение. Используем математическое выражение второго закона Рауля
ΔТкип = kЭ·Сm,
где ΔТкип = Ткип(р-ра) – Ткип(Н2О); Сm– моляльная концентрация раствора,

 .
.
Из условия задачи следует, что в 100 г раствора содержатся 15 г спирта и 85 г воды, молярная масса пропилового спирта М(С3Н7ОН) = 60 г/моль, тогда
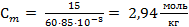 .
.
Теперь рассчитаем температуру кипения раствора, используя справочные данные для эбуллиоскопической постоянной воды Ткип(Н2О) = 373 К; kЭ (Н2О) = 0,520:
Ткип(р-ра) = kЭ·Сm + Ткип(Н2О) = (0,52·2,94) + 373 = 374,53 К.
Ответ: раствор кипит при температуре 374,53 К.
3. Массовые доли углерода, водорода и серы, входящих в состав неизвестного вещества, соответственно равны (%): 39,34; 8,20; 52,46. Раствор, содержащий 0,2 г этого вещества в 26 г бензола, кристаллизуется при температуре на 0,3180 ниже, чем чистый растворитель. Определите формулу неизвестного вещества.
Решение. Используем 2-й закон Рауля для расчета молярной массы неизвестного вещества:  , откуда
, откуда  .
.
Справочное значение kK(C6H6) = 5,120 и тогда
 .
.
На основании данных о составе вещества определим его простейшую формулу:
 ;
;  ;
;  . Отсюда nС ÷ nН ÷ nS = 3,28 ÷ 8,20 ÷ 1,64 = 2 ÷ 5 ÷ 1 и простейшая формула неизвестного вещества будет иметь вид С2Н5S.
. Отсюда nС ÷ nН ÷ nS = 3,28 ÷ 8,20 ÷ 1,64 = 2 ÷ 5 ÷ 1 и простейшая формула неизвестного вещества будет иметь вид С2Н5S.
Рассчитаем молярную массу простейшей формулы и сравним с найденным ранее значением М(в-ва): М(С2Н5S) = 12·2 + 5·1 + 32 = 61 г/моль и она в 2 раза меньше М(в-ва). Значит, в простейшей формуле все индексы необходимо удвоить, тогда получим истинную формулу вещества: С4Н10S2.
Ответ: формула неизвестного вещества С4Н10S2.
4. Определите, будут ли изотоничны водные растворы глюкозы и этилового спирта, если их массовые доли составляют 20% для глюкозы и 5% для спирта.
Решение. Изотоническими называются растворы с одинаковым значением осмотического давления, которое рассчитывается по закону Вант-Гоффа: π = СµRT, где π – осмотическое давление; Сµ –молярная концентрация раствора; Т – температура, R – универсальная газовая постоянная Ридберга (R = 8,31 Па·м3/моль·К).
Для расчета π(С6Н12О6) и π(С2Н5ОН) необходимо вначале определить их молярные концентрации по уравнениюСμ = m/(M·V), преобразованному с учетом пересчета концентрации растворов с массовой доли на Сμ: m = ω·V·ρ и тогда
Сμ =  =
=  .
.
Произведем расчеты по этому уравнению, зная, что М(С6Н12О6) = 180 г/моль, М(С2Н5ОН) = 46 г/моль, а плотности растворов при соответствующих массовых долях, согласно справочным данным, равны ρ(С6Н12О6) = 1,081 г/мл; ρ(С2Н5ОН) = 0,990 г/мл:
Сμ (р-ра С6Н12О6) =  = 1,20
= 1,20  ;
;
Сμ (р-ра С2Н5ОН)  .
.
Дальнейшие расчеты можно не проводить, т.к в выражении для осмотического давления сомножитель RT у обоих растворов одинаковый. Если
Сμ(р-ра С6Н12О6) > Сμ(р-ра С2Н5ОН), то и π(р-ра С6Н12О6) > π(р-ра С2Н5ОН), следовательно, растворы не изотоничны.
Ответ: растворы не изотоничны, π(р-ра С6Н12О6) > π(р-ра С2Н5ОН).
5. Определите, при какой температуре осмотическое давление раствора, содержащего 18,6 г анилина С6Н5NН2 в 3 л раствора, достигнет 2,84·105 Па.
Решение. Для расчета используем уравнение закона Вант-Гоффа, преобразовав его относительно температуры раствора:  .
.
Решим это уравнение, подставив в него значение М(С6Н5NН2) = 93 г/моль:
 .
.
Ответ: при температуре 512,6 К.






