САМОСТОЯТЕЛЬНАЯ РАБОТА № 4 по ХИМИИ
Раздел № 1. Обучающие задания с алгоритмами решения для закрепления темы «Теория растворов»
Пример 1. Расчеты концентрации растворов при различных способах
Её выражения
1. В электрохимических аккумуляторах в качестве электролита применяется 34%-й раствор серной кислоты (плотность раствора ρ = 1,255 г/мл). Рассчитайте объемы воды и купоросного масла (концентрированной 94%-й  , ρ = 1,840 г/мл), необходимые для приготовления 2 л такого электролита.
, ρ = 1,840 г/мл), необходимые для приготовления 2 л такого электролита.
Решение. Сначала определим массу серной кислоты, содержащуюся в 2 л 34%-го раствора, используя формулу  . Преобразуем это выражение относительно m и рассчитаем массу серной кислоты:
. Преобразуем это выражение относительно m и рассчитаем массу серной кислоты:
 ;
; 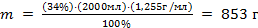 .
.
Теперь определим, в каком объеме купоросного масла содержится 853 г  , предварительно преобразовав формулу относительно объема
, предварительно преобразовав формулу относительно объема  :
:
 ;
;  .
.
Ошибкой было бы предположить, что объем воды будет определяться как разность между объемом раствора (2 л) и объемом купоросного масла (493 мл). Хорошо известно, что серная кислота является сильным электролитом, взаимодействующим с растворителем, а потому объемы при смешении не суммируются. Для определения объема воды вычислим вначале массы раствора аккумуляторной кислоты и купоросного масла:
 ;
;  ;
;
 .
.
Теперь вычислим массу воды, необходимую для приготовления раствора:
 . Зная, что плотность химически чистой воды
. Зная, что плотность химически чистой воды  , определим объем воды:
, определим объем воды:
 ;
;  .
.
Ответ:  .
.
2. К 0,8 л раствора натрия гидроксида (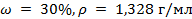 ) прибавлено 0,4 л раствора этого же вещества, массовая доля
) прибавлено 0,4 л раствора этого же вещества, массовая доля 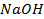 в котором равна 14% (
в котором равна 14% (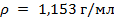 ). Определите плотность полученного раствора и массовую долю
). Определите плотность полученного раствора и массовую долю 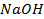 в нём.
в нём.
Решение. Первый способ. Для определения массовой доли и плотности раствора, полученного после смешивания, необходимо рассчитать его массу, а также массу растворенного вещества. Масса первого раствора  будет равна:
будет равна:
 .
.
В этом количестве раствора содержится гидроксида натрия:
 .
.
Масса второго раствора  равна:
равна:
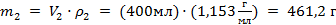 .
.
В этом растворе содержится гидроксида натрия:
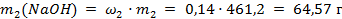 .
.
Масса раствора после смешения
 .
.
В этом растворе содержится растворённого вещества:
 .
.
Теперь легко определить массовую долю 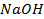 в полученном растворе:
в полученном растворе:
 .
.
Плотность раствора рассчитывается как частное от деления его массы на объем, равный условно  :
:
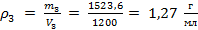 .
.
Второй способ. Задачи такого типа (на смешивание растворов с разной массовой долей растворенного вещества) легко решаются с помощью диагональной схемы или «правила креста»: слева одно под другим записывают значения исходных концентраций смешиваемых растворов. От них проводят диагональные отрезки и в точке их пересечения записывают значение концентрации раствора, получаемого после смешивания, а у других концов отрезков – разности между значениями концентраций смеси и её компонентов, учитывая то, что эти величины должны оставаться положительными (т.е. от большего значения необходимо отнимать меньшее). Неизвестные значения при этом обозначаем буквой «x».
Диагональная схема на примере данной задачи выглядит так:
30 x -14
x
1430 - x
Схема читается следующим образом: массы смешиваемых растворов  и
и 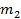 обратно пропорциональны разностям концентраций смеси и компонентов, т.е.
обратно пропорциональны разностям концентраций смеси и компонентов, т.е.
 .
.
Решим эту пропорцию относительно x, помня, что  и
и  , т.е.
, т.е.
 ;
;  ;
;  ;
;  . Мы получили значение концентрации раствора после смешивания –
. Мы получили значение концентрации раствора после смешивания –  .
.
Плотность раствора, как и в предыдущем способе, определяется по формуле:
 ;
;  .
.
Ответ: массовая доля полученного раствора 25 %, его плотность 1,27 г/мл.
3. Определите массу кристаллогидрата K2CO3·5H2O, необходимого для приготовления 0,25 л 0,03 н. раствора. Рассчитайте молярность этого раствора.
Решение. Молярная концентрация эквивалента раствора прямо пропорциональна количеству вещества эквивалентов:  (моль/л), где B – суммарная валентность ионов металла соли. Преобразуем это выражение относительно количества растворенного вещества n и произведем расчеты:
(моль/л), где B – суммарная валентность ионов металла соли. Преобразуем это выражение относительно количества растворенного вещества n и произведем расчеты:
 ;
;  моль.
моль.
Масса кристаллогидрата определяется по формуле  , где М – молярная масса K2CO3·5H2O (М = 2·39 + 12 + 3·16 + 5·18 = 228 г/моль):
, где М – молярная масса K2CO3·5H2O (М = 2·39 + 12 + 3·16 + 5·18 = 228 г/моль):
m = 228(г/моль)·3,75·10-3(моль) = 0,855 г.
Для определения молярности раствора используем формулу:  , следовательно,
, следовательно,
 .
.
Ответ: m(K2CO3·5H2O) = 0,855 г, Сμ = 0,015 моль/л.
4. Вычислите массовую долю, молярность, моляльность, молярную концентрацию эквивалента, молярную долю и титр раствора свинца (2) нитрата, если к 100 мл его 30 %-го раствора добавили 200 мл воды и получили раствор с плотностью 1,109 г/мл.
Решение. Сначала определим массовую долю растворенного вещества после разбавления раствора водой, используя «правило креста»:
30 x
x
0 30 - x.
Отсюда  , далее
, далее  .
.
Для решения полученного уравнения относительно x вспомним, что плотность жидкой воды в широком интервале температур постоянна и равна  , а по справочной таблице найдем плотность 30 %-го раствора свинца (2) нитрата
, а по справочной таблице найдем плотность 30 %-го раствора свинца (2) нитрата 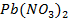 : ρ1 = 1,328 г/мл. Подставим эти значения в полученное уравнение и решим его:
: ρ1 = 1,328 г/мл. Подставим эти значения в полученное уравнение и решим его:
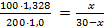 ; 0,664(30- x) = x; x = 11,97 ≈ 12.
; 0,664(30- x) = x; x = 11,97 ≈ 12.
Таким образом, после разбавления массовая доля раствора свинца нитрата ω2 = 12 %.
Масса растворенного вещества в разбавленном растворе осталась такой же, как и в исходном растворе Pb(NO3)2, тогда m(Pb(NO3)2) = ω1·V1·ρ1 = 0,30·100·1,328 = 39,84 г.
Зная по условию задачи плотность второго раствора, полученного после разбавления, определим его объем:
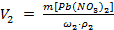 ;
;  .
.
Рассчитанной нами массе соли соответствует количество вещества:
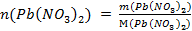 ;
;  .
.
Теперь легко определить молярность и нормальность (молярную концентрацию эквивалента) раствора:
 ; СN = Сμ·B = 0,4·2 = 0,8
; СN = Сμ·B = 0,4·2 = 0,8  .
.
Для определения моляльности необходимо предварительно рассчитать  :
:
 ;
;
 .
.
Рассчитаем моляльность раствора:
 ;
;  .
.
Для определения молярной доли растворенной солиχ(Pb(NO3)2) по формуле
 необходимо предварительно рассчитать количество вещества воды:
необходимо предварительно рассчитать количество вещества воды:
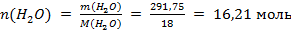 ; и тогда
; и тогда  ;
;
 или
или  .
.
И, наконец, титр раствора рассчитываем по формуле: 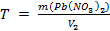 ,
,
 .
.
Ответ: ω = 12%; Сμ = 0,4 моль/л; СN = 0,8 моль/л; Сm = 0,41 моль/кг; χ = 0,7%; Т = 0,133 г/мл.
5. Для осаждения в виде BaSO4 всего бария, содержащегося в 100 мл раствора бария хлорида, потребовалось 50 мл 0,1 н. раствора серной кислоты. Определите молярную концентрацию раствора бария хлорида и массу выпавшего в осадок бария сульфата.
Решение. В любой химической реакции вещества взаимодействуют между собой в количествах, пропорциональных их эквивалентам. Значит, для реакции
BaCl2 + H2SO4 = BaSO4↓ + HCl
справедливо равенство nЭ(BaCl2) = nЭ(H2SO4) = nЭ(BaSO4). А поскольку nЭ = СN·V, то можно записать и закон эквивалентов для взаимодействующих растворов:
СN(BaCl2)·V(BaCl2) = CN(H2SO4)·V(H2SO4).
Преобразуем это уравнение относительно неизвестной молярной концентрации эквивалента бария хлорида и решим его:
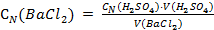 ;
;  .
.
Молярная и нормальная концентрации связаны соотношением СN = Сμ·B, откуда  и значит,
и значит,  .
.
Количество вещества бария сульфата в осадке равно количеству вещества бария хлорида, вступившего в реакцию, следовательно, в осадок выпало
n(BaSO4) = n(BaCl2) = Сμ(BaCl2)·V(BaCl2) = 0,025·0,01 = 2,5·10-4 (моль).
Теперь легко рассчитать массу осадка, зная, что молярная масса бария сульфата M(BaSO4) = 137 + 32 + 4·16 = 233 г/моль:
m(BaSO4) = n(BaSO4)·M(BaSO4) = 2,5·10-4·233 = 0,058 г.
Ответ: СN(BaCl2) = 0,05 моль/л; Сμ(BaCl2) = 0,025 моль/л; m(BaSO4) = 0,058 г.
Пример 2. Определение растворимости и энергетики процесса растворения
1. Растворимость кальция хлорида в воде при 100 0С равна 159 г на 100 мл воды. Определите массовую долю и массу соли, содержащейся при указанной температуре в 1,35 кг раствора.
Решение. Растворимость вещества (чаще её называют коэффициентом растворимости) определяется по формуле 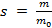 при m0 = 100 г.
при m0 = 100 г.
Поскольку масса 100 мл воды равна 100 г (ρН2О = 1,00 г/мл) и, согласно условию задачи, 159 г СаСl2 содержатся в (159 + 100) = 259 г раствора, то искомая масса соли
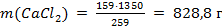 .
.
Массовая доля растворенного вещества в состоянии насыщения при 100 0С определится по уравнению:

Ответ: m(CaCl2) = 828,8 г; ω(СаСl2) = 61,4%.
2. Растворимость аммония хлорида при 90 0С равна 70 г на 100 г воды, а при 50 0С – 50 г на 100 г Н2О. Определите массу выпавшего в осадок NH4Cl при охлаждении 1 кг насыщенного при 90 0С раствора до 50 0С, ирассчитайте моляльностьохлажденного раствора.
Решение. Зная растворимость NH4Cl при температурах 90 0С и 50 0С, определим массу раствора соли при разных температурах:
а) при 90 0C m1 = 70 + 100 = 170 г; б) при 50 0С m2 = 50 + 100 = 150 г. При охлаждении 170 г раствора хлорида аммония в осадок выпадает 170 – 150 = 20 г NH4Cl. А если охладить 1000 г раствора, то в осадок выпадет  .
.
Масса соли в горячем насыщенном растворе  ,
,
после охлаждения раствора она уменьшилась на величину осадка и стала равной
m2(NH4Cl) = m1(NH4Cl) - m(NH4Cl) = 411,8 – 117,6 = 294,2 г.
Следовательно, масса растворителя после охлаждения составила
 .
.
Теперь не трудно рассчитать моляльность полученного после охлаждения раствора, зная, что молярная масса аммония хлорида М(NH4Cl) = 14 + 4 + 35,5 = 53,5 г/моль:
 .
.
Ответ: при охлаждении в осадок выпало 117,6 г. аммония хлорида, моляльность охлажденного раствора составила 9,35  .
.
3. Растворимость газообразного хлора при 10 0С и давлении 1,01·105 Па составляет 3,148 м3 в 1м3 воды. Определите, в каком объеме воды при этой же температуре и давлении 1,5·105 Па растворится 250 г хлора. Рассчитайте массовую долю хлора в растворе.
Решение. Определяем массу газообразного хлора в насыщенном растворе при нормальном давлении и температуре 10 0С, используя уравнение Менделеева-Клапейрона:
 , откуда
, откуда 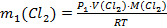 ;
;  .
.
Согласно закону Генри-Дальтона,при изотермическом процессе масса газа, растворенного в данном объеме жидкости, пропорциональна давлению этого газа на жидкость. Применительно к нашей задаче этот закон выглядит следующим образом:
 .
.
И тогда масса хлора в насыщенном растворе при новом давлении Р2 будет равна:
 .
.
Объем воды, в которой растворилось 250 г хлора при давлении Р2, определим, используя пропорцию:
1000 л Н2О - 14248 г Cl2
x л Н2О - 250 г Сl2 и тогда 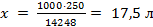 .
.
Принимая массу 1000 л воды за 1000 кг, находим, что в (1000 + 14,248) кг раствора содержится 14,248 кг Cl2. Тогда в 100 кг раствора будет содержаться:
 .
.
Следовательно, массовая доля растворенного газа составляет 1,4%.
Ответ: 250 г хлора растворяется в объеме 17,5 л воды, массовая доля растворенного вещества ω(Cl2) = 1,4%.
4. Энтальпия растворения натрия карбоната в воде равна 25,6 кДж/моль. Определите, на какую величину повысится температура раствора, если в 250 мл воды растворить 6 г Na2CO3. Удельную теплоёмкость раствора принять равной 4,174  /.
/.
Решение. Между энтальпией растворения ΔН0раств, удельной теплоёмкостью раствора L, и температурным эффектом растворения ΔТ существует зависимость, которую применительно к условиям нашей задачи можно записать так:
 .
.
Преобразуем это уравнение относительно ΔT и решим его, зная, что 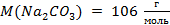 :
:  ; и
; и  .
.
Ответ: температура раствора увеличится при растворении на 1,38 0.
5. При растворении 4,0 г меди (2) сульфата в 0,2 л воды температура повысилась на 20. Вычислите теплоту гидратации CuSO4, если энтальпия растворения CuSO4·5H2O равна -11,72 кДж/моль, а удельная теплоёмкость раствора равна 4,18 Дж/г·К.
Решение. Тепловые эффекты процессов растворения безводной соли CuSO4 и кристаллогидрата CuSO4·5H2O будут отличаться между собой на теплоту гидратации:
СuSO4 + aq → CuSO4(aq) + ΔH0раств; ΔН01 = ΔH0раств + ΔH0гидр.
CuSO4(aq) + 5H2O = CuSO4·5H2O(aq) + ΔH0гидр.
При растворении кристаллогидрата идёт только один процесс:
CuSO4·5H2O + aq → CuSO4·5H2O(aq) + ΔH0раств; и ΔН02 = ΔH0раств.
Сравним эти два процесса:
ΔН0гидр(CuSO4) = ΔН0раств(CuSO4) – ΔН0раств(CuSO4·5H2O).
Энтальпию растворения безводной соли рассчитаем, как и в предыдущей задаче, помня, что MСuSO4 = 64 + 32 + 4·16 = 160 г/моль:

 .
. 
Теперь определим теплоту гидратации:
 66,88 – (-11,72) = 78,60 кДж/моль.
66,88 – (-11,72) = 78,60 кДж/моль.
‘
=нгош235466///6Ответ: теплота гидратации сульфата меди равна 78,60 кДж/моль.






