ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
Электрохимия представляет собой область химии, которая изучает реакции, протекающие с подводом и отводом электрической энергии; такие процессы называются электрохимическими. При электрохимических реакциях происходит превращение химической энергии в электрическую и, наоборот, электрической энергии в химическую.
Для проведения электрохимической реакции необходима электрохимическая цепь, существенными элементами которой являются электроды. Рассмотрим простейший электрод, представляющий собой металлическую пластинку, опущенную в раствор соли этого же металла, например, цинковая пластинка, опущенная в раствор ZnSO4.
При погружении цинка в водный раствор его соли под действием молекул воды часть ионов металла переходит с поверхности пластинки в раствор:
Zn – 2e– = Zn2+
При этом металлическая пластинка заряжается отрицательно, так как электроны, образовавшиеся в процессе перехода металла в раствор, осаждаются на поверхности металла, поскольку раствор не обладает электронной проводимостью. Гидратированные ионы металла притягиваются к отрицательно заряженной пластинке, образуя на границе металл – раствор двойной электрический слой.
Количественной характеристикой этого процесса является электродный потенциал Е – потенциал, возникающий на границе раздела двух фаз (металла и водного раствора электролита). Абсолютное значение электродного потенциала экспериментально определить невозможно. Можно определить только разность потенциалов между двумя электродами, одним из которых является электрод сравнения. В качестве электрода сравнения, по отношению к которому определяют потенциалы других электродов, принят стандартный водородный электрод.
Стандартный водородный электрод

Стандартный водородный электрод представляет собой стеклянный сосуд, в котором находится платиновая пластинка, покрытая черненой платиной (рыхлой пористой платиной с большой поверхностью для сорбции газообразного водорода). Сосуд заполняется раствором серной кислоты с концентрацией ионов водорода 1 моль/л. Через сосуд пропускают очищенный газообразный водород под давлением 1 атм при температуре 298 К. На границе платины и раствора серной кислоты устанавливается равновесие между ионами водорода в растворе и газообразным водородом, адсорбированным платиной:
{Н+}aq + e– = ½(Н2)
Стандартный электродный потенциал такого электрода принят равным нулю:
 В.
В.
Электродные потенциалы металлов, измеренные по отношению к стандартному водородному электроду при стандартных условиях (концентрация ионов металла 1 моль/л, Т = 298 К, р = 1 атм), называются стандартным электродным потенциалом:
Еоox/red
Величины стандартных электронных потенциалов располагают в ряд по мере их увеличения и называют электрохимическим рядом напряжений металлов:

Ряд напряжений характеризует следующие химические свойства металлов:
- чем отрицательнее значение стандартного электродного потенциала (чем левее расположен металл в ряду напряжений), тем сильнее его восстановительная способность и тем слабее окислительная способность его иона в растворе;
- каждый металл способен вытеснять из растворов солей те металлы, которые стоят в ряду напряжений правее его;
- металлы, стоящие в ряду напряжений левее водорода, способны вытеснять его из растворов кислот (кроме азотной кислоты).
Уравнение Нернста
Величина электродного потенциала зависит от природы электрода, концентрации электролита и температуры. Эта зависимость выражается уравнением Нернста, которое для простых полуреакций:

имеет вид
 ,
,
где  – электродный потенциал полуреакции, В;
– электродный потенциал полуреакции, В;  – стандартный электродный потенциал полуреакции, В; R – универсальная газовая постоянная, равная 8,31 Дж/(моль × К); T – абсолютная температура, К; F – постоянная Фарадея, равная 96 484 Кл/моль; z – число электронов, участвующих в электродном процессе;
– стандартный электродный потенциал полуреакции, В; R – универсальная газовая постоянная, равная 8,31 Дж/(моль × К); T – абсолютная температура, К; F – постоянная Фарадея, равная 96 484 Кл/моль; z – число электронов, участвующих в электродном процессе;  – концентрация (активность) ионов металла в растворе, моль/л.
– концентрация (активность) ионов металла в растворе, моль/л.
При стандартной температуре 298 К после подстановки в уравнение постоянных и после перехода от натурального логарифма к десятичному уравнение Нернста примет следующий вид:
 .
.
Значения стандартных электродных потенциалов для полуреакций относительно стандартного водородного электрода приводятся в справочных таблицах.
По значениям стандартных электродных потенциалов полуреакций можно сравнивать окислительно-восстановительные свойства веществ, составляющих полуреакцию. Чем меньше E 0, тем сильнее выражены восстановительные свойства вещества, а чем больше E 0, тем сильнее выражены окислительные свойства вещества.
Пример. Рассчитайте потенциал серебряного электрода, опущенного в насыщенный раствор хлорида серебра.
Решение. Потенциал серебряного электрода, на котором устанавливается электродное равновесие

находим по уравнению Нернста. Для серебряного электрода уравнение Нернста будет иметь следующий вид:
 .
.
В насыщенном растворе хлорида серебра устанавливается равновесие между осадком и ионами в растворе:

Записываем выражение для произведения растворимости AgCl:
 .
.
Концентрация ионов серебра в насыщенном растворе равна концентрации ионов хлора:
 .
.
Тогда из выражения для ПР находим концентрацию ионов серебра:
 ,
,
 моль/л.
моль/л.
Значение стандартного электродного потенциала берем из справочника и вычисляем значение потенциала:
 В.
В.
Гальванические элементы
Устройства, которые обеспечивают превращение энергия химической реакции в электрическую работу, называются гальваническими элементами. Они должны иметь в своем составе два электрода – металлы, погруженные в растворы электролитов, которые содержат соответственно окислитель и восстановитель. Растворы должны сообщаться друг с другом пористой перегородкой, которая обеспечивает прохождение через электролиты электрического тока и препятствует непосредственному взаимодействию окислителя и восстановителя.
Электрод, находящийся в контакте с окислителем и на котором происходит процесс восстановления, называется катодом, а электрод, находящийся в контакте с восстановителем и на котором происходит процесс окисления, называется анодом. Электроны во внешней цепи будут двигаться от анода к катоду. Поэтому в гальваническом элементе анод будет иметь отрицательный потенциал или «–», а катод – положительный потенциал или «+». Разность потенциалов катода E к и анода E а называется электродвижущей силой (ЭДС) гальванического элемента:
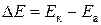 .
.
Рассмотрим гальванический элемент, состоящий из цинкового и медного электродов (элемент Даниэля – Якоби).
Гальванический элемент
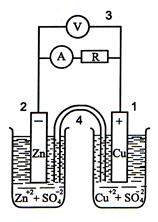
Поскольку самопроизвольно электроны могут переходить только от электрода с большей концентрацией электронов к электроду с меньшей концентрацией, то в процессе действия рассматриваемого гальванического элемента электроны во внешней цепи движутся от цинка к меди. На цинковом электроде происходит процесс окисления. Медь в данном случае играет роль инертного электрода, который передает электроны, поступившие от цинка, ионам меди, находящимся в растворе сульфата меди. Таким образом, на медном электроде происходит восстановление катионов меди.
Во внутренней цепи сульфат-ионы, оказавшиеся в избытке в катодном пространстве, переходят через пористую перегородку или через солевой мостик в анодное пространство, где компенсируют заряды образовавшихся при окислении ионов цинка.
В основе работы данного гальванического элемента лежит реакция:
Zn + CuSO4 = Cu + ZnSO4
Элемент будет работать до тех пор, пока цинковый анод полностью не раствориться или не восстановиться вся медь из раствора сульфата меди.
Zn – 2e– = Zn2+ - процесс окисления на аноде
Cu2+ + 2e– = Cu - процесс восстановления на катоде
Zn + Cu2+ = Zn2+ + Cu - суммарная реакция
При схематическом изображении гальванического элемента граница раздела между металлом и раствором электролита изображается вертикальной чертой, а граница между растворами электролитов – двойной вертикальной чертой. Например, схема гальванического элемента, в основе работы которого лежит реакция

изображается следующим образом:

Эта же схема может быть изображена в ионной форме:

Знаки «–» и «+» электродов и, соответственно, анод и катод находим из сравнения стандартных электродных потенциалов:

Стандартный потенциал цинка много меньше, чем серебра, поэтому цинковый электрод будет иметь знак «–» и будет анодом, на котором идет полуреакция окисления металлического цинка:

а серебряный электрод будет иметь знак «+» и будет катодом, на котором идет полуреакция восстановления ионов серебра:

Иногда на схеме указывают концентрацию электролитов в растворе:

Для реакции

схема гальванического элемента будет иметь следующий вид:
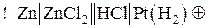
где Pt(H2) обозначает водородный электрод, состоящий из инертного металла Pt, выполняющего здесь роль катода, на котором идет полуреакция восстановления катионов водорода:

На аноде протекает полуреакция окисления цинка

Эта же схема элемента в ионной форме будет иметь следующий вид:

Пример. Гальванический элемент состоит из металлического цинка, погруженного в 0,1 н. раствор нитрата цинка, и металлического свинца, погруженного в 0,02 М раствор нитрата свинца. Вычислите ЭДС элемента, напишите уравнения электродных процессов, составьте схему элемента.
Дано:
 моль/л
С (Pb(NO3)2) = 0,02 моль/л моль/л
С (Pb(NO3)2) = 0,02 моль/л
| Решение. Чтобы определить, какой из электродов будет катодом, а какой – анодом, рассчитаем и сравним электродные потенциалы цинкового и свинцового электродов. Расчет проведем по уравнению Нернста. |
| D E –? |
Вычисляем электродный потенциал цинкового электрода. На цинковом электроде устанавливается электродное равновесие

Уравнение Нернста для цинкового электрода будет иметь вид:
 .
.
Находим концентрацию ионов цинка в растворе:
 (a = 1, сильный электролит)
(a = 1, сильный электролит)

Рассчитываем потенциал цинкового электрода:
 В.
В.
Вычисляем электродный потенциал свинцового электрода:

 .
.
 (a = 1, сильный электролит)
(a = 1, сильный электролит)
 моль/л.
моль/л.
Находим потенциал свинцового электрода:
 В.
В.
Сравниваем электродные потенциалы цинкового и свинцового электродов:
 .
.
Значит, цинковый электрод будет иметь знак «–» и будет анодом, на котором идет полуреакция окисления металлического цинка:

а свинцовый электрод будет иметь знак «+» и будет катодом, на котором идет процесс восстановления ионов свинца:

Схема гальванического элемента будет иметь следующий вид:

ЭДС элемента равна:
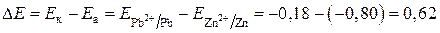 В.
В.






