Кожина Ольга Владимировна
Самарцев Виктор Николаевич
БИОХИМИЯ
Малый практикум
учебно-методическое пособие
ВВЕДЕНИЕ
Биохимия – наука о химическом строении и функциях веществ, входящих в состав живой материи, и их превращениях в процессах жизнедеятельности. Биохимия изучает различные структуры, свойственные живым организмам, и химические реакции, протекающие на клеточном и организменном уровнях. Биохимия изучает процессы, лежащие в основе обмена веществ.
В биохимии выделяют два раздела:
1. СТАТИЧЕСКАЯ биохимия – изучает состав живых организмов.
2. ДИНАМИЧЕСКАЯ биохимия – изучает обмен веществ.
Статическая биохимия выявила характерную черту живых клеток – их сложность и высокий уровень молекулярной организации, переход от более простых компонентов клетки к более сложным. Структурную организацию живой клетки можно представить в виде следующей схемы: неорганические вещества (H2O, N2, CO2, O2, P, S) → мономеры (нуклеотиды, аминокислоты, моносахариды, жирные кислоты, глицерин) → макромолекулы (нуклеиновые кислоты, белки, полисахариды, липиды) → сложные макромолекулы (нуклеопротеины, гликопротеины, липопротеины) → комплексы (рибосомы, ядрышко, мембраны, сократительные системы) → органеллы (ядро, митохондрии, лизосомы) → клетка.
Переход от простых биомолекул к сложным биологическим структурам основывается на физико-химических принципах самоорганизации.
Задачей динамической биохимии является изучение обмена веществ, или метаболизма клетки. Обмен веществ – это совокупность двух диаметрально противоположных, но гармонически сочетающихся процессов – синтеза (анаболизма) и распада (катаболизма) веществ. Обмен веществ в клетке не отделим от обмена энергии, т.к. синтез веществ невозможен без затраты энергии.
Другой чертой обмена веществ является тонкое регулирование скорости протекания отдельных химических реакций. Важную роль в регулировании процессов метаболизма играют биологические катализаторы – ферменты. Регуляция клеточного метаболизма может осуществляться либо путем активации или подавления действия ферментов, либо за счет изменения скорости их биосинтеза в клетке.
Раздел 1. БЕЛКИ
Тема 1
АМИНОКИСЛОТНЫЙ СОСТАВ БЕЛКА. КЛАССИФИКАЦИЯ И СВОЙСТВА АМИНОКИСЛОТ. КАЧЕСТВЕННЫЕ РЕАКЦИИ НА БЕЛКИ И АМИНОКИСЛОТЫ
Белок – высокомолекулярное азотистое природное соединение, распадающееся в ходе гидролиза на аминокислоты.
Белки содержат углерода - 50-55 %, водорода - 6,5-7,3 %, азота - 15-18 %, кислорода - 21-24 %, серы - до 2,4 % и золы - до 0,5 %.
Для построения всех белков используется один и тот же набор из 20 различных аминокислот, ковалентно связанных друг с другом в определенной, характерной только для данного белка последовательности.
Общей структурной особенностью аминокислот является наличие карбоксильной и аминогруппы, связанных с одним и тем же атомом углерода. Различаются аминокислоты боковыми цепями (R-группами), которые у разных аминокислот неодинаковы по структуре, электрическому заряду и растворимости в воде. Карбоксильные и аминогруппы аминокислот участвуют в образовании пептидных связей.
Помимо 20 стандартных, основных или нормальных аминокислот, входящих в состав белков, существуют другие аминокислоты, присутствующие в живых организмах, но не встречающиеся в белках.
Стандартные аминокислоты имеют трехбуквенные и однобуквенные условные обозначения (таблица 1).
Таблица 1
Сокращенные обозначения аминокислот
| № | Аминокислота | Трехбуквенное сокращенное обозначение | Однобуквенное обозначение | |
| Аланин | ала | Ala | A | |
| Аргинин | арг | Arg | R | |
| Аспарагин | асн | Asn | N | |
| Аспарагиновая кислота | асп | Asp | D | |
| Валин | вал | Val | V | |
| Гистидин | гис | His | H | |
| Глицин | гли | Gly | G | |
| Глутамин | глн | Gln | Q | |
| Глутаминовая кислота | глу | Glu | E | |
| Изолейцин | иле | Ile | I | |
| Лейцин | лей | Leu | L | |
| Лизин | лиз | Lys | K | |
| Метионин | мет | Met | M | |
| Пролин | про | Pro | P | |
| Серин | сер | Ser | S | |
| Тирозин | тир | Tyr | Y | |
| Треонин | тре | Thr | T | |
| Триптофан | три | Trp | W | |
| Фенилаланин | фен | Phe | F | |
| Цинтеин | цис | Cys | C |
Протеиногенные аминокислоты делят на 4 группы по полярности радикалов: 1) неполярные (гидрофобные) (рисунок 1);2) полярные (гидрофильные) незаряженные (рисунок 2);3) отрицательно заряженные (рисунок 3);4) положительно заряженные (рисунок 4).
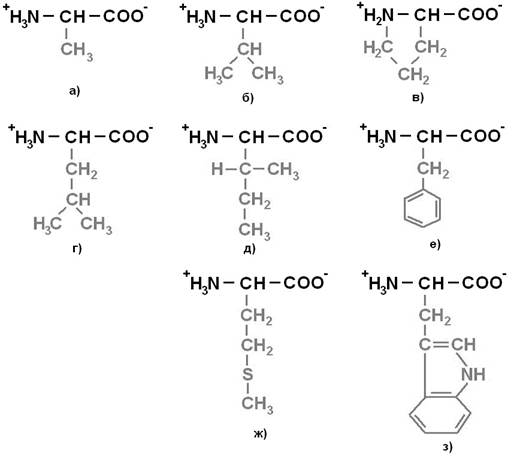
Рисунок 1. Неполярные (гидрофобные) аминокислоты: а) Аланин (Ala) – Ала; б) Валин (Val) – Вал; в) Пролин (Pro) – Про; г) Лейцин (Leu) – Лей; д) Изолейцин (Ile) – Иле; е) Фенилаланин (Phe) – Фен; ж) Метионин (Met) – Мет; з) Триптофан (Trp) – Три.

Рисунок 2. Незаряженные полярные аминокислоты: а) Глицин (Gly)- Гли; б) Серин (Ser) – Сер; в) Треонин (Thr) – Тре; г) Тирозин (Tyr) – Тир; д) Аспарагин (Asn) – Асн; е) Глутамин (Gln) – Глн; ж) Цистеин (Cys) - Цис
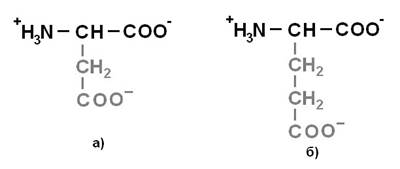
Рисунок 3. Отрицательно заряженные аминокислоты: а) Аспарагиновая кислота (Asp) – Асп; б) Глутаминовая кислота (Glu) – Глу.

Рисунок 4. Положительно заряженные аминокислоты: а) Лизин (Lys) – Лиз; б) Аргинин (Arg) – Арг; г) Гистидин (His) – Гис.
Радикалы аминокислот участвуют в образовании связей: 1) гидрофобные радикалы участвуют в гидрофобных взаимодействиях; 2) гидрофильные радикалы формируют водородные связи; 3) полярные (заряженные) радикалы образуют ионные связи; 4) сближение двух радикалов цистеина цис-SH + цис-SH ведет к образованию дисульфидной связи цис-S–S-цис.
Лабораторная работа №1






