Описание химической связи между атомами в соединении есть по су-ществу описание распределения электронной плотности. По характеру этого распределения химические связи традиционно подразделяют на ковалентные, ионные и металлические. Дополнительно рассматривают водородную связь и силы межмолекулярного взаимодействия.
Химическая связь – это повышение электронной плотности между ядрами атомов, сопровождаемое повышением энергии. Причина образования связи – выделившаяся энергия (ее в первом приближении называют энергией связи). Общие электроны располагаются на молекулярной орбитали, образу-ющейся в результате перекрывания исходных атомных орбиталей при сближении атомов по двум механизмам: обменному – в результате спари-вания двух непарных электронов разных атомов; донорно-акцепторному – за счет электронной пары одного атома (донор) и свободной орбитали другого атома (акцептор). При максимальной передаче электронной пары одному из атомов образуются ионы (катион и анион), между которыми осуществляется электростатическое притяжение и реализуется ионная связь. Если пара в равной степени принадлежит двум атомам, то между ними реализуется кова-лентная неполярная связь, а если пара несколько сдвинута в сторону наи-более электроотрицательного атома – то ковалентная полярная.
В зависимости от характера перекрывания орбиталей возможно образо-вание s- и p-связей: s-связь при перекрывании симметричных относительно линии связи атомных орбиталей; p-связь – при перекрывании по обе стороны от линии, связывающей ядра.
Длина связи – расстояние между ядрами двух атомов, если связь кова-лентная, или ионных радиусов, если связь ионная. Ковалентные радиусы зависят от кратности связи - число s- и p-связей между атомами. Ионные радиусы зависят от координационного числа – число s-связей центрального атома.
Валентность – общее число связей атома с другими атомами в моле-куле. Ковалентность – число связей, образованных по обменному механизму.
Ионная связь – результат электростатического взаимодействия проти-воположно заряженных ионов, обладающих обособленными друг от друга электронными оболочками. Ионная связь образуется между атомами, заметно отличающимися по электроотрицательности (Dc ³ 1,9 эВ). Относительная электроотрицательность ( c ) – способность атома данного элемента притягивать к себе электроны, осуществляющие связь. Чем больше c атома, тем сильнее притягивает он обобществленные электроны. Наиболее электроотрицательный - атом фтора, для него значение c условно принято равным 4,0.
Чисто ионная связь представляет собой лишь предельный случай. В подавляющем большинстве молекул химические связи имеют характер промежуточный между чисто ковалентными и чисто ионными связями. Это полярные ковалентные связи, которые осуществляются общей для двух ато-мов парой электронов, смещенной к ядру одного из атомов – партнеров. Если такое смещение невелико, то связь по своему характеру приближается к чисто ковалентной; чем это смещение больше, тем ближе связь к чисто ионной. С электроотрицательностью связано такое понятие как степеньионности – величина, оценивающая вклад ионной связи в соединениях: 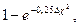 где Dc - разница в электроотрицательностях двух атомов. Если Dc = 0,8, то степень ионности – 15%, при Dc = 3,2 степень ионности – 92 %.
где Dc - разница в электроотрицательностях двух атомов. Если Dc = 0,8, то степень ионности – 15%, при Dc = 3,2 степень ионности – 92 %.
Ионный тип связи характеризуется максимальной полярностью, нена-правленностью и ненасыщаемостью. Последние две характеристики обуслов-лены тем, что электростатически взаимодействующие ионы следует рассмат-ривать как сферы, несущие либо положительный, либо отрицательный заряд.
Ковалентный тип связи характеризуется полярностью или неполяр-ностью, направленностью и насыщаемостью. Полярность связи определяется наличием на атомах частичного положительного и отрицательного зарядов (образование диполя) и характеризуется дипольным моментом m = l×d, где l – длина связи, d - эффективный заряд диполя. Дипольный момент – вектор-ная величина и направлен от плюса к минусу. Полярность молекулы определяется как сумма векторов дипольных моментов всех связей в моле-куле. По величине |d| можно оценить тип связи: если |d| = 0 – неполярная ковалентная, |d| £ 0,5 – полярная ковалентная, 0,5 < |d| < 1 – ионная.
Насыщаемость ковалентной связи определяется числом валентных орбиталей, принимающих участие в ее образовании. Поэтому теоретически возможная валентность определяется номером периода: во втором периоде – 4, в третьем – 9 и т.д. Однако следует учитывать, что не все орбитали по симметрии могут участвовать в образовании связи.
Для квантово-механического описания ковалентной связи и строения частиц (молекул и ионов с ковалентной связью) ныне используются два подхода: метод валентных связей и метод молекулярных орбиталей.
В основе метода валентных связей (ВС) лежат следующие положения:
- ковалентная химическая связь образуется двумя электронами, облада-ющими противоположно направленными спинами и принадлежащими двум атомам (по обменному и донорно-акцепторному механизмам образования связи);
- ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака; поэтому ковалентная связь образуется в таком направлении, при котором это перекрывание максимально.
Для объяснения направленности ковалентных связей в методе ВС используют представление о гибридизации атомных орбиталей центрального атома. Согласно этому представлению, образованию химических связей может предшествовать изменение валентных орбиталей атома: исходные неравноценные атомные орбитали, как бы «перемешиваясь», образуют энергетически равноценные орбитали. При этом происходит перераспределение электронной плотности, которое требует затраты энергии и в изолированных атомах не реализуется. Но в результате гибридизации электронное облако вытягивается по направлению к взаимодействующему атому, благодаря чему увеличивается его перекрывание с электронными облаками периферийных атомов, что приводит к образованию более прочных связей и выделению энергии, которая компенсирует связанные с гибридизацией энергетические затраты. Таким образом, гибридизация – это выравнивание по форме и энергии валентных орбиталей центрального атома. Пространственная структура частиц с ковалентным типом связи определяется видом гибридизации валентных орбиталей центрального атома и числом неподеленных электронных пар, содержащихся в его валентном электронном слое.
Для нахождения пространственной конфигурации частицы необходи-мо выполнить следующие операции:
- рассчитать количество возможных связей у центрального и периферийных атомов с учетом двух механизмов связи; в случае ионов добавить дополнительные электроны (учесть заряд иона);
- возбудить центральный атом (промотирование), а если невозможно – то спариваем электроны у периферийных атомов так, чтобы число связей по обменному механизму центрального и периферийных атомов было одинако-вым; если уровнять нельзя, то лишний электрон оставить у центрального атома;
- рассчитать общее число связей и разделить их на s- и p- (число s-связей равно сумме атомов в частице минус единица);
- установить тип гибридизации (участвуют все орбитали с электронами,
кроме тех, что идут на образование p-связей);
- изобразить структурную формулу и с учетом неподеленных электронов определить конфигурацию; если число p- связей меньше, чем s-, то p-связи делокализованы;
- для определения полярна или неполярна молекула необходимо найти
сумму векторов всех связей в молекуле (вектор направлен от плюса к минусу).
Если в гибридизации участвуют одна s- и одна p- орбитали (sp- гибри-дизация), то образуются две равноценные sp- орбитали; из одной s- и двух p- орбиталей (sp2- гибридизация) образуются три sp2- орбитали) и т.д. Гибрид-ные облака, соответствующие данному типу гибридизации, располагаются в атоме так, чтобы взаимодействие между электронами было минимальным, т.е. как можно дальше друг от друга. Поэтому при sp- гибридизации элек-тронные облака ориентируются в противоположных направлениях, при sp2- гибридизации – направлениях, лежащих в одной плоскости и составляющих друг с другом углы в 120о (т.е. в направлениях к вершинам правильного треугольника), при sp3- гибридизации – к вершинам тетраэдра (угол между этими направлениями составляет 109о28¢), при sp3d2- гибридизации – к вершинам октаэдра (т.е. по взаимно перпендикулярным направлениям).
 |
sp sp2 sp3 sp3d2
5.2 Примеры решения типовых задач
Задача 1. Изобразите структурную формулу молекулы СО2.
Решение. Для изображения структурной формулы воспользуемся методом валентных связей (ВС).
 |
1. Изображаем энергетические диаграммы исходных атомов, образую-щих молекулу. У периферийных атомов р-элементов можно не изображать s-орбиталь.
2. Определяем количество связей, которое может дать центральный атом и периферийные атомы по отдельности по двум механизмам.
3. Если количество связей, образуемых по обменному механизму (спаривание) различается, возбуждаем атом. В первую очередь проверяем возможность увеличения количества неспаренных электронов у централь-ного атома. Если это невозможно, то уменьшаем количество неспаренных электронов у периферийных атомов.
4. Рассчитываем общее количество связей, образованных по двум механизмам, и устанавливаем их принадлежность к s- или p. Число s-связей равно сумме атомов в молекуле минус единица.
5. Определяем тип гибридизации центрального атома. В гибридизации участвуют все орбитали с электронами, кроме тех, которые идут на образо-вание p-связей. Углерод в молекуле СО2 находится в sp-гибридизации. Моле-кула имеет линейную структуру.
6. Изображаем гибридную энергетическую диаграмму центрального атома.
5.3 Задания для самостоятельного решения
1. Как изменяется характер химической связи в ряду NaCl – MgCl2 – AlCl3 – SiCl4 – PCl5 и как это отражается на химических свойствах хлори-дов?
2. Чему равны валентность и степень окисления азота в ионе NO3-?
3. Объясните, почему молекула а) BF3 – плоская, а NF3 – объемная; б) Н2О – угловая, а ВеН2 – линейная?
4. Пользуясь таблицей относительных электроотрицательностей, вы-числить их разность для связей K – Cl, Ca – Cl, Fe – Cl, Ge – Cl. Какая из свя-зей характеризуется наибольшей степенью ионности?
5. Изменится ли конфигурация частиц при переходе от NO2 к NO2-?
6. Какие типы гибридизации атомных орбиталей углерода соответст-вуют образованию молекул СН4, С2Н6, С2Н4,С2Н2?
7. В молекулах SO2 и SO3 атом серы находится в sp2-гибридизации. По-лярны ли эти молекулы? Какова их пространственная структура?
8. BaCl2 в водных растворах диссоциирует полностью, а HgCl2 почти не диссоциирует. Объясните это различие в свойствах солей.
9. Какой вид взаимодействия между частицами приводит в конденси-рованное состояние Nе, N2, HJ, Cl2, BF3, H2O?






