Задача 1. Вычислить ионную силу и активность ионов в 0,08 М растворе СаCl2, содержащем, кроме того, 0,06 моль/л HCl.
Решение.
m =  .
.
Находим коэффициенты активности ионов

Активность ионов составляет соответственно (моль/л):

Задача 2. Вычислить a и [H+] для 0,05 М раствора хлоруксусной кисло-ты CH2ClCOOH. K = 1,4×10-3.
Решение. Так как С/К = 0,05/1,4×10-3 = 35,7, что меньше 450. Поэтому для определения a воспользуемся формулой  . Из этой формулы находим
. Из этой формулы находим  ;
;
[H+] = C×a =5×10-2 ×0,154 = 7,7×10-3 моль/л.
Задача 3. Вычислить a, [H+] и рН в 0,1 М растворе HClO (K = 5 ×10-8). Как изменится рН, если к 1 л 0,1 М раствора НСlO добавить 0,2 моля NaClO?
Решение. Отношение С/К = 0,1/5 ×10-8 > 450. Воспользуемся форму-лой: К = С × a2, откуда 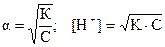 . В растворе кислоты
. В растворе кислоты
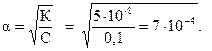 Тогда концентрацию ионов водорода можно рас-считать как: [H+] = С × a = 0,1×7×10-4 = 7×10-5 моль/л; рН = -lg[H+] =
Тогда концентрацию ионов водорода можно рас-считать как: [H+] = С × a = 0,1×7×10-4 = 7×10-5 моль/л; рН = -lg[H+] =
-lg[7×10-5 ] = 4,15.
В растворе при добавлении сильного электролита создается ионная сила, влияющая на концентрацию ионов водорода. Концентрацию ионов сильного электролита определяем по уравнению диссоциации:
NaClO ⇄ Na+ + ClO-
C,моль/л 0,2 0,2 0,2
Так как кислота HClO⇄H++ClO- слабый электролит, то концентрация его ионов не оказывает значительного влияния на ионную силу раствора:  . Поскольку кислота при диссоциации образует ионы Н+: и ClO-, то определяем для них коэффициент активности:
. Поскольку кислота при диссоциации образует ионы Н+: и ClO-, то определяем для них коэффициент активности:
 ;
;  f+ =0,70. Для однозарядных ионов коэффициенты активностей при данной ионной силе одинаковы и равны 0,70. Рассчитываем термодинамическую константу равновесия HClO
f+ =0,70. Для однозарядных ионов коэффициенты активностей при данной ионной силе одинаковы и равны 0,70. Рассчитываем термодинамическую константу равновесия HClO  . Для определения концентрации ионов Н+ в присутствии сильного электролита составим таблицу:
. Для определения концентрации ионов Н+ в присутствии сильного электролита составим таблицу:
СМ HClO ⇄ H+ + ClO
 исходная 0,1 - 0,2 ® СМ(NaClO)
исходная 0,1 - 0,2 ® СМ(NaClO)
в диссоциации х х х
в равновесии [ ] (0,1-x) x (0,2+x)
Добавление 0,2 моля NaClO к 1 л раствора HClO уменьшит концентрацию Н+ - ионов за счет увеличения концентрации ионов ClO- (по принципу Ле Шателье). Подставляем равновесные концентрации в выра-жение константы диссоциации, используя значение термодинамической константы К0:
 . Так как х << 0,1 и 0,2 выражение для константы приобретает вид:
. Так как х << 0,1 и 0,2 выражение для константы приобретает вид: 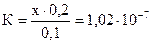 ; [H+] = х = 5,1×10-8 моль/л. Активность ионов водорода равна:
; [H+] = х = 5,1×10-8 моль/л. Активность ионов водорода равна:  моль/л. Определяем pH по формуле:
моль/л. Определяем pH по формуле: 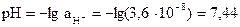 . Таким образом, [H+] умень-шилась в
. Таким образом, [H+] умень-шилась в  раз.
раз.
Задача 4. рН раствора составляет 4,3. Вычислить концентрацию ионов Н+ и ОН- в растворе.
Решение. Из выражения рН = -lg[H+] = 4,3 следует, что [H+] = 10-pH =
10-4,3 = 5×10-5 моль/л. Из ионного произведения воды находим [OH-] =
 моль/л.
моль/л.
Задача 5. Вычислить растворимость BaSO4 (ПР = 1,1×10-10) в 0,2 М растворе KNO3 и сравнить ее с растворимостью той же соли в воде.
Решение. Ионная сила 0,2 М раствора KNO3 m =0,2 (ионной силой насыщенного раствора BaSO4 m =4 × 10-5 можно пренебречь при вычислении общей ионной силы раствора), а активность ионов Ba2+ и SO42- равна каждая 0,24×S, где S – растворимость BaSO4, моль/л, а 0,24 – коэффициент активности иона, рассчитанный по формуле 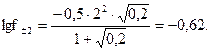 В таком случае ПР = (0,24 S)2; 1,1×10-10 = 5,76×10-2×S2, откуда
В таком случае ПР = (0,24 S)2; 1,1×10-10 = 5,76×10-2×S2, откуда
 моль/л.
моль/л.
Учитывая, что растворимость BaSO4 в воде равна 
моль/л, находим, что в 0,2 М растворе KNO3 растворимость BaSO4 увеличилась в  раза.
раза.
Задача 6. Произведение растворимости MgS при 25 0С равно 2×10-15. Образуется ли осадок MgS при смешивании равных объемов 0,004 н. Mg(NO3)2 и 0,0006 н. Na2S? Степени диссоциации этих электролитов принять равными единице.
Решение. При смешивании равных объемов растворов объем смеси стал в 2 раза больше каждого из взятых растворов, а концентрация каждого из растворенных веществ 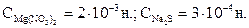 уменьшилась вдвое. Для определения концентрации ионов Mg2+ и S2- необходимо перевести молярную концентрацию эквивалента смешиваемых растворов в молярную.
уменьшилась вдвое. Для определения концентрации ионов Mg2+ и S2- необходимо перевести молярную концентрацию эквивалента смешиваемых растворов в молярную.
Концентрации ионов Mg2+ и S2- соответственно равны:  моль/л;
моль/л;
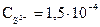 моль/л. Произведение концентраций (ПК) ионов Mg2+ и S2-: ПК =
моль/л. Произведение концентраций (ПК) ионов Mg2+ и S2-: ПК = 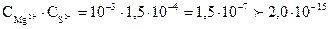 . Таким образом, произведение концентраций ионов больше произведения растворимости (ПК>ПР), следо-вательно, осадок MgS образуется.
. Таким образом, произведение концентраций ионов больше произведения растворимости (ПК>ПР), следо-вательно, осадок MgS образуется.
Лабораторные работы






