1. Написать формулы ангидридов указанных кислот. Назвать кислоты и их ангидриды: H2SO4; H3BO3; H4P2O7; HClO; HMnO4.
2. Написать уравнения реакций, свидетельствующих о проявлении основных свойств соединениями: FeO; Cs2O;HgO; Bi2O3; CaO; Fe2O3.
3. Написать формулы оксидов, соответствующих указанным соединениям. Назвать эти оксиды и соединения: H2SiO3; Cu(OH)2; H3ASO4; H3P3O9; HClO2; HMnO4; Fe(OH)3; H2WO4; HClO4.
4. Какие из указанных газов вступают в химическое взаимодействие с раствором щелочи: HCl; H2S; NO2; N2; Cl2; CH4; SO2; NH3? Написать уравнения соответствующих реакций.
5. Написать уравнения реакций образования Ca3 (PO4)2; Mg(ClO4)2;
Ba (NO3)2; NaAlO2 в результате взаимодействия:
а) основного и кислотного оксидов;
б) основания и кислотного оксида;
в) основного оксида и кислоты;
г) основания и кислоты.
6. Запишите уравнения реакций нейтрализации, характерных для орто-фосфорной кислоты.
7. Какие кислоты могут быть получены непосредственным взаимодействием с водой оксидов: P2O5; CO2; N2O5; NO2; SO2.? Назвать эти оксиды и их продукты взаимодействия с водой.
8. Какие из указанных веществ реагируют с гидроксидом натрия: HNO3; CaO; CuSO4; Zn(OH)2; P2O5; SO2; NH3. Написать уравнения соответствующих реакций.
9. Какие из перечисленных соединений относятся к оксидам: K2O2; MnO2; BaO2; MnO; CrO3; V2O5; Cl2O7; Cl2O; Cr2O3.? Назвать эти соединения. Какие кислоты или основания (указать формулу) соответствуют этим оксидам?
10. С какими из нижеперечисленных веществ будет реагировать соляная (хлороводородная) кислота: N2O5; CaO; CuSO4; Zn(OH)2; P2O5; AgNO3; NH3; H3PO4; Cr2O3; Fe(OH)3. Написать уравнения соответствующих реакций.
11. Какие из перечисленных оксидов имеют кислотный характер: SeO2; MnO2; BaO; Mn2O7; CrO3; V2O5; Cl2O7; P2O3? Подтвердить уравнениями реакций. Назовите эти соединения и соответствующие им кислоты.
12. С какими из нижеперечисленных веществ будет реагировать азотная кислота: N2O5; CaO; Cu(OH)NO3; Zn(OH)2; P2O5; NH3; NaHCO3; Cr2O3; Fe(OH)3. Написать уравнения соответствующих реакций.
13. Можно ли получить раствор, содержащий одновременно:
а) Ba(OH)2 и HCl; б) СаCl2 и Na2CO3; в) NаCl и AgNO3? Обосновать.
14. Запишите уравнения реакций нейтрализации c участием ортофосфорной кислоты и гидроксида кальция.
15. Какие из перечисленных оксидов реагируют со щелочами: SO2; MnO2; СaO; Mn2O7; CrO3; N2O5; Cl2O; P2O3? Подтвердить уравнениями реакций. Назовите эти оксиды и продукты их взаимодействия с гидроксидом натрия.
16. С какими из нижеперечисленных веществ будет реагировать гидроксид кальция: N2O5; MgO; Cu(OH)NO3; P2O5; NH3; NaHCO3; SO3; HClO3? Написать уравнения соответствующих реакций.
17. Можно ли получить раствор, содержащий одновременно:
а) Ba(OH)2 и H2SO4; б) MgCl2 и Na2CO3; в) NаCl и Pb(NO3)2? Обосновать.
18. Запишите уравнения реакций нейтрализации c участием ортофосфорной кислоты и гидроксида аммония.
19. Составить уравнения реакций, с помощью которых можно осуществить указанные превращения: S – SO2 – NaHSO3 - Na2SO3 – CaSO3 –– SO2 – SO3 – BaSO4.
20. Составьте формулы: дигидроксосульфата железа (III); гидрофосфата аммония; хлората калия; нитрата аммония.
ТЕМА 4. СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКИЙ ЗАКОН
Д. И. МЕНДЕЛЕЕВА
4.1 Рекомендации к изучению теоретического материала
Современная теория строения атомов и молекул основана на квантово-механической теории, разработанной де Бройлем, Шредингером, Гейзенбер-гом и другими учеными, которая учитывает двойственность природы электронов и других микрообъектов, т.е. их корпускулярно-волновые свойства. Свет также обладает корпускулярно-волновыми свойствами, что обнаруживается в ряде различных явлений: в его интерференции и дифракции; с одной стороны, в его фотоэффекте и давлении – с другой. Двойственность природы света обнару-живается и в уравнении, связывающем количество движения фотона (mc) с длиной волны (l): hn = mc2 или l =  , где h – постоянная Планка или квант действия, равна 6,63×10-34 Дж×с; n - частота, равная n = с/l; с - скорость света равна 3×108 м/с; l - длина волны.
, где h – постоянная Планка или квант действия, равна 6,63×10-34 Дж×с; n - частота, равная n = с/l; с - скорость света равна 3×108 м/с; l - длина волны.
В квантовой механике движение микрочастиц описывается уравнением Шредингера, играющим роль, подобную роли уравнений законов Ньютона в классической механике, движение волны частицы (например, электрона) количественно характеризуется амплитудой Y (волновой функцией), которая вычисляется из уравнения Шредингера (HY=EY, где H - гамильтониан, Е – энергия электрона. Квадрат функции ½Y½2 выражает вероятность нахож-дения электрона в данном месте пространства.
В квантовой механике сохраняются значения понятий массы частицы, энергии, импульса (mu) и момент количества движения. Однако такое поня-тие как траектория движения частицы в ней отсутствует. По соотношению неопределенностей Гейзенберга одновременное определение местополо-жения частицы (например, координатой x) и ее количества движения (им-пульса p = mv) не может быть сделано с какой угодно степенью точности. Вероятностное описание движения электрона приводит к тому, что электрон вокруг ядра образует той или иной формы электронное облако, плотность которого в разных точках определяется вероятностью пребывания электрона в них. Орбиталь – область пространства вокруг ядра, в которой вероятность нахождения электрона составляет 90%.
Каждая совокупность положений электрона в атоме (орбиталь) описы-вается определенного вида волновой функцией Y. Значение этой функции зависит от трех координат, в связи с чем в решении уравнения Шредингера появляются три целочисленных квантовых числа: n, l, m, характеризующие любое устойчивое состояние электрона в атоме – атомную электронную орбиталь.
Для характеристики энергетического состояния электрона в атоме квантовая механика пользуется системой четырех квантовых чисел.
1. Главное квантовое число n характеризует энергетический уровень, на котором находится электрон, а, следовательно, общий запас его энергии. Число n принимает целочисленные значения от 1 до ¥, а для атомов элементов периодической таблицы в нормальном состоянии – от 1 до 7. Уровни, отвечающие этим состояниям, обозначаются соответственно бук-вами К, L, M, N, O, P и Q.
2. Энергетические состояния электронов одного уровня могут несколь-ко отличаться друг от друга в зависимости от конфигураций их электронных облаков, образуя группы электронов разных подуровней. Для характеристики подуровня служит побочное или орбитальное квантовое число l – момент количества движения электрона на орбитали или форма орбитали. Это число может иметь целочисленные значения в пределах от 0 до n – 1. Так, если главное квантовое число n = 1, то побочное квантовое число имеет только одно значение (l = 0). При n = 4 величина l принимает четыре значения, а именно: 0, 1, 2, 3. Электроны, отвечающие этим значениям l, называются соответственно s-, p-,d- и f-электронами. Например, запись 3р отвечает сос-тоянию n = 3 и l = 1. Для каждого значения n имеется столько же значений l.
Электроны различных подуровней отличаются формой электронных облаков. Для s-электронов характерна простейшая форма – сфера; для р-электронов – форма вытянутых восьмерок, или гантелей, оси которых располагаются по отношению друг к другу под углом 900 и обозначаются px, py и pz. Формы d- и f-орбиталей более сложные.
3. Магнитное квантовое число ml – проекция вектора момента коли-чества движения электрона на направление магнитного поля, ориентация орбитали в пространстве, т.е. ее наклон относительно магнитной оси атома. Оно может принимать целочисленные значения от – l до + l, всего 2 l + 1 значений. Правило, по которому ml может принимать только значения l, l -1, …, 0,... - (l -1), - l, гласит, что вектор, представляющий собой орбитальный угловой момент, может быть направлен так, чтобы его компонента вдоль данного направления имела величину, определяемую числом ml. Например, для l = 1 (p-орбиталь) ml принимает значения –1, 0, +1 (орбитали в декартовой системе координат располагаются по осям px, py, pz), а при l = 3 оно принимает 7 значений: -3, -2, -1, 0, 1, 2, 3. Для d-орбиталей l = 2, а m l =-2, -1, 0, 1, 2, т.е. пять орбиталей, расположенные вдоль биссектрис в декартовых плоскостях (dxy, dyz, dxz) и на осях координат ( ).
).
4. Спиновое квантовое число ms – момент собственного количества дви-жения электрона может принимать значения  . Это квантовое число не связано с остальными.
. Это квантовое число не связано с остальными.
Набор орбиталей с одинаковым значением главного квантового числа n и разным значением орбитального квантового числа l составляет энерге-тический уровень, а с одинаковым l и разным магнитным квантовым числом ml – энергетический подуровень. В графических схемах электронного строения атомов каждая орбиталь обозначается символом.
При заполнении орбитали электронами следует придерживаться следу-
ющих положений.
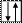 Принцип Паули. В атоме не может быть двух электронов, характери-зующихся одинаковым набором квантовых чисел. Из этого следует, что каж-дая атомная орбиталь может быть занята не более чем двумя электронами, причем их спиновые квантовые числа должны быть различными, что сим-волически обозначают так:
Принцип Паули. В атоме не может быть двух электронов, характери-зующихся одинаковым набором квантовых чисел. Из этого следует, что каж-дая атомная орбиталь может быть занята не более чем двумя электронами, причем их спиновые квантовые числа должны быть различными, что сим-волически обозначают так:
Устойчивому (невозбужденному) состоянию многоэлектронного атома отвечает такое распределение электронов по атомным орбиталям, при кото-ром энергия атома минимальна. Поэтому атомные орбитали заполняются в порядке последовательного возрастания их энергий (при этом не должен нарушаться принцип Паули).
Правила Клечковского учитывают зависимость энергии орбитали от зна-чений как главного (n), так и орбитального (l) квантовых чисел. Согласно этим правилам атомные орбитали заполняются электронами в порядке последо-вательного увеличения суммы n + l (1-е правило Клечковского), а при одина-ковых значениях этой суммы – в порядке последовательного возрастания главного квантового числа n (2-е правило Клечковского).
Размещение электронов в пределах одного энергетического подуровня определяется правилом Хунда, согласно которому минимальной энергии атома соответствует такое распределение электронов по атомным орбиталям данного подуровня, при котором абсолютное значение суммарного спина атома максимально; при любом другом размещении электронов атом будет находиться в возбужденном состоянии, т.е. будет характеризоваться более высокой энергией.
Используя указанные правила, можно записать электронную формулу или изобразить энергетическую диаграмму для любого атома. При этом необходимо учитывать, что максимальная емкость уровня - 2 n 2, а подуровня - 2(2 l + 1). Для атома хлора электронная формула будет иметь вид: 1s22s2-2p63s23p5. Его порядковый номер 17 указывает на заряд ядра и на суммарное число электронов.
Электронными аналогами называются элементы, у которых валентные электроны расположены на орбиталях, описываемых общей для всех элементов формулой. В периодической системе элементов электронные аналоги входят в состав одной подгруппы. Первую группу составляют элементы ns1 (главная подгруппа – щелочные металлы) и (n – 1)d10ns1 (побочная подгруппа меди). Во II группе находятся элементы ns2 (главная подгруппа бериллия) и (n – 1)d10ns2 (побочная подгруппа цинка), в III группе – ns2np1 (главная подгруппа бора) и (n – 1)d1ns2 (побочная подгруппа скандия), в IV группе – ns2np2 (главная подгруппа углерода) и (n – 1)d2ns2 (побочная подгруппа титана), в V группе – ns2np3 (главная подгруппа азота) и (n – 1)d4ns1 (побочная подгруппа ванадия), в VI группе - ns2np4 (главная подгруппа кислорода) и (n – 1)d5ns1 (побочная подгруппа хрома), в VII группе – ns2np5 (главная подгруппа фтора) и (n – 1)d5ns2 (побочная подгруппа марганца). В VIII группе находятся три побочные подгруппы (железа, кобальта, никеля). Нулевая группа имеет только главную подгруппу – ns2np6 (благородные газы); сюда же относят и гелий, хотя он s – элемент (1s2). Номер группы определяет максимально возможную положительную степень окисления элемента в соединении.
В периодической системе элементов номер периода соответствует наи-большему значению главного квантового числа n орбиталей с электронами. Семейства химических элементов определяются значением l. Если последний электрон в атоме попадает на s орбиталь, то он относится к семейству s- элементов, если на p орбиталь, то – к семейству p- элементов и т.д.; s и p элементы составляют главные подгруппы, d- и f- элементы – побочные. Периодическая система элементов построена в соответствии с периодическим законом Д. И. Менделеева, современная формулировка которого следующая: физические и химические свойства элементов находятся в периодической зависимости от заряда ядра (сумма протонов в ядре). Главная периодичность – периодичность в изменении свойств внутри периода или группы, внутренняя – внутри всего семейства элементов и вторичная – внутри отдельных групп, составляющих семейство.
Потенциал ионизации – энергия, необходимая для удаления электрона с орбитали на бесконечное расстояние от ядра – в группе сверху вниз уменьшается, в периоде слева направо возрастает. Сродство к электрону – энергия, которая выделяется при присоединении электрона к атому – в группе сверху вниз уменьшается, в периоде слева направо возрастает. Электроотрицательность – арифметическая сумма энергии ионизации и сродства к электрону – в группе сверху вниз уменьшается, в периоде слева направо возрастает.
4.2 Примеры решения типовых задач
Задача 1. Написать электронные формулы атомов хрома, меди и германия. К какому семейству элементов они относятся?
Решение. У элементов 4-го периода хрома (z = 24) и меди (z = 29), атомы которых имеют 4 электронных слоя, происходит, начиная от Sc, заполнение подуровня 3d и поэтому следовало бы ожидать, что их формулы будут иметь вид: Cr – 1s22s22p63s23p6(4s23d4); Cu – 1s22s22p63s23p6(4s23d9). Однако в действительности из-за проскока одного из электронов подуровня 4s на подуровень 3d электронные формулы будут иметь вид:
Cr – 1s22s22p63s23p64s13d5;
Cu – 1s22s22p63s23p64s13d10;
Хром и медь относятся к семейству d – элементов.
Атом германия (z = 32) имеет следующую электронную формулу:
1s22s22p63s23p63d104s24p2. Германий относится к семейству р-элементов.
Задача 2. Написать электронно-графические формулы атомов азота и кислорода.
Решение. Напишем электронные формулы атомов азота и кислорода.
N – 1s22s22p3; O – 1s22s22p4.
Согласно правилу Хунда, наименьшим запасом энергии обладают атомы, у которых в пределах данного значения орбитального квантового числа l электроны располагаются так, чтобы число неспаренных электронов с параллельными спинами было максимальным.
для азота для кислорода
 |
Задача 3. Установите номер периода и группы для элементов с электронной конфигурацией внешнего уровня: 4s23d3 и 4s24p3. Запишите формулы высших оксидов и гидроксидов с участием этих элементов.
Решение. В обоих случаях самое большое значение главного квантового числа равно 4, значит - это элементы четвертого периода. Сумма внешних электронов равна 5, значит - это элементы пятой группы. Первый из них относится к семейству d-элементов (побочная подгруппа), второй – к семейству р-элементов (главная подгруппа). Таким образом, первый элемент – ванадий, второй – мышьяк. У обоих элементов высшая степень окисления +5, значит, формула оксида Э2О5, а кислоты НЭО3 или Н3ЭО4.
Задача 4. Чему равен суммарный спин электронного состояния
ns2(n – 1)d4. Какие элементы имеют это состояние?
 Решение. Изображаем энергетическую диаграмму в соответствии с правилом Хунда:
Решение. Изображаем энергетическую диаграмму в соответствии с правилом Хунда:
Суммарный спин åМS = 5 (+  ) + 1 (-
) + 1 (-  ) = 2.
) = 2.
Так как валентных электронов шесть, это d-элемент шестой группы (хром, молибден, вольфрам). У хрома и молибдена имеет место проскок электрона, что приводит к конфигурации ns1(n – 1)d5. Следовательно, заданный электронной формулой элемент – вольфрам.
4.3 Задачи для самостоятельного решения
1. Сколько значений магнитного квантового числа возможно для электронов энергетического подуровня, орбитальное квантовое число которого l=2? l=3?
2. Какое максимальное число электронов может содержать атом в элек-тронном слое с главным квантовым числом n=4?
3. Определить по правилу Клечковского последовательность заполнения электронных орбиталей, характеризующихся суммой n +l: а) 5; б) 6; в) 7.
4. Указать порядковый номер элемента, у которого: а) заканчивается заполнение электронами орбиталей 4d; б) начинается заполнение подуровня 4р;
5. Записать электронные формулы для элементов с порядковыми номе-рами 8; 15; 18; 20, 23, 53, 63, 83. Установить положение этих элементов в периодической системе. Составить графические схемы заполнения электро-нами валентных орбиталей этих атомов.
6. Напишите электронные формулы для хрома, меди, ниобия, молибдена, родия, палладия и серебра. Какое явление в электронном строении объеди-няет эти элементы?
7. Структура валентного электронного слоя атома элемента выражается формулой: а) 5s25p4; б) 3d54s1; в) 6s26p1. Определить порядковый номер, суммарный спин и название элемента. Составить для него формулу высшего оксида и гидроксида (кислоты).
8. У элементов каких периодов электроны внешнего слоя характеризуются значением n + l =5?
9. Почему потенциалы ионизации у р-элементов различаются сильнее, чем у d-элементов?
10. Как изменяются химические свойства элементов в подгруппах и периодах? Чем определяется такое изменение свойств?
ТЕМА 5. ХИМИЧЕСКАЯ СВЯЗЬ






