Обменные реакции в растворах электролитов протекают в направлении связывания ионов, приводящего к образованию малорастворимых веществ (осадков или газов) или частиц слабых электролитов.
В обменных реакциях, протекающих в растворах электролитов, наряду с недиссоциированными частицами слабых электролитов, твердыми вещест-вами и газами участвуют также находящиеся в растворе ионы. Поэтому сущность протекающих процессов наиболее полно выражается при записи их в форме ионно-молекулярных уравнений. В таких уравнениях слабые элек-тролиты, малорастворимые соединения и газы записываются в молекуляр-ной форме, а находящиеся в растворе сильные электролиты – в виде состав-ляющих их ионов:
а) BaCl2 + Na2SO4 = BaSO4 ¯ + 2NaC
Ba2+ + SO42- ® BaSO4 ¯
б) Na2SO3 +2HCl = 2NaCl + SO2 + H2O
SO32-+ 2H+ ® SO2 + H2O
в) 2CH3COOK + H2SO4 = K2SO4 + 2CH3COOH
CH3COO- + H+ ® CH3COOH
г) Са(ОН)2 + 2 HNO3 = Ca(NO3)2 + 2H2O
OH- + H+ ® H2O
д) NH4OH + HCl = NH4Cl + H2O
NH4OH + H+ «NH4+ + H2О
е) [Zn(H2O)2(OH)2] + 2NaOH = Na2[Zn(OH)4] + 2H2O
[Zn(H2O)2(OH)2] + 2OH- ® Zn(OH)4]2- + 2H2O
В тех случаях, когда малорастворимые вещества (или слабые электро-литы) имеются как среди исходных веществ, так и среди продуктов реакции, равновесие смещается в сторону образования наименее растворимых или на-именее диссоциированных веществ. Например, если малорастворимый хло-рид серебра обработать при взбалтывании раствором иодида калия, то про-изойдет постепенный переход его в более труднорастворимый иодид сереб-ра, т.к. ПРAgI (8,3×10-17) меньше ПРAgCl (1,8×10-10): AgCl ¯ + I- = AgI ¯ + Cl-. При нейтрализации слабой кислоты сильным основанием СН3СООН + ОН- = СН3СОО- + Н2О в реакции участвуют два слабых электролита – сла-бая кислота и вода. При этом равновесие оказывается сильно смещенным в сторону образования более слабого электролита - воды, константа диссоци-ации которой (1,8×10-16) значительно меньше константы диссоциации уксус-ной кислоты (1,8×10-5). Однако до конца такая реакция протекать не будет: в растворе останется небольшое количество недиссоциированных молекул СН3СООН и ионов ОН-, так что реакция раствора будет не нейтральной (как при нейтрализации сильной кислоты сильным основанием), а слабоще-лочной.
Аналогично при нейтрализации слабого основания сильной кислотой Zn(OH)2 + 2H+ = Zn2+ + 2H2O равновесие будет смещено вправо – в сторону образования более слабого электролита (воды), но при достижении равно-весия в растворе останется небольшое количество недиссоциированных час-тиц основания и ионов Н+; реакция раствора будет слабокислой.
Таким образом, реакции нейтрализации, в которых участвуют слабые кислоты или основания, - обратимы. Это означает, что при растворении в воде соли, в состав которой входит ион слабого электролита, протекает процесс гидролиза, т.е. обменного взаимодействия соли с водой, в результате которого образуется слабая кислота или слабое основание.
Количественными характеристиками процесса гидролиза являются степень гидролиза (h) и константа гидролиза (КГ). Степень гидролиза – это отношение концентрации подвергшейся гидролизу соли к исходной концен-трации соли  . Константу гидролиза определяют по закону действия масс с использованием константы диссоциации соответствующей кислоты или основания. Эти две характеристики связаны между собой формулой:
. Константу гидролиза определяют по закону действия масс с использованием константы диссоциации соответствующей кислоты или основания. Эти две характеристики связаны между собой формулой:  Если h<<1, то можно пользоваться формулой КГ = С × h2, откуда
Если h<<1, то можно пользоваться формулой КГ = С × h2, откуда 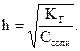 Гидролизу подвергаются три типа солей.
Гидролизу подвергаются три типа солей.
Соль образована слабой кислотой и сильным основанием, например: NaNO2, KCN, Na2SO3, CH3COONa, K3PO4 и т.д. Вследствие гидролиза этого типа солей среда будет щелочной (рН>7), т.к. в растворе появляется некоторый избыток ОН- -ионов.
KCN + H2O ⇄ HCN + KOH (молекулярная форма)
СN- + H2O ⇄ HCN + OH- (ионная форма).
Для этого типа солей константа гидролиза определяется по формуле:  ; концентрация гидроксильных ионов связана с константой гидролиза и концентрацией соли: [OH-] = h × Cсоли =
; концентрация гидроксильных ионов связана с константой гидролиза и концентрацией соли: [OH-] = h × Cсоли =  . Для приведенной реакции -
. Для приведенной реакции - 
 ;
;
[OH-] =  ; рН = 14 – рОН = 14 – (-lg[OH]) = 14 + lg
; рН = 14 – рОН = 14 – (-lg[OH]) = 14 + lg 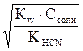 .
.
Соли многоосновных кислот гидролизуются ступенчато:
Na3PO4 + H2O ⇄ Na2HPO4 + NaOH (первая стадия)
PO43- + H2O ⇄ HPO42- + OH-
Для этой стадии гидролиза в выражение константы входит третья константа диссоциации ортофосфорной кислоты 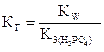 ;
;
Вторая стадия гидролиза связана с гидролизом кислой соли Na2HPO4.
Накопление в растворе ионов ОН- препятствует дальнейшему протека-нию гидролиза. Однако, если связывать образующиеся гидроксид - ионы добавлением Н+, то анион НРО42- в свою очередь подвергается гидролизу (вторая ступень гидролиза). Ионы водорода появляются в водной среде кислой соли посредством диссоциации гидрофосфат-аниона НРО42- и дигид-рофосфат-аниона Н2РО4-, образующегося в результате гидролиза:
НРО42- + Н2О ⇄ Н2РО4- + ОН-
Протекание процесса гидролиза кислой соли можно оценить по вели-чине рН раствора кислой соли, рассчитываемого по формуле:  , где рК = -lg Kд(кислоты). Если рН > 7, то гидролиз будет протекать, а если
, где рК = -lg Kд(кислоты). Если рН > 7, то гидролиз будет протекать, а если
РН < 7 - гидролиз не будет протекать. Для раствора соли Na2HPO4
 .
.
Гидролиз этой соли в молекулярной форме описывается уравнением:
Na2HPO4 + H2O ⇄ NaH2PO4 + NaOH (вторая стадия)
Раствор соли NaH2PO4 имеет кислую среду, поэтому эта соль гидро-лизу не подвергается: 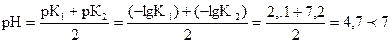 .
.
Соль образована слабым основанием и сильной кислотой, например: NH4NO3, Al(NO3)3, ZnSO4 , CuCl2, Be(NO3)2 и т.п. Для реакции NH4NO3 + H2O = NH4OH + HNO3 константа гидролиза этой соли определяется по формуле:  , а степень гидролиза:
, а степень гидролиза: 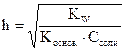 . Концентрация ионов водорода в растворе и рН вычисляются по формуле рН = - lg[H+] = h×Ссоли =
. Концентрация ионов водорода в растворе и рН вычисляются по формуле рН = - lg[H+] = h×Ссоли = 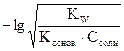 .
.
В ионном виде эта реакция представляется как:
NH4+ + H2O ⇄ NH4OH + H+; pH < 7.
Соли многокислотных слабых оснований гидролизуются ступенчато, например: Fe3+ + H2O ⇄ Fe(OH)2+ + H+ (первая стадия).
В холодных и умеренно концентрированных растворах солей гидролиз их практически ограничивается этой первой стадией. При повышении темпе-ратуры растворов, а также по мере их разбавления гидролиз солей усиливается и тогда заметно активизируется вторая стадия гидролиза, в результате которой образуются соли, содержащие дигидроксо-ионы:
Fe(OH)2+ + H2O ⇄ Fe(OH)2+ + H+ (вторая стадия).
В более редких случаях, например, при добавлении по каплям раствора FeCl3 в кипящую воду, идет третья стадия гидролиза и образуется Fe(OH)3:
Fe(OH)2+ + H2O ⇄ Fe(OH)3 + H+ (третья стадия).
Cоль образована слабым основанием и слабой кислотой, например:
СH3COONa, NH4NO2, NH4CN, (NH4)2S, (NH4)3PO4, (NH4)HCO3 и т.п. Для реакции NH4NO2 + H2O ⇄ NH4OH + HNO2 или в ионном виде:
NH4+ + NO2- + H2O ⇄ NH4OH + HNO2
константа гидролиза определяется по формуле:  . Кислотно-основной характер среды оценивается сравнением констант диссоциации слабой кислоты и слабого основания. Для приведенной реакции Кдис.(HNO2) = 5,1×10-4 больше Кдис.(NH4OH) = 1,8×10-5, поэтому реакция среды слабо- кислая.
. Кислотно-основной характер среды оценивается сравнением констант диссоциации слабой кислоты и слабого основания. Для приведенной реакции Кдис.(HNO2) = 5,1×10-4 больше Кдис.(NH4OH) = 1,8×10-5, поэтому реакция среды слабо- кислая.
При гидролизе по катиону и аниону возможны случаи полного гидролиза. Если соль образована катионом амфотерного гидроксида (Cr3+, Al3+, Fe3+, Be2+, Zn2+, Cd2+, Cu2+, Pb2+ и др.) и анионом слабой летучей кислоты (H2CO3, H2SO3, H2S, HCN и др.), то гидролиз такой соли будет идти с образованием осадка гидроксида и газообразного вещества (оксида или кислоты), например:
Al2S3 + 6H2O ⇄ 2Al(OH)3¯ + 3H2S
Cr2(CO3)3 + 3H2O ⇄ 2Cr(OH)3¯ + 3CO2.
Совместный гидролиз происходит, если в реакции обмена двух солей может образоваться полностью гидролизующаяся соль. В результате сов-местного гидролиза образуются труднорастворимые основания двух- или трехзарядных катионов и газообразные вещества слабых летучих кислот.
Если анионом слабой кислоты является карбонат-ион СО32-, то в смеси с трехзарядным катионом образуется осадок М(ОН)3, а с двухзарядным кати-оном – трудно растворимый гидроксокарбонат - М2(ОН)2СО3. Например:
2Fe(NO3)3 + 3Na2CO3 + 3H2O ⇄ 2Fe(OH)3¯ + 3CO2 + 6NaNO3.
В растворе нитрата железа (III) гидролиз обусловливает катион Fe3+:
Fe3+ + H2O ⇄ Fe(OH)2+ + H+,
а в растворе карбоната натрия – анион СО32-:
СО32- + H2O ⇄ НСО3- + ОН-.
Гидролиз этих солей обычно ограничивается первой ступенью. При смеше-нии растворов этих солей ионы Н+ и ОН- взаимодействуют, образуя молеку-лы слабого электролита Н2О, который уходит из сферы реакции. Это приводит к тому, что усиливается гидролиз каждой из солей до образования Fe(OH)3 и СО2.
В осадок в подобных случаях выпадает наименее растворимый из возможных продуктов гидролиза. Так, растворимость гидроксокарбоната меди (СuОН)2СО3 меньше, чем гидроксида меди Сu(ОН)2. Поэтому при сли-вании растворов CuSO4 и Na2CO3 конечным продуктом гидролиза является именно гидроксокарбонат меди
2CuSO4 + 2Na2CO3 + H2O ⇄ (СuОН)2СО3¯ + 3CO2 + Na2SO4
2Cu2+ + 2СО32- + H2O ⇄ (СuОН)2СО3¯ + 3CO2
Равновесие гидролиза может быть смещено изменением концентрации соли (уменьшение усиливает, а увеличение ослабляет гидролиз); подкис-лением или подщелачиванием раствора соли (по принципу Ле Шателье), а также изменением температуры. Поскольку обратный гидролизу процесс – реакция нейтрализации – протекает с выделением теплоты, то реакция гидролиза представляет собой эндотермический процесс. Поэтому повыше-ние температуры ведет к усилению гидролиза, а понижение температуры – к его ослаблению.






