1. Степень окисления фосфора в соединении Ca3(PO4)2 равна
1) –3 3) +3
2) 0 4) +5
2. Наибольшей электроотрицательностью обладает элемент
1) Be 3) B
2) C 4) N
3. Наибольшую степень окисления азот проявляет в соединении
1) NH3 3) N2
2) NO2 4) N2O5
4. Степень окисления +6 сера проявляет в соединении
1) H2S 3) SO2
2) Na2SO3 4) K2SO4
5. В соединения PH3, P2O5, H3PO3 фосфор имеет степени окисления, соответственно равные
1) +3; +5; -3 3) –3; +5; +3
2) -3;+3; +5 4) +3; -5; -3
6. Одинаковую степень окисления фосфор имеет в соединениях
1) Ca3P2 и H3PO3 3) KH2PO4 и K3PO4
2) P4O6 и P4O10 4) H3PO4 и H3PO3
7. Сульфит натрия Na2SO3 может проявлять в окислительно-восстановительных реакциях свойства
1) только окислителя
2) только восстановителя
3) ни окислителя, ни восстановителя
4) и окислителя, и восстановителя
8. KMnO4 при взаимодействии с Na2S в растворе является
1) окислителем
2) восстановителем
3) донором электронов
4) окислителем и восстановителем в зависимости от условий протекания процесса
9. Коэффициент перед молекулой восстановителя в уравнении реакции
KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4+ H2O равен
1) 5 2) 2 3) 3 4) 1
10. Соединение, содержащее Mn+7, в кислой среде восстанавливается до:
1) Mn+4 2) Mn+6 3) Mn+2 4) Mn0
11. Частицы, которые присоединяют электроны, называются
1) окислителями 3) присоединителями
2) восстановителями 4) нет верного ответа
12. Окислительно-восстановительные реакции, в которых элемент-окислитель и элемент-восстановитель входит в состав молекул различных веществ, называются
1) внутримолекулярными 3) диспропорционирования
2) межмолекулярными 4) самоокисления-самовосстановления
13. Какое вещество может выступать только в роли окислителя
1) HCl 3) FeCl2
2) K2Cr2O7 4) CO
14. В уравнении окислительно-восстановительной реакции
Cu + HNO3(разб) = Cu(NO3)2 + NO + H2O
коэффициент перед окислителем
1) 8 2) 10 3) 6 4) 2
15. Окислительные свойства оксид серы (IV) проявляет в реакции
1) SO2 + NaOH = NaHSO3
2) SO2 + Br2 + 2H2O = H2SO4 + 2HBr
3) SO2 + 2H2S = 3S + 2H2O
4) 2SO2 + O2 = 2SO3
16. В каком направлении данная ОВР протекает самопроизвольно:
H2SO4 + 2HCl = Cl2 + H2SO3 + H2O, если φ0(Cl2/2Cl-) = 1.36B; φ0(SO42- /SO32-) = 0.22B
1) в прямом
2) в обратном
3) слева на право
4) определить нельзя
16. Укажите тип окислительно-восстановительной реакции
H2SO3 + H2S → S + H2O
1) внутримолекулярная
2) межмолекулярная
3) диспропорционирования
4) контрдиспропорционирования
18. Уравнением Al0- 3ẽ = Al+3 описывает
1) процесс окисления
2) процесс восстановления
3) процесс присоединения электронов
4) процесс изменения степени
19. Какую роль играет перекись водорода в уравнении реакции
H2O2 →Н2О + О2
1) окислителя 3) окислителя-восстановтеля
2) восстановителя 4) нельзя определить
20. В каком направлении данная ОВР протекает самопроизвольно:
2NaCl + Fe2(SO4)3 → 2FeSO4 + Cl2 + Na2SO4, если φ0(Cl2/2Cl-) = 1.36B; φ0(Fe3+ /Fe2+) = 0.77B
1) в прямом
2) обратном
3) слева на право
4) определить нельзя
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Химическая термодинамика рассматривает энергетические аспекты различных процессов и определяет условия их самопроизвольного протекания.
Химическая термодинамика является уникальной теорией; рассматривая только макроскопические свойства вещества может предсказать возможное поведение системы и ответить на вопрос: возможна ли химическая реакция (физико-химический процесс) в данных условиях или нет.
Первое начало (первый закон) термодинамики – это всеобщий закон природы, закон сохранения и превращения энергии, соответствующий основному положению диалектического материализма о вечности и неуничтожимости движения. Впервые этот закон в 1842 г. сформулировал выдающийся немецкий физик Ю. Мейер, врач по образованию.
Энергия не исчезает и не возникает из ничего, а только превращается из одного вида в другой в строго эквивалентных соотношениях.
В зависимости от вида системы первый закон термодинамики имеет различные формулировки.
В изолированной системе внутренняя энергия постоянна, т.е. ∆U = 0.
Для закрытой системы:
Если к закрытой системе подвести теплоту, то эта энергия расходуется на увеличение внутренней энергии системы и на совершение системой работы против внешних сил окружающей среды.
Математическое выражение первого закона термодинамики в интегральной форме имеет вид: Q = ΔU + W (1).
Здесь: ΔU – изменение внутренней энергии. Внутренняя энергия представляет собой общий запас энергии системы за вычетом кинетической энергии движения центра масс и потенциальной энергии системы. Этот общий запас включает энергию поступательного и вращательного движения молекул, энергию колебательного движения атомов и атомных групп, составляющих молекулы, энергию взаимодействия ядер и электронов, энергию взаимодействия нуклонов в ядре.
Абсолютное значение внутренней энергии не известно, т.к. не возможно перевести систему в состояние, где внутренняя энергия была бы равна нулю. Поэтому в термодинамических расчетах пользуются разностными значениями внутренней энергии (∆U). Измеряется внутренняя энергия в Дж или Дж/моль.
Теплота Q и работа W. Это две формы передачи энергии к системе и наоборот. Работа характеризует направленную передачу энергии, а теплота – хаотическую. Эти функции характеризуют не состояние, а процесс передачи энергии, и являются функциями процесса или функциями пути. Измеряются они в Дж или в Дж/моль. Теплота, переданная системе в ходе процесса, является отрицательной (теплота поглощается, Q < 0)), а такой процесс называется эндотермическим. Экзотермическим называется процесс, в котором теплота выделяется (передается от системы к окружающей среде). В этом случае теплота положительная (Q > 0).
Для системы идеального газа в зависимости от протекаемого процесса математический вид первого закона термодинамики меняется:
1. Для изотермического процесса (Т = const) ΔU = 0 и Q = W (2).
2. Для изохорного процесса (V=const) W=0 и QV =ΔU:
3. Для изобарного процесса (р=const).
Qр = ΔU + рΔV = (Uкон – Uнач) + (рVкон – рVнач) = (Uкон - рVкон) – (Uнач – рVнач).
Сумма внутренней энергии системы и произведения объема на давление (U + рV) называют энтальпией (Н). Поэтому Qр = ΔU + рΔV = Δ Н.
Энтальпия Н – это функция специально введенная в термодинамику, которая характеризует общий запас энергии системы при постоянном давлении (внутренняя энергия – при постоянном объеме). Абсолютное ее значение не известно, поэтому в расчетах используют ∆Н. Измеряется энтальпия в Дж или Дж/моль.
Энтальпия является функцией состояния системы. Одним из самых важных свойств функций состояния является следующее: при переходе системы из одного состояния в другое изменение функции состояния не зависит от пути перехода (процесса), а определяется лишь начальным и конечным её состояниями. К ним относят внутреннюю энергию U [Дж], энтальпию H [Дж], энтропию S [Дж/К], энергию Гиббса G [Дж], энергию Гельмгольца A [Дж].
Энтальпия системы является экстенсивным параметром и зависит от количества вещества, температуры и давления, поэтому изменение энтальпии в результате химической реакции или других процессов определяют при стандартных условиях.
Стандартные условия: количество вещества – 1 моль;
давление – 1 атм. = 760 мм рт. ст. = 101325 Па; температура – 298 К ≈ 250С.
В термодинамики для оценки энергетического состояния веществ используют значения стандартных энтальпий образования этих веществ, обозначаемые ∆Н0обр, кДж/моль и стандартных энтальпий сгорания - ∆Н0сг, кДж/моль.
Стандартная энтальпия образования простых веществ в их наиболее термодинамически устойчивом агрегатном и аллотропном состоянии при стандартных условиях принимается равной нулю.
Например, для кислорода ∆Н0обр(О2) = 0, для графита ∆Н0обр(Сграфита) = 0. Однако стандартная энтальпия образования озона ∆Н0обр(О3) = 142,2 кДж/моль, алмаза ∆Н0обр(Салмаз) = 1,8 кДж/моль.
Стандартная энтальпия образования сложных веществ равна энтальпии реакции получения 1 моль этого вещества из простых веществ при стандартных условиях.
Например, стандартная энтальпия образования этанола равна стандартной энтальпии гипотетической реакции: 2Сграфит + 3Н2(г) + 0,5О2(г) = С2Н5ОН (ж), ∆Н0f(С2Н5ОН) = -277 кДж/моль.
Стандартная энтальпия сгорания простейших (высших) оксидов в их наиболее устойчивых состояниях равна нулю.
Например, для воды ∆Н0сг(Н2О(ж)) = 0; для углекислого газа ∆Н0сг(СО2(г)) = 0 и т.д.
Стандартная энтальпия сгорания сложных веществ равна энтальпии реакции сгорания в атмосфере кислорода 1 моль вещества при стандартных условиях до простейших оксидов. При этом все участники реакции должны быть в устойчивых агрегатных состояниях.
Например, стандартная энтальпия сгорания этанола равна стандартной энтальпии реакции: С2Н5ОН + 7/2О2 = 2СО2 + 3Н2О, ∆Н0сг(С2Н5ОН) = -1370 кДж/моль.
Значения стандартных энтальпий образования и сгорания сложного вещества зависят от природы вещества и его агрегатного состояния. Числовые значения стандартных энтальпий образования (сгорания) веществ приводятся в справочниках.
Изучением тепловых эффектов (энтальпий) химических реакций и фазовых переходов занимается термохимия.
Энтальпию реакции можно определить как экспериментально, так и методом расчета с использованием стандартных энтальпий образования (сгорания) веществ, участвующих в химической реакции, на основе закона, открытого академиком РАН Г.И. Гессом (1840).
Тепловой эффект реакции, протекающей при постоянном давлении или объеме и при условии, что продукты реакции и исходные вещества имеют одинаковую температуру и отсутствуют другие виды работ, кроме работы расширения, не зависит от пути процесса, а определяется только начальным и конечным состоянием системы.
В термохимических расчетах большое значение имеют следствия из закона Гесса.
Первое следствие.
Тепловой эффект реакции (энтальпия реакции) равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ с учетом их стехиометрических коэффициентов:
 . (2)
. (2)
Это следствие позволяет вычислить энтальпии различных реакций (в том числе и биохимических, осуществление которых in vitro невозможно), используя табличные значения стандартных энтальпий образования продуктов реакции и исходных веществ.
Второе следствие.
Тепловой эффект реакции (энтальпия реакции) равен разности между суммой энтальпий сгорания исходных веществ и суммой энтальпий сгорания продуктов с учетом их стехиометрических коэффициентов:
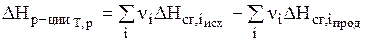 . (3)
. (3)
Третье следствие, известное также как закон Лавуазье – Лапласа.
Тепловой эффект образования соединения из данных веществ равен взятому с обратным знаком тепловому эффекту разложения данного соединения при этих же условиях до тех же исходных веществ.
DН0обр = -DН0cг. (4)
Из закона Гесса также следует, что неизвестная энтальпия реакции может быть получена путем алгебраического суммирования известных энтальпий соответствующим образом подобранных химических реакций.
Первый закон термодинамики и вытекающие из него законы термохимии позволяют составить энергетический баланс термодинамического процесса, но не позволяют сделать заключение о возможности и направлении химического процесса и состоянии равновесия.
Второй закон термодинамики позволяет судить о направлении самопроизвольных процессов и совместно с первым началом устанавливает множество точных количественных соотношений между различными макроскопическими параметрами систем в состоянии термодинамического равновесия.
Процессы, происходящие в определенном направлении без затрат энергии из внешней среды и завершающиеся установлением состояния равновесия, называют самопроизвольными (например, взрыв, коррозия, разряд аккумулятора). Несамопроизвольные процессы (например, заряд аккумулятора) требуют подвода энергии из внешнего источника.
Процессы, протекающие в реальной жизни, являются самопроизвольными и необратимыми. Обратимый процесс (равновесный процесс, который может возвратиться в первоначальное состояние без каких-либо энергетических изменений в окружающей среде или в самой системе под влиянием бесконечно малой силы) является идеализацией.
Во всех необратимых процессах осуществляется более равномерное распределение энергии и вещества, происходит выравнивание в системе температур и других интенсивных параметров. Разупорядоченность, или степень беспорядка системы может быть определена количественно и называется энтропией. Эту функцию ввел Клаузиус и обозначил буквой S. Подобно энтальпии энтропия является экстенсивным свойством системы и функцией состояния системы. Поэтому изменении энтропии в ходе химической реакции может быть найдено в соответствии с первым следствием из закона Гесса:  . (2)
. (2)
Формулировки второго начала термодинамики:
- Теплота не может самопроизвольно переходить от более холодного тела к более горячему (Клаузиус).
- Теплота наименее нагретого из тел системы не может служить источником работы, т.е. невозможно превращение только теплоты в работу, тогда как превращение работы в теплоту может быть единственным результатом процесса (Томсон).
- В изолированной системе самопроизвольные (необратимые) процессы происходят в направлении увеличения энтропии системы: dS > 0.
В случае открытых и закрытых систем энтропия не может быть критерием направленности процесс, т.к. кроме изменений в системе, необходимо учитывать изменения в окружающей среде. А это далеко не всегда возможно.
Для таких систем были введены специальные функции состояния, по изменению которых можно судить о направлении самопроизвольного процесса – термодинамические потенциалы.
В зависимости от системы и процесса роль термодинамического потенциала выполняют различные функции:
в изолированной системе (U=const и V=const) – энтропия;
изотермо- изобарный процесс - энергия Гиббса (G);
изотермо- изохорный процесс - энергия Гельмгольца (F);
при S=const и V=const - внутренняя энергия (U);
при S=const и p=const - энтальпия (H).
Термодинамические потенциалы являются критериями направления процесса: в ходе самопроизвольного процесса соответствующий термодинамический потенциал при постоянстве естественных переменных убывает: ∆US,V < 0; ∆HS,p < 0; ∆AT,V < 0; ∆Gp,T < 0, (энтропия – возрастает ∆SU,V > 0). При этом потенциал стремится к некоему экстремальному значению: энтропия – к максимуму, все остальные – к минимуму, которому соответствуют равновесное состояние системы. В состоянии равновесия изменения всех потенциалов становиться равным нулю.
Для процессов, происходящих на Земле и в живых организмах, наибольшее значение имеет изотермо-изобарный потенциал – энергия Гиббса. Биохимические реакции, сопровождающиеся уменьшением энергии Гиббса, называются экзэргоническими реакциями, они могут совершаться самопроизвольно. Биохимические реакции, сопровождающиеся увеличением энергии Гиббса, называются эндэргоническими, и они не возможны без внешнего подвода энергии. Например, процесс фотосинтеза в растениях идет только под воздействием солнечной энергии. В живых организмах эндэргонические реакции происходят за счет их сопряжения с экзэргоническими реакциями.
Рассчитать стандартную энергию Гиббса можно по уравнениям:
1) Уравнение изотермы: ∆G0 = -RTlnKp.
2) Следствие из закона Гесса:
∆G0298 = å(ni∆G0i)прод - å(ni∆G0i)реаг.
3) Уравнение Гиббса – Гельмгольца: ∆G0 = ∆Н0 - Т∆S0 (при условии, что все составляющие уравнения взяты при одинаковой температуре).
Примеры решения задач
Пример 1.
В результате реакции, термохимическое уравнение которой:
4NO2 + O2 = 2N2O5 + 109,4 кДж
выделилось 27350 Дж теплоты. Рассчитать массу затраченного кислорода и объем израсходованного оксида азота (IV) (при н.у.).
Решение:
Выделение или поглощение теплоты в ходе реакции происходит в строго эквивалентных количествах, поэтому:
При участии 4 моль NO2 выделяется 109400 кДж теплоты,
А при участии х моль NO2 - 27350 кДж теплоты:
Отсюда х равен: х = 4∙27350/109400 = 1 моль.
Объем оксида азота (IV) при н.у. может быть найден по формуле: V = n ∙ Vm.
V(NO2) = 1 ∙ 22,4 = 22,4 л.
Составим пропорцию для нахождения массы кислорода:
1 моль О2 – 109400 кДж теплоты;
х моль О2 – 27350 кДж теплоты.
Отсюда: х = 1 ∙ 27350 / 109400 = 0,25 моль.
Масса кислорода: m(O2) = n ∙ M = 0,25 ∙ 32 = 8 г.
Ответ: Масса затраченного кислорода равна 8 г, а объем оксида азота 22,4 л.
Пример 2.
Рассчитать стандартную энтальпию сгорания этанола, если известно, что при сгорании 4,6 г спирта выделяется 137 кДж теплоты.
Решение:
Тепловой эффект реакции (теплота) и энтальпия равны по значению, но притивоположны по знаку, следовательно, энтальпия сгорания 4,6 г спирта составляет -137 кДж.
По определению, стандартная энтальпия сгорания, это энтальпия сгорания 1 моль вещества. Определим, сколько моль составляет 4,6 г спирта:
n = m / M = 4,6 / 46 = 0,1 моль.
Составим пропорцию:
Энтальпия сгорания 0,1 моль составляет -137 кДж;
А энтальпия сгорания 1 моль - х кДж;
Отсюда: х = 1 ∙ (-137) / 0,1 = -1370 кДж.
Ответ: - 1370 кДж/моль.
Пример 3.
При образовании 134 г СО2 выделилось 787 кДж теплоты. Определить стандартную энтальпию сгорания углерода.
Решение:
Образование углекислого газа и сгорания углерода до высшего оксида – это одна и та же реакция:
С + О2 = СО2,
энтальпия которой и является стандартной энтальпией сгорания С и стандартной энтальпией образованияСО2.
Поэтому определим по имеющимся данным стандартную энтальпию образования СО2, т.е. энтальпию образования 1 моль СО2. Учтем, что энтальпия и тепловой эффект реакции равны по величине, но противоположны по знаку.
Рассчитаем количество вещества СО2: n = m / M = 134 / 44 = 3 моль.
Составим пропорцию:
Энтальпия образования 3 моль СО2 составляет -787 кДж,
а энтальпия образования 1 моль СО2 – х кДж;
Отсюда: х = 1 ∙ (-787) / 3 = -262,3 кДж.
Ответ: Энтальпия сгорания С равна - 262,3 кДж/моль.
Пример 4.
Определить тепловой эффект реакции синтеза диэтилового эфира, применяемого в медицине для наркоза, при 298К;
2С2Н5ОН(ж) = С2Н5ОС2Н5(ж) + Н2О (ж),
если известны стандартные энтальпии сгорания веществ, участвующих в реакции:
ΔН0с (С2Н5ОС2Н5(ж)) = -2727 кДж/моль;
ΔН0с (С2Н5ОН(ж)) = -1371 кДж/моль;
ΔН0с (Н2О(ж)) = 0 кДж/моль.
Решение:
Используя второе следствие из закона Гесса, получим:
ΔН0r = [2ΔН0с (С2Н5ОН(ж))] - [ΔН0с (С2Н5ОС2Н5(ж)) + ΔН0с (Н2О(ж))] = [2(-1371)] - [(-2727) + 0] = - 15 кДж/моль.
Ответ: ΔН0r = - 15 кДж/моль – процесс экзотермический.
Пример 5.
Вычислить энергию Гиббса тепловой денатурации трипсина при 50°С, если DН0298 = 283 кДж/моль, DS0298 = 288 Дж/моль∙К. Протекает ли эта реакция в данных условиях? Считать, что энтальпия и энтропия в данном интервале температур являются постоянными.
Решение:
Согласно уравнению Гиббса – Гельмгольца: DG0T = DН0T - TDS0T:
DG0323 = 283 кДж/моль - 323∙288∙10-3 кДж/моль = 190 кДж/моль.
Ответ: DG0323 = 190 кДж/моль > 0, реакция самопроизвольно не протекает.






