Вариант 1.
1. Какая реакция лежит в основе протолитометрии?
1. 2J- - 2e = J2 3. Ag+ + CI- = AgCI
2. H+ + OH- = Н2О 4. Сu+2 + 4NH3 = [Cu(NH3)4]2+
2. Какие объемы (см3) 0,01 моль/дм3 раствора НС1 и воды нужно взять для приготовления 500 см3 0,005 моль/дм3 раствора соляной кислоты?
1. 100 и 400 3. 250 и 250
2. 10 и 490 4. 400 и 100
3. Выберите наиболее сильный окислитель:
1. NO3- ; Eo  = + 0,94 B
= + 0,94 B
2. MnO4- ; Eo 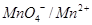 = +1,51 B
= +1,51 B
3. Fe3+; Eo  = +0,77 B
= +0,77 B
4. MnO4-; Eo  = 0,77 B
= 0,77 B
4. Укажите стехиометрические коэффициенты перед окислителем в реакции
FeSO4 + KMnO4 + H2SO4 ® Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
1. 2 3. 10
2. 5 4. 1
5. При иодометрическом определении аскорбиновой кислоты в модельном растворе (1) и яблочном соке (П) на титрование затрачены следующие объемы (см3) раствора тиосульфата натрия:
1. 2,95; 2,85; 3,10; 3,05; 3,00
П. 2,90; 3,40; 3,65; 2,75; 2,60
При каком титровании воспроизводимость результатов выше?
1. При титровании модельного раствора
2. При титровании яблочного сока
Вариант 2.
1. Вычислить титр (мг/см3) 0,01 моль/дм3 раствора Н2С2 О4
1. 4,50×10-2 3. 0,45
2. 9,00×10-3 4. 0,90
2. На титрование 10,0 см3 молока затрачено 1,95 см3 0,1 моль/дм3 раствора
NaOH. Вычислите кислотность молока в градусах Тернера.
1. 9,75 3. 19,5
2. 0,97 4. 1,95
3. Укажите наиболее сильный восстановитель:
1. Fe2+ Eo  = 0,77 B
= 0,77 B
2. Feo Eo  = -0,44B
= -0,44B
3. H2S Eo  = +0,14B
= +0,14B
4. Sn2+ Eo 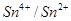 = -0,15B
= -0,15B
4. Скачок на кривой титрования находится в интервале +0,9… +1,3В.
Какой редокс-индикатор применим для фиксирования точки
стехиометричности:
1. Дифенилбензидил; ЕоInol= + 0,78; n= 1
2. Дифениламин; ЕоInol= + 0,76; n= 2
3. Этоксихризоидин; ЕоInol= + 1,00;n= 2
5. Рассчитайте жесткость воды, если на титрование 100,0 см3 её
затрачено 9,50 см3 0,05 моль/дм3 раствора комплексона Ш. Сделайте
вывод о качестве воды. Анализируемая вода является
1. Мягкой 3. Жёсткой
2. Средней жесткости. 4. Очень жесткой
Вариант 3.
1. Как называется метод анализа, в котором титрантом является щелочь?
1. Алкалиметрия 3. Комплексонометрия
2. Ацидиметрия 4. Трилонометрия
2. Рассчитайте массу (г) гидроксида натрия в 500 см3 раствора с титром
6,0 мг/см3
1. 0,6 3. 0,3
2. 1,5 4. 3,0
3. На титрование 10,00 см3 раствора щавелевой кислоты с Сэк.(Н2С2О4), равной 0,10 моль/дм3 затрачено 12,5 см3 раствора перманганата калия. Найдите Сэк.(КМnО4).
1. 0,064 3. 0,032
2. 0,020 4. 0,010
4. При каких условиях происходит окислительно-восстановительный процесс?
1. ЭПС > 0 3. ЭПС = 1
2. ЭПС< 0 4.ЭПС = 0
5. На титрование раствора соли кальция израсходовано 15 см3 0,05 моль/дм3 раствора комплексона Ш. Вычислите массу (г) Са2+ в данном растворе.
1. 0,0300 3. 0,0600
2. 0,0150 4. 0,0075
Вариант 4.
1. Как называется метод анализа, в котором титрантом является кислота?
1. Алкалиметрия 3. Редоксиметрия
2. Ацидиметрия 4. Комплексонометрия
2. Какой объем воды (см3) нужно добавить к 15 см3 0,1 моль/дм3 раствора уксусной кислоты, чтобы получить 0,05 моль/дм3 раствор?
1. 10 3. 30
2. 15 4. 7,5
3. Титр раствора КМпО4 равен 6,32×10-4 г/см3; рН= 3. Вычислите Сэк.(КМпО4).
1. 4,0×10-3 3. 2,0×10-2
2. 1,2×10-2 4. 2,0×10-3
4. Укажите окислительно-восстановительную пару, на потенциал которой влияет рН среды.
1. J2/2J- 3. Fe3+/Fe2+
2. MnO4-/Mn2+ 4. Sn4+/Sn2+
5. При иодометрическом определении лактозы в продукте детского питания, получены следующие результаты (мас.%): 4,87; 4,96; 4,80; 4,90. Рассчитайте относительную погрешность определения.
1. 1% 3. 0,028 мас.%; 0,5%
2. 0,112 мас. %; 2% 4. 0,280 мас. %; 5%
Вариант 5.
1. В каком случае при титровании наблюдается больший скачок рН на кривой титрования?
1. HCl ¾ NaOH 3. H2C2O4 ¾ NaOH
2. CH3COOH ¾ NaOH 4. NH4OH ¾ HCl
2. Рассчитайте массу (г) гидроксида натрия в 250 см3 раствора с титром
12,0 мг/см3.
1. 0,6 3. 0,3
2. 1,5 4. 3,0
3. Составьте уравнение реакции установления концентрации перманганата калия по щавелевой кислоте с помощью электронных и электронно-ионных уравнений. Подсчитайте сумму коэффициентов.
1. 31 3. 21
2. 36 4. 41
4. Какими окислительно-восстановительными свойствами обладает пара J2/2J-?
1. Восстановительными
2. Окислительными
3. И восстановительными, и окислительными свойствами
4. Ни восстановительными, ни окислительными свойствами
5. На титрование 100 мл воды израсходовано 14 см3 0,02 моль/дм3
раствора комплексона Ш. Рассчитайте общую жесткость воды
(моль/дм3).
1. 5,8 3. 11,6
2. 2,8 4. 1,5
Вариант 6
1. Почему нельзя приготовить по точной массе навески раствор гидроксида натрия с точно известной концентрацией?
1. Гидроксид натрия гигроскопичен
2. Гидроксид натрия поглощает из воздуха вещества с кислотными свойствами
3. Состав раствора изменяется при хранении
4. Ответы даны в пунктах 1,2,3.
2. Рассчитайте титр (г/см3) 0,02 моль/дм3 раствора уксусной кислоты.
1. 1,2×10-3 3. 1,2×10-2
2. 6,0×10-2 4. 6,0×10-3
3. Какие реакции лежат в основе методов редоксиметрии?
1. Реакция нейтрализации
2. Реакция комплексообразования
3. Реакция окисления-восстановления
4. Реакция осаждения.
4. По значениям стандартных редокс-потенциалов определите, какие ионы окисляются водными растворами иода. (Ео  = +0,54 В)
= +0,54 В)
1. Ионы Sn2+ (Eo 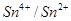 = +0,54B)
= +0,54B)
2. Ионы С1- (Ео  = +1,36 B)
= +1,36 B)
3. Ионы Вr- (Eo 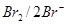 = +1,07B)
= +1,07B)
4. Ионы Аg+ (Eo 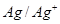 = +0,80 B)
= +0,80 B)
5. Используя Q- критерий, установите грубую погрешность в результатах определения массы Fe+3 в контрольном растворе (мг): 0,2600; 0,2590; 0,2595; 0,2592.
1. Все результаты достоверны 3. 0,2600
2. 0,2590 4. 0,2600 и 0,2590
Вариант 7.
1. Как называется интервал значений рН, в пределах которого происходит изменение окраски индикатора?
1. Показателем титрования
2. Показателем индикатора
3. Областью перехода индикатора
4. Конечной точкой титрования.
2. Рассчитайте концентрацию (моль/дм3) раствора уксусной кислоты с титром 1,60×10-2 мг/см3.
1. 1,33×10-3 3. 2,60×10-2
2. 2,60×10-2 4. 2,67×10-3
3. Что используют для характеристики окислительно-восстановительных процессов?
1. Значение редокс-потенциала
2. Величину степени окисления
3. Число отданных или принятых электронов
4. Величину электроотрицательности элемента.
4. Составьте уравнение реакции перманганатометрического определения содержания железа (П) в растворе с помощью электронных или электронно-ионных уравнений. Подсчитайте сумму коэффициентов.
1. 25 3. 28
2. 46 4. 36
5. Среднее арифметическое значение пяти определений кислотности молока (К) равно 20,50оТ. Вероятная абсолютная погрешность D  = ±0,05 Т (Р=0,95). Рассчитайте относительную погрешность определения (%).
= ±0,05 Т (Р=0,95). Рассчитайте относительную погрешность определения (%).
1. 0,2400 3. 0,0024
2. 4,1000 4. 0,4100
Вариант 8
1. Как называется значение рН, при котором происходит наиболее резкое изменение окраски индикатора?
1. Показателем титрования
2. Показателем индикатора
3. Точкой эквивалентности
4. Интервалом перехода индикатора
2. До какого объема (см3) следует разбавить 10 см3 0,1 моль/дм3 раствора СН3СООН, чтобы получить 0,01 моль/дм3 раствор?
1. 250 3. 500
2. 1000 4. 100
3. Как вычислить молярную массу эквивалента железа Fe (П) при перманганатометрическом титровании?
1. М/1 3. М/3
2. М/2 4. М/5
4. Чему равен стехиометрический коэффициент перед НС1 в реакции:
NaNO2 + NaJ + HC1® NO + J2 + NaC1 + H2O
1. 1 3. 3
2. 2 4. 4
5. При стандартизации раствора НС1 получены следующие результаты (моль/дм3): 0,1002; 0,0998; 0,1000; 0,0990. Используя Q-критерий, установите, какой результат следует исключить из расчета среднего значения концентраций НС1 (Р=0,99).
1. Все результаты достоверны 3. 0,1002
2. 0,1002 и 0,0990 4. 0,0990
Вариант 9
1. Какие индикаторы применяются в методе кислотно-основного титрования?
1. Индикаторы-реагенты
2. Адсорбционные индикаторы
3. рН-индикаторы
4. Редокс-индикаторы
2. Рассчитайте концентрацию (моль/дм3) гидроксидов-ионов в растворе с рН=2
1. 10-10 3. 10-2
2. 10-12 4. 10-4
3. Чему равен стехиометрический коэффициент перед окислителем в реакции:
КМпО4 + H2C2O4 + H2SO4 ® MnSO4 + CO2 + K2SO4 + H2O
1. 1 3. 5
2. 2 4. 10
4. Сколько электронов примет окислитель в процессе восстановления:
Сr2O72- +? Н+ +?  ® 2Cr3+ +? Н2О
® 2Cr3+ +? Н2О
1. 1 3. 3
2. 2 4. 6
5. Границы доверительного интервала при определении жесткости воды 5,35 ± 0,04 ммоль/дм3 (п=6; Р=0,95). Вычислите дисперсию
1. 0,07 3. 0,02
2. 0,04 4. 0,03
Вариант 10
1. На титрование 10,00 см3 раствора Na2СО3 в присутствии метилового оранжевого затрачено 10,50 см3 0,500 моль/дм3 раствора НС1. Рассчитайте молярную концентрацию эквивалента раствора карбоната натрия (моль/дм3).
1. 1,0500 3. 0,2625
2. 0,5250 4. 0,1312
2. Вычислите титр (г/см3) раствора, в 300 см3 которого содержится 12,9 г
гидроксида калия.
1. 0,0430 3. 0,4030
2. 0,4300 4. 0,0043
3. Чему равен стехиометрический коэффициент перед восстановителем в реакции:
КМпО4 + FeSO4 + H2SO4 ®MnSO4 + Fe2(SO4)3 + K2SO4 + H2O
1. 2 3. 5
2. 3 4. 10
4. Рассчитайте титр (мг/см3) раствора KJ, в 100 см3 которого содержится
0,0525 г соли.
1. 0,052500 3. 0,525000
2. 0,000525 4. 0,105000
5. Массовая доля аскорбиновой кислоты в техническом препарате по
результатам семи определений (%): 81,7; 83,5; 80,0; 85,0; 84,5;
80,5; 79,0.
Какой результат нельзя применять для статистической обработки дан-
ных (Р=0,95)?
1. Все результаты достоверны
2. Исключить 79,0
3. Исключить 79,0 и 85,0
4. Исключить 85,0
Вариант 11
1. Какой закон лежит в основе расчетов титриметрического анализа?
1. Закон сохранения массы.
2. Закон эквивалентов
3. Закон постоянства состава
4. Закон кратных отношений
2. Рассчитайте массу (г) уксусной кислоты в 400 г раствора с титром 0,348 мг/см3.
1. 0,1392 3. 1,392×10-3
2. 1,392×10-2 4. 1,3920
3. Для чего нужны кривые титрования по методу редоксиметрии?
1. Для вычисления редокс-потенциала
2. Для выбора редокс-индикатора
3. Для установления точки эквивалентности
4. Для вычисления рН раствора.
4. Чему равен стехиометрический коэффициент перед окислителем в реакции:
K2Cr2O7 + FeSO4 + H2SO4 ® Cr2(SO4)3 + Fe2(SO4)3 + K2SO4 + H2O
1. 1 3. 3
2. 2 4. 6
5. Укажите среду, в которой возможно комплексонометрическое определение общей жесткости воды
1. Щелочная 3. Кислая
2. Нейтральная 4. Сильнокислая
Вариант 12
1. Какая относительная ошибка допустима в методах титриметрии?
1. 0,1% 3. 1%
2. 0,5% 4. 5%
2. Рассчитайте концентрацию (моль/дм3) раствора щавелевой кислоты, в 10 см3 которого содержится0,0252 г двуводородного кристаллогидрата кислоты.
1. 0,1 3. 0,01
2. 0,2 4. 0,02
3. Чему равен стехиометрический коэффициент перед окислителем в реакции
K2Cr2O7 + KJ + H2SO4 ® Cr2(SO4)3 + J2 + K2SO4 + H2O
1. 1 3. 3
2. 2 4. 6
4. Какой ион можно окислить азотной кислотой, если Ео  =+1,5o1В?
=+1,5o1В?
1. F-; Eo  = + 2,87 B
= + 2,87 B
2. Br-; Eo 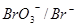 = + 1,45 B
= + 1,45 B
3. Cl-; Eo  = + 1,36 B
= + 1,36 B
4. Fe2+; Eo  = + 0,77 B
= + 0,77 B
5. Какой фактор обусловливает окраску индикатора в точке стехиометричности при определении общей жесткости воды?
1. Изменение рН раствора
2. Окраска комплексного соединения металла с индикатором
3. Собственная окраска индикатора
4. Окраска комплексного соединения катионов кальция и магния с комплексоном Ш.
Вариант 13
1. К 100 см3 раствора гидроксида натрия (С  = 0,1моль/дм3) прибавили 100 см3 хлороводородной кислоты (С
= 0,1моль/дм3) прибавили 100 см3 хлороводородной кислоты (С  = 0,1 моль/дм3). По какой формуле нужно вычислить рН в данной точке титрования?
= 0,1 моль/дм3). По какой формуле нужно вычислить рН в данной точке титрования?
1. рН = рОН = 7 3. рН = 14 + lgCосн.
2. рН = - lgСкисл. 4. рН = ½ рКкисл.-1/2 lgСкисл.
2. Что называется титром раствора?
1. Масса вещества (г), содержащаяся в 1 дм3 раствора
2. Масса вещества (г), содержащаяся в 1 см3 раствора
3. Масса вещества (г), содержащаяся в 1 см3 растворителя
4. Число моль вещества, содержащаяся в 1 дм3 раствора
3. Чему равен коэффициент перед восстановителем в реакции:
КМnО4 + Н2S+ H2SO4 ®MnSO4 + S + K2SO4 + H2O
1. 1 3. 5
2. 2 4. 10
4. Рассчитайте содержание в (г) Fe2+ в растворе, на титрование которого израсходовано 12,00 см3 раствора перманганата калия с титром
0,1264 мг/см3.
1. 0,0076 3. 0,0027
2. 0,0480 4. 0,0144
5. Какая группа атомов комплексона Ш образует с ионами кальция и магния главную (ионную) связь:
1. - СООН 3. - COONa
2. - N = 4. - CH2 -
Вариант 14
1. Что такое кривые кислотно-основного титрования?
1. Графическое изображение изменения рН раствора в процессе титрования.
2. Графическое изображение изменения окраски индикатора в процессе титрования.
3. Графическое изображение изменения индикаторных форм в процессе титрования.
4. Графическое изображение изменения объемов кислоты и основания в процессе титрования.
2. Рассчитайте массу (г) уксусной кислоты в 800 см3 раствора с титром
0,348 мг/см3
1. 0,2784 3. 2,784×10-3
2. 2,784×10-2 4. 2,7840
3. Что называется стандартным редокс-потенциалом?
1. Потенциал пары, измеренный при температуре 0оС.
2. Потенциал пары, измеренный при температуре 18 - 25оС, концентрации ионов окислителя и восстановителя равны.
3. Потенциал пары, измеренный при температуре 18 - 25оС, активной концентрации ионов 1 моль/дм3со стандартным водородным электродом.
4. Потенциал пары, измеренный при температуре 0оС, при активной концентрации ионов 1 моль/дм3.
4. Чему равен стехиометрический коэффициент перед восстановителем в реакции:
КМnО4 + KJ + H2SO4 ®MnSO4 + J2 + K2SO4 + H2O
1. 2 3. 6
2. 5 4. 10
5. Какая группа атомов комплексона Ш образует с ионами кальция и магния координационную связь?
1. - СООН 3. - COONa
2. - N = 4. - CH2 -
Вариант 15
1. Для какой системы скачок на кривой титрования больше:
1. HCl - NaOH 3. NH4OH - HCl
2. CH3COOH - NaOH 4. CH3COOH - NH4OH
2. В какой области рН находится точка стехиометричности сильной кислоты слабым основанием
1. рН = 7 3. рН < 7
2. рН > 7
3. Рассчитайте концентрацию (моль/дм3) ионов гидроксида в растворе при рН = 3.
1. 10-3 3. 10-10
2. 10-11 4. 10-7
4. Вычислите молярную массу эквивалента КМпО4 при рН = 4
1. 158,03 3. 31,61
2. 79,01 4. 51,61
5. Какие соли создают постоянную жесткость воды?
1. Ca(HCO3)2; Mg(HCO3)2
2. CaCl2; CaSO4 ; MgCl2; MgSO4
3.. Ca(HCO3)2; CaCl2
4. Mg(HCO3)2; MgSO4






