Реактивы:
- хлорная вода;
- 10% раствор KI;
- 0,05 н раствор тиосульфата натрия Na2S2O3;
- раствор крахмала.
Выполнение работы
1. Бюретку № 1 заполнить хлорной водой, бюретку № 2 заполнить раствором йодида калия, в бюретку № 3 залить раствор тиосульфата натрия. В коническую колбу отмерить 20 мл хлорной воды и 10 мл йодида калия. Выделившийся йод титровать раствором тиосульфата натрия до соломенно-желтой окраски. Затем добавить 1 каплю раствора крахмала и дотитровать синий раствор до обесцвечивания.Титрование повторить три раза, результаты занести в таблицу:
| Объем хлорной воды, мл | Объем Na2S2O3, мл |
| 20,0 20,0 20,0 | V1 = V2 = V3 = |
Вычислить среднее значение, мл
V (Na2S2O3) СР. = 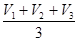
На основании полученных данных рассчитать содержание хлора (в г на 1 л воды):
m = T (Na2S2O3/Cl) ×V ×50, где
Т (Na2S2O3/С1) – титр раствора тиосульфата натрия по хлору;
V – объем раствора тиосульфата натрия, затраченный на титрование, мл;
50 – коэффициент для пересчета на 1 л воды.
Титр раствора тиосульфата натрия по хлору Na2S2O3/Cl определяют по формуле:
Т(Na2S2O3/Cl = MЭК(Cl)×CЭК.(Na2S2O3), где
МЭК. (С1) = 35,5 г/моль, а СЭК.(Na2S2O3) = 0,05. Следовательно,
Т(Na2S2O3/Cl) = 35,5 × 0,05 = 1,775
Вопросы для самоконтроля
1. В чем особенность перманганатометрического титрования?
2. Как готовят рабочий раствор перманганата калия?
3. Раствор какого вещества можно использовать для стандартизации раствора перманганата калия?
4. Как вычислить молярную массу эквивалента КМпО4: а) в кислой среде; б) в нейтральной среде; с) в щелочной среде?
5. На чем основано дихроматометрическое титрование восстановителей?
6. В чем преимущества дихромата калия перед перманганатом калия?
7. Какой индикатор используют при дихроматометрическом определение железа (П)? В чем принцип его действия?
8. Что такое «прямое» и «обратное» титрование?
9. На чем основано йодометрическое определение восстановителей и окислителей?
10. Дайте характеристику рабочих растворов в йодометрии.
11. Перечислите условия проведения йодометрического титрования.
12. При помощи какого индикатора фиксируется точка эквивалентности в йодометрии? В чем особенность его действия?
Задачи
1. Используя метод электронного баланса, найдите коэффициенты в уравнениях следующих окислительно-восстановительных реакций и определите молярные массы эквивалентов окислителя и восстановителя:
1). К2Сr2O7 + KI + H2SO4 ®Cr2(SO4)3 + I2 + K2SSO4 + H2O
2). KMnO4 + MnSO4 + H2O ® MnO2 + K2SO4 + H2SO4
3). KMnO4 + NaNO2 + H2SO4 ® MnSO4 + NaNO3 + K2SO4 + H2O
4). Cr2(SO4)3 + KMnO4 + KOH ® MnO2 + K2Cr2O7 + K2SO4 + H2O
5). KMnO4 + Na2C2O4 + H2SO4® MnSO4 + CO2 + K2SO4 + Na2SO4 + H2O
6). Cr2O3 + KNO3 + KOH ® K2CrO4 + KNO2 + H2O
7). CrCl3 + Cl2 + KOH ® K2CrO4 + KCl + H2O
8). FeCl2 + H2SO4(к) ® Fe2(SO4)3 + SO2 + HCl + H2O
9). KI + H2SO4 ® I2 + S + K2SO4 + H2O
10). H2S + HNO3 ® H2SO4 + NO + H2O
11). K2Cr2O7 + HCl ® CrCl3 + Cl2 + H2O + KCl
12). KMnO4 + HCl ® MnCl2 + Cl2 + KCl + H2O
13). MnO2 + HCl ® MnCl2 + Cl2 + H2O
14). Fe(OH)2 + NO2 ® Fe(NO3)3 + NO + H2O
15). FeSO4 + KMnO4 + KOH ® Fe(OH)3 + K2MnO4 + K2SO4
1. Сколько граммов перманганата калия надо взять, чтобы получить 0,1 л
0,1 н раствора для применения его в кислой среде?
2. Сколько граммов перманганата калия КМnO4 надо взять, чтобы получить 0,2 л 0,15 н раствора для применения его в щелочной среде?
3. Какова молярная концентрация эквивалента раствора перманганата калия в кислой среде, если титр его равен 0,3161×10-3 г/мл?
4. Какова молярная концентрация эквивалента раствора дихромата калия К2Сr2О7 в кислой среде, если титр данного раствора равен 4,9×10-3 г/мл?
5. Какова молярная концентрация эквивалента раствора сульфита натрия Na2SO3 в реакции взаимодействия с перманганатом калия КМnО4 в кислой среде, если известно, что титр раствора сульфита натрия равен 2,52×10-3 г/мл?
6. Щавелевая кислота Н2С2О4 взаимодействует с перманганатом калия КМпО4 в кислой среде. Чему равна молярная концентрация эквивалента раствора щавелевой кислоты, если титр его равен 6,303×10-4 г/мл?
7. Определить молярную концентрацию эквивалента раствора железного купороса FeSO4×7H2O в реакции взаимодействия его с раствором перманганата калия Т (FeSO4×7H2O) = 55,6 ×10-3г/мл
8. Определить молярную концентрацию эквивалента раствора тиосульфата натрия Na2S2O3×5Н2О в реакции взаимодействия его с йодом I2, если известно, что титр раствора тиосульфата натрия равен 0,248×10-2 г/мл.
9. Навеску перманганата калия КМnО4 0,9375 г растворили и довели объем раствора водой до 500 мл. Вычислить молярную концентрацию эквивалента раствора для реакции в щелочной среде.
10. Навеску перманганата калия KMnO4 0,9375 г растворили и довели объем раствора водой до 1000 мл. Вычислить молярную концентрацию эквивалента раствора для реакции в кислой среде.
11. Навеску перманганата калия КМnО4 0,2344 г растворили и довели объем раствора водой до 125 мл. Вычислить титр раствора и молярную концентрацию эквивалента для реакции в кислой среде.
12. Определить титр раствора перманганата калия в кислой среде, если молярная концентрация эквивалента его равна 0,1 н.
13. Сколько литров 0,15 н раствора перманганата калия КМпО4 для применения его в щелочной среде может быть получено из навески 3,1608 г
14. Чему равен титр раствора щавелевой кислоты Н2С2О4×2Н2О, если молярная концентрация эквивалента его равна 0,1 н и если известно, что данный раствор взаимодействует с перманганатом калия КМпО4 в кислой среде?
15. Какой объем (л) 0,1 н раствора перманганата калия КМпО4 для применения его в кислой среде может быть получено из навески 1,5804 г?
Тестовый контроль.






