Методом дихроматометрии
В основе определения лежит реакция:
 К2Сr2О7 + 6FeSO4 + 7H2SO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
К2Сr2О7 + 6FeSO4 + 7H2SO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
2Сr6+ +6e ® 2Cr3+ 1
2Fe2+ -2e ® 2Fe3+ 3
или
 Cr2O72- + 6e + 14 H+ = 2Cr3+ + 7 H2O 1
Cr2O72- + 6e + 14 H+ = 2Cr3+ + 7 H2O 1
2Fe2+ - 2e = Fe3+ 3
Реактивы:
- раствор К2Сr2О7;
- раствор Н2SO4 1:4;
- концентрированный раствор Н3РО4;
- раствор дифениламина.
Выполнение работы
1. Бюретку заполнить раствором К2Cr2O7. В мерную колбу объемом 100 мл получить у лаборанта кафедры раствор сульфата железа (П) и довести объем раствора дистиллированной водой до метки. В колбу для титрования отмерить пипеткой 10 мл приготовленного раствора соли железа (П) прибавить с помощью цилиндров 5 мл серной кислоты, 3 мл ортофосфорной кислоты и добавить одну каплю дифениламина (последовательность прибавления реактивов соблюдать строго!)
Затем полученную смесь титровать раствором К2Сr2О7 до появления устойчивой синей окраски раствора. Титрование повторить три раза. Результат записать в таблицу и рассчитать среднее значение.
| Объем FeSO4, мл | Объем К2Сr2О7, мл |
| 5,0 5,0 5,0 | V1 = V2 = V3 = |
V (K2Cr2O7)СР. = 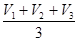
2. На основании полученных данных произвести расчет эквивалента сульфата железа, моль/л
СЭк (FeSO 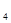 ) =
) = 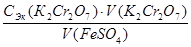
3. Рассчитать титр раствора FeSO4, г/мл
Т (FeSO4) = 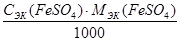 , где
, где
МЭК (FeSO4) = 
4. Определить содержание сульфата железа в объеме мерной колбы, в граммах
m (FeSO4) практ. = Т (FeSO4) ×100
5. У преподавателя узнать теоретическое содержание сульфата железа(П) и рассчитать абсолютную и относительную погрешность определения.
Абсолютная погрешность:
DХАБС. = m (FeSO4)ТЕОР. – m (FeSO4)ПРАКТ.
Относительная погрешность:
DХОТН. = 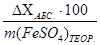
Йодометрия
Сущность метода
Йодометрическое титрование основано на окислительно-восстановительных реакциях с участием свободного йода I2 и йодид-анионов I-.
Свободный йод ведет себя в реакциях как окислитель:
I2 + 2e = 2I-
Используя раствор свободного йода в качестве титранта, определяют количество восстановителей в исследуемом растворе.
Индикатором в данном случае является раствор крахмала, который образует с йодом комплекс синего цвета. Раствор крахмала добавляют при этом к анализируемому раствору и затем титруют раствором элементарного йода до появления неисчезающей синей окраски.
Йодид-анионы играют роль восстановителей:
2I- - 2e = I2
С помощью йодид-ионов можно определить концентрацию окислителей в растворе. При этом используют метод обратного титрования. К исследуемому раствору прибавляют избыток йодида калия, из которого окислитель выделяет строго эквивалентное количество элементарного йода. Последний оттитровывают в присутствии крахмала раствором восстановителя, как правило тиосульфатом натрия (Na2S2O3) до обесцвечивания раствора.
I2 + 2 Na2S2O3 = 2NaI + Na2S4O6
Структурно реакцию можно представить так:



 О ОNa O ONa
О ОNa O ONa

 S S
S S


 O SNa O S
O SNa O S
+ I2 ® 2 NaI +



 О SNa O S
О SNa O S



 S S
S S
О ONa O ONa
Тиосульфат натрия Тетратионат натрия Na2S4O6
Следовательно, в йодометрии применяют два рабочих раствора. Рабочий раствор элементарного йода используют при определении количества восстановителя в растворе. При определении количества окислителя рабочим раствором является тиосульфат натрия. Метод йодометрического титрования является достаточно точным. При проведении анализа необходимо соблюдать следующие условия:
- титрование проводить на холоду, так как повышение температуры снижает чувствительность крахмала как индикатора;
- титрование проводить спустя 3 – 5 минут с момента сливания растворов, выдерживая реакционную смесь в темноте; это необходимо потому, что образование I2 происходит во времени и под действием света протекает нежелательная побочная реакция окисление ионов йода в элементарный йод;
- йодометрическое определение необходимо проводить в кислой среде, так как ионы водорода способны увеличивать скорость окисления ионов йода I- до элементарного йода I2;
- при определении окислителей необходимо применять избыток раствора йодида калия. Это необходимо для смещения реакции в нужном направлении, а также для повышения растворимости молекулярного иода, который плохо растворим в воде и может выпасть в осадок. В присутствии же избытка йодида калия образуется хорошо растворимый, но мало устойчивый комплекс по схеме:
I2 + KI = K[I3]
При титровании тиосульфатом равновесие этой реакции смещается влево, в раствор поступают все новые количества йода. Кроме того, крахмал адсорбирует значительные количества йода и очень медленно отдает их в раствор. Поэтому, чтобы избежать ошибки при титровании йода тиосульфатом, крахмал добавляют в самом конце, когда йода в растворе остается мало и бурая жидкость становится бледно-желтой.
В практике химического анализа йодометрическое титрование применяют для определения хлора в хлорной извести, брома в природных водах, меди в солях и рудах, хрома в бихроматах и т.д.
Лабораторная работа 14






