В основе стандартизации лежит следующая реакция:
 2КМпО4 + 5Н2С2О4 + 3Н2SO4 =2 МпSO4 + K2SO4 + 10СО2 + 8Н2О
2КМпО4 + 5Н2С2О4 + 3Н2SO4 =2 МпSO4 + K2SO4 + 10СО2 + 8Н2О
среда
 Мп7+ +5е = Мп2+ 2
Мп7+ +5е = Мп2+ 2
2С3+ - 2е = 2С4+ 5
или
 МпО4- + 5е + 8Н+ = Мп2+ + 4Н2О 2
МпО4- + 5е + 8Н+ = Мп2+ + 4Н2О 2
С2О4 - 2е = 2СО2 5
Реактивы:
- 0,01 н раствор КМпО4;
- 0,1 н раствор щавелевой кислоты Н2С2О4×2Н2О;
- 2 н раствор Н2SO4.
Выполнение работы
1. Приготовить 100 мл 0,01 н раствора щавелевой кислоты из 0,1 н раствора. Для этого отмерить в мерную колбу на 100 мл пипеткой точно 10 мл 0,1 н раствора и довести объем раствора водой до метки.
2. Установить молярную концентрацию эквивалента и титр раствора КМпО4.
Бюретку заполнить приготовленным раствором перманганата калия. В колбу для титрования отмерить пипеткой 10 мл приготовленного раствора щавелевой кислоты и мерным цилиндром 10 – 15 мл 2 н раствора серной кислоты. Приготовленную в колбе смесь подогреть до 70 – 80о С (не кипятить!) и оттитровать раствором КМпО4 до появления устойчивой слабо-розовой окраски.
Обратите внимание, что вначале обесцвечивание раствора идет медленно, но по мере накопления в растворе ионов Мп2+, которые действуют каталитически, обесцвечивание происходит практически мгновенно. Поэтому раствор КМпО4 необходимо приливать по каплям при непрерывном помешивании.
Титрование повторить три раза, результаты занести в таблицу:
| Объем Н2С2О4, мл | Объем КМпО4, мл |
| 5,0 5,0 5,0 | V1 = V2 = V3 = |
и вычислить среднее значение, мл:
V (КМпО4) СР. = 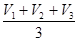
3. На основании полученных данных произвести расчет молярной концентрации эквивалента раствора перманганата калия и его титра, г/мл:
СЭК (КМпО4) = 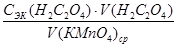
Т (КМпО4) =  где
где
МЭК(КМпО4) = 

Лабораторная работа 12
Определение содержания железа (П) в растворе
В основе определения лежит реакция:
10FeSO4 + 2KMnO4+ 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O
 Mn7+ + 5e = Mn2+ 2
Mn7+ + 5e = Mn2+ 2
2Fe2+ - 2e = 2Fe3+ 5
или
 МпО4- + 5е + 8Н+ = Мп2+ + 4Н2О 2
МпО4- + 5е + 8Н+ = Мп2+ + 4Н2О 2
2Fe2+ - 2e = 2Fe3+ 5
По количеству затраченного на титрование окислителя (КМпО4) определяют концентрацию восстановителя (FeSO4).
Выполнение работы
1. Бюретку заполнить раствором КМпО4. В мерную колбу емкостью 100 мл получить у лаборанта кафедры раствор сульфата железа (П) и довести объем раствора дистиллированной водой до метки. В колбу для титрования отмерить пипеткой 10 мл приготовленного раствора соли железа, прибавить мерным цилиндром 10 – 15 мл 2 н Н2SO4 и титровать раствором КМпО4 до появления бледно-розовой окраски. Титрование повторить три раза, записать в таблицу и рассчитать среднее значение:
| Объем FeSO4, мл | Объем КМпО4, мл |
| 5,0 5,0 5,0 | V1 = V2 = V3 = |
V (КМпО4) = 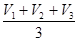
2. На основании полученных данных произвести расчет молярной концентрации эквивалента раствора сульфата железа, моль/л:
СЭК (FeSO4) = 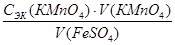
3. Вычислить титр, г/мл:
Т (FeSO4) =  где
где
МЭК(FeSO4) = 
4. Определить содержание сульфата железа в объеме мерной колбы, г:
m (FeSO4)ПРАКТ. = Т (FeSO4) ×100
5. Узнать у преподавателя теоретическое значение содержания сульфата железа (П) и рассчитать абсолютную и относительную погрешность определения.
Абсолютная погрешность:
DCАБС. = m (FeSO4)ТЕОР. - m (FeSO4)ПРАКТ.
Относительная погрешность:
DCОТН. = 
Дихроматометрия
Сущность метода
Дихроматометрическое титрование – один из методов окислительно-восстановительного титрования, основанный на применении в качестве титранта раствора дихромата калия К2Сr2О7. При взаимодействии с восстановителями дихромат – ион Сr2О72- присоединяет шесть электронов и восстанавливается до иона Сr3+:
Сr2О72- + 6е + 14Н+ ® 2 Сr3+ + 7Н2О
Из данного уравнения видно, что для процесса восстановления необходимо присутствие катионов водорода Н+, следовательно, благоприятной является кислая среда. Молярная масса эквивалента дихромата калия будет равна:
МЭ(К2Сr2О7) = 
Дихроматометрия имеет следующие преимущества перед перманганатометрией:
1. Путем перекристаллизации из водного раствора можно получить химически чистый дихромат калия, строго соответствующий формуле К2Сr2О7. Поэтому стандартный раствор дихромата калия можно приготовить из точной навески.
2. Раствор дихромата калия очень устойчив при хранении, он не разлагается даже при кипячении в подкисленном растворе.
3. Дихромат калия труднее, чем перманганат калия восстанавливается органическими веществами, поэтому он не окисляет примеси органических веществ, что обуславливает постоянство его титра в растворе.
Индикатором дихроматометрического титрования, как правило, является дифениламин NH(C6H5)2:
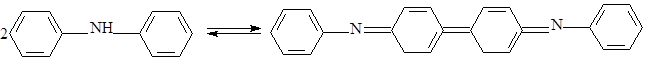






восстановленная форма окисленная форма
(бесцветная) (синий цвет)
Дифениламин окрашивает раствор в синий цвет при малейшем избытке дихромата.
Дихроматометрически определяют ионы Fe2+ в сернокислых растворах. Однако, при титровании солей Fe2+ дихроматом в растворе накапливаются ионы Fe3+, окислительно-восстановительный потенциал системы: Fe3+  Fe2+ повышается и дифениламин окисляется. Таким образом, будет достигнута точка эквивалентности. Чтобы избежать этого, к титруемому раствору кроме дифениламина прибавляют еще ортофосфорную кислоту, которая маскирует мешающие ионы Fe3+, связывая их в прочный бесцветный комплекс Fe(НРО4)+.
Fe2+ повышается и дифениламин окисляется. Таким образом, будет достигнута точка эквивалентности. Чтобы избежать этого, к титруемому раствору кроме дифениламина прибавляют еще ортофосфорную кислоту, которая маскирует мешающие ионы Fe3+, связывая их в прочный бесцветный комплекс Fe(НРО4)+.
В сельскохозяйственном анализе дихроматометрически определяют содержание Fe2+ в его солях, используемых как ядохимикаты.
Лабораторная работа 13






