Растворы гидролизующихся солей находят применение в медицинской практике. Так, при попадании на кожу растворов кислот пораженные участки обрабатывают сначала водой, а затем раствором карбоната натрия Na2CO3. Такой способ позволяет нейтрализовать остатки кислоты, так как водный раствор Na2CO3 имеет щелочную реакцию. Однако растворы Na2CO3 вряд ли следует применять для снижения повышенной кислотности желудочного сока ввиду достаточно высокой щелочности. Для этих целей применяют растворы гидрокарбоната натрия NaHCO3, которые характеризуются более низким значением pH. В этой связи, для точного использования препарата, действие которого основано на гидролизе, врачу необходимо уметь оценивать величины pH растворов гидролизующихся солей.
1. В растворах солей типа NH4Cl:
 , ,
| (8) |
или
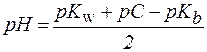 . .
| (8´) |
где 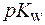 , pC,
, pC, 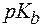 - отрицательные десятичные логарифмы соответствующих величин.
- отрицательные десятичные логарифмы соответствующих величин.
Так как при t0 = 20-250C 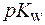 = 14, то
= 14, то 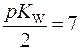 , следовательно:
, следовательно:
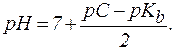
| (8´´) |
2. В растворах солей типа CH3COONa:
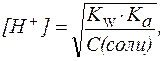
| (9) |
или

| (9´) |
3. В растворах солей типа NH4CN:
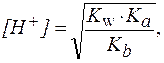
| (10) |
или
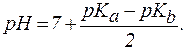
| (10´) |
В случае равенства  =
=  дробная часть формулы обратится в ноль и рН = 7.
дробная часть формулы обратится в ноль и рН = 7.
Если соль гидролизуется в несколько ступеней, то можно считать, что значение рН раствора этой соли будет определяться только первой ступенью гидролиза.






