Количественно гидролиз можно охарактеризовать при помощи константы гидролиза (КГ) и степени гидролиза (h).
Константа гидролиза (KГ) - это отношение ионного произведения воды (K w ) к константе диссоциации слабого основания или слабой кислоты, образующих данную соль.
Частное от деления одной постоянной величины на другую есть также величина постоянная. Поэтому K Г - величина постоянная, которая характеризует способность соли подвергаться гидролизу. Значение K Г зависит от природы соли, температуры и не зависит от концентрации раствора.
1. Для солей типа NH4Cl:
 . .
| (1) |
Чем слабее основание, тем в большей степени подвергаются гидролизу образованные им соли.
2. Для солей типа CH3COONa:
 . .
| (2) |
Чем слабее кислота, тем в большей степени подвергаются гидролизу соли, образованные этой кислотой.
3. Для солей типа NH4CN:
 . .
| (3) |
Чем слабее кислота и основание, образующие соль, тем в большей степени протекает гидролиз соли.
4. Для солей типа Na2CO3 (две ступени гидролиза):

| (4) |

| (4´) |
Так как  , следовательно,
, следовательно,  . Таким образом, по первой ступени гидролиз солей всегда протекает в большей степени.
. Таким образом, по первой ступени гидролиз солей всегда протекает в большей степени.
Степень гидролиза (h) - отношение количества гидролизованной соли к общему количеству растворенной соли, обычно выражаемое в процентах.
Если, например, в воде было растворено 2 моль соли, а гидролизу подверглось 0,01 моль, то  .
.
Степень гидролиза зависит от многих факторов:
1. В первую очередь, она зависит от химической природы составляющих данную соль ионов. Так, в растворах CH3COONa и NaCN с молярными концентрациями 0,1 моль/л при 250С степень гидролиза солей различна:
h(CH3COONa) = 0,01%, a h(NaCN) = 1,5%.
Это объясняется различной силой кислот, составляющих соли:


 .
.
Таким образом:
Чем слабее кислота (основание), образующие соль, тем выше степень гидролиза.
2. Степень гидролиза сильно меняется c изменением температуры раствора соли. Действительно, процесс гидролиза является эндотермическим, поэтому:
Чем выше температура, тем больше степень гидролиза.
3. Степень гидролиза зависит от концентрации раствора:
Чем меньше концентрация раствора соли, тем больше степень гидролиза.
Степень гидролиза может быть выражена через константу гидролиза:
1. Для солей типа NH4Cl:
 . .
| (5) |
2. Для солей типа CH3COONa:
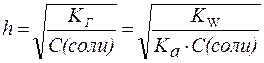
| (6) |
3. Для солей типа NH4CN:

| (7) |
Таким образом, степень гидролиза солей, образованных слабой кислотой и слабым основанием, практически не зависит от концентрации раствора соли.






