1. Обчислити об’єм розчину натрій гідрофосфату з молярною концентрацією речовини Na2HPO4 0,5 моль/дм 3, який треба взяти для осадження йонів Mg2+ у вигляді MgNH4PO4 із 0,5 г сплаву, що містить магній масовою часткою 90%, за умови стехіометричного співвідношення реагуючих речовин.
Відповідь: 37,0 см 3.
2. Обчислити об’єм хлоридної кислоти (ρ =1,17 г/см 3), який треба взяти для осадження йонів Ag2+ у вигляді AgCl з 2,0г сплаву, що містить срібло масовою часткою 22% за умови використання півторакратної кількості осаджувача.
Відповідь: 0,56 см 3.
3. Для визначення сірки наважку руди масою 2,0 г, що містить 20%S, сплавляють з Na2O2 і сплав розчиняють у 200 см 3 води. Розрахувати об’єм розчину BaCl2 з молярною концентрацією барій хлориду 0,25 моль/дм 3, який необхідний для осадження сульфат-іонів у вигляді BaSO4 з 20 см 3 отриманого розчину за умови півторакратної кількості осаджувача.
Відповідь: 7,5 см 3.
4. Обчислити масу диметилсульфату (CH3O)2SO2, яка необхідна для осадження йонів Ва2+ з розчину, що містить 0,2 г BaCl2·2H2O за умови трикратної кількості осаджувача.
Відповідь: 0,31 г.
5. Обчислити втрати PbSO4 (в г і %) за рахунок розчинності осаду, якщо до 20 см 3 розчину Pb(NO3)2 з молярною концентрацією плюмбум нітрату 0,1 моль/дм 3 додали півторакратний надлишок розчину сульфатної кислоти з молярною концентрацією H2SO4 0,1 моль/дм 3.
Відповідь: 1,21·10–5 г; 2,0·10–3%.
6. Розрахувати втрати CaCO3 при промиванні 0,3 г осаду водою об’ємом 250 см 3.
Відповідь: 1,54·10–3 г.
7. Розрахувати об’єм води, який треба взяти для промивання осаду MgNH4PO4·6H2O масою 0,5 г, щоб втрати за рахунок розчинності не перевищували 0,05%.
Відповідь: 16,2 см 3.
8. Наважку алюмокалієвого галуну масою 2,671 г розчинили в 200,0 см 3 води і з 20,0 см 3 цього розчину отримали 0,2680 г ВаSO4. Обчислити масову частку Алюмінію в препараті.
Відповідь: 5,80%.
9. Із наважки сплаву масою 2,700 г отримали 0,2004 г Al2O3 і 0,0518 г SiO2. Розрахувати масові частки Al і Si у сплаві.
Відповідь: 3,93%; 0,90%.
10. Наважку технічного натрію масою 0,2120 г розчинили у 200,0 см 3 води і з 20,0 см 3 отриманого розчину отримали 0,5578 г NaZn(UO2)3(CH3COO)9·6H2O. Розрахувати масову частку Na2O у досліджуваному зразку.
Відповідь: 53,02%.
11. Наважку сильвініту масою 5,000 г розчинили у мірній колбі об’ємом 500 см 3. З 10,0 см 3 цього розчину отримали 0,1948 г калій тетрафенілборату KB(C6H5)4. Розрахувати масову частку KCl у вологому сильвініті, якщо вміст води у зразку складає 2,50%.
Відповідь: 40,53%.
12. Наважку органічної речовини масою 0,4004 г мінералізували і залишок розчинили в колбі об’ємом 200,0 см 3. З 20,0 см 3 цього розчину отримали 0,1982 г (NH4)3PO4·12MoO3. Розрахувати масову частку Фосфору в досліджуваній речовині.
Відповідь: 8,17%.
13. Для визначення саліцилової кислоти наважку фармацевтичного препарату масою 0,2101 г перевели в розчин Na2CO3, додали йод і отримали 0,5175 г тетрайодфеніленхінону (C6H2I2O)2. Розрахувати масову частку саліцилової кислоти C6H4(OH)COOH у препараті.
Відповідь: 98,93%.
14. З наважки технічного цинк сульфату масою 1,135 г отримали 0,5298 г Zn2P2O7 і 0,9052 г BaSO4. Розрахувати масові частки ZnSO4 і K2SO4 у технічному продукті.
Відповідь: 49,46%; 6,16%.
15. Із наважки суміші NaCl і KCl масою 0,1225 г отримали 0,2850 г AgCl. Розрахувати масові частки NaCl і KCl у суміші.
Відповідь: 76,26%; 23,74%.
16. Наважку Fe2O3 і Al2O3 масою 0,7000 г відновили воднем і отримали 0,6350 г продукту, що містить Fe і Al2O3. Розрахувати масові частки Fe2O3 і Al2O3 у вихідній суміші.
Відповідь: 30,90%; 69,10%.
17. Обчислити об’єм розчину оксихіноліну з масовою часткою C9H6NOH 5% (d =1,07 г/см 3), який треба взяти для осадження Mg2+ із 20 см 3 розчину, отриманого при розчиненні 5 г доломіту CaCO3·MgCO3 у 200 см 3 розчину хлоридної кислоти, якщо реагенти беруться в стехіометричних кількостях.
Відповідь: 14,77 см 3.
18. Обчислити об’єм розчину амоній сульфату з молярною концентрацією (NH4)2SO4, який треба додати до 300 см 3 води, щоб при промиванні осаду BaSO4 масою 0,5 г цим розчином втрати за рахунок розчинності не перевищували 0,01%.
Відповідь: 0,92 см 3.
19. Розрахувати масову частку Na2S2O3·5H2O у технічному препараті натрій тіосульфату, якщо з наважки препарату масою 0,1852 г після окиснення 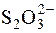 до
до  отримали осад масою 0,3448 г.
отримали осад масою 0,3448 г.
Відповідь: 98,98%.
20. Обчислити число молекул води в молекулі залізоамонійного галуну, якщо з наважки галуну масою 0,5020 г отримали 0,0891 г Fe2O3.
Відповідь: 12.






