як вже зазначалось, колоњдн≥ системи мають великий запас в≥льноњ енерг≥њ, а тому термодинам≥чно нест≥йк≥. ¬еличезна питома поверхн€ дисперсноњ фази створюЇ надлишок поверхневоњ енерг≥њ, €ка, зг≥дно другого закону термодинам≥ки, прагне до найменшого значенн€, що повТ€зано ≥з зменшенн€м поверхн≥ розд≥лу м≥ж частинками ≥ середовищем. ÷е викликаЇ перех≥д системи в такий стан, коли частинки обТЇднуютьс€, зч≥плюютьс€ п≥д д≥Їю молекул€рних сил в агрегати.
—едиментац≥йна ст≥йк≥сть (ст≥йк≥сть до ос≥данн€) колоњдних систем звТ€зана з дифуз≥Їю та броун≥вським рухом, а агрегативна ст≥йк≥сть Ц ≥з зм≥ною ступен€ дисперсност≥.
ѕорушенн€ агрегативноњ ст≥йкост≥ колоњдноњ системи в б≥к укрупненн€ частинок за рахунок њх злипанн€ п≥д д≥Їю молекул€рних сил прит€ж≥нн€ називаЇтьс€ коагул€ц≥Їю. –озр≥зн€ють дв≥ стад≥њ коагул€ц≥њ: приховану ≥ €вну. ѕерша в колоњдних системах зак≥нчуЇтьс€, €к правило, дуже швидко. Ќа ц≥й стад≥њ частинки хоч ≥ укрупнюютьс€, але осад ще не утворюЇтьс€. ¬ де€ких випадках пом≥чаютьс€ зовн≥шн≥ зм≥ни ≥ зм≥нюЇтьс€ забарвленн€ зол€, зТ€вл€Їтьс€ муть ≥ ≥н. ƒруга стад≥€ Ц €вна коагул€ц≥€ Ц настаЇ в результат≥ подальшоњ агрегац≥њ частинок, €ка зак≥нчуЇтьс€ за певний час повним розд≥ленн€м системи на дв≥ фази ≥ випад≥нн€м частини чи вс≥Їњ колоњдноњ речовини в осад. “акий осад називаЇтьс€ коагель або коагул€т, що маЇ певну структуру.
оагул€ц≥ю колоњд≥в можуть викликати електрол≥ти ≥ неелектрол≥ти, зм≥на температури, механ≥чн≥ впливи, зм≥на складу дисперс≥йного середовища, електричний струм ≥ ≥нш≥ фактори. ќсобливо важливу роль в коагул€ц≥њ в≥д≥грають електрол≥ти.
ƒл€ коагул€ц≥њ колоњд≥в необх≥дно зн€ти зар€д частинок. ƒл€ цього до колоњдноњ системи додають в≥дпов≥дний електрол≥т.
ћ≥н≥мальна концентрац≥€ електрол≥ту, €ка викликаЇ швидку коагул€ц≥ю, називаЇтьс€ порогом коагул€ц≥њ ≥ виражаЇтьс€ звичайно в м≥л≥мол€х на 1дм3 колоњду.
оагулуюча здатн≥сть електрол≥ту повТ€зана ≥з зар€дом йона. оагулюючий йон повинен мати зар€д, протилежний знаку зар€ду частинки. „им вищий його зар€д, тим менша концентрац≥€ електрол≥ту в≥дпов≥даЇ порогу коагул€ц≥њ. ≤снуЇ загальна законом≥рн≥сть: з п≥двищенн€м зар€ду йона зменшуЇтьс€ концентрац≥€ доданого коагулюючого електрол≥ту, а в≥дношенн€ порог≥в коагул€ц≥њ дл€ одно-, дво- та тризар€дних йон≥в в≥дпов≥даЇ в≥дношенню чисел Ц сотень, дес€тк≥в, одиниць. ѕор≥г коагул€ц≥њ зм≥нюЇтьс€ обернено пропорц≥йно 6-≥й степен≥ зар€ду коагулюючого йона.
≤з досл≥джень по осадженню колоњд≥в електрол≥тами виникла адсорбц≥йна теор≥€ коагул€ц≥њ. —уть њњ пол€гаЇ в тому, що при коагул€ц≥њ золей йони-коагул€тори адсорбуютьс€ колоњдними частинками в залежност≥ в≥д концентрац≥њ розчину в≥дпов≥дно до р≥вн€нн€ адсорбц≥њ ‘рейндл≥ха:
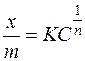 , де
, де
х Ц к≥льк≥сть молей адсорбованого йона;
m Ц маса адсорбента, г;
— Ц концентрац≥€ коагулюючого електрол≥та, моль/дм3;
≥ n Ц константи.
Ѕагатозар€дн≥ йони, що про€вл€ють б≥льш високу адсорбц≥йну здатн≥сть, коагулюють золь в менших концентрац≥€х, н≥ж однозар€дн≥ йони тому, що однозар€дн≥ йони у менш≥й м≥р≥ знижують зар€д колоњдноњ частинки.
|
|
|
ƒл€ оц≥нки ≥нтенсивност≥ коагул€ц≥њ необх≥дно враховувати не т≥льки величину зар€ду коагулюючого йона, а також розпод≥ленн€ йон≥в у дифузному шар≥ та величину дзета-потенц≥алу колоњдноњ системи.
≈лектростатична теор≥€ коагул€ц≥њ заснована на врахуванн≥ зм≥н подв≥йного електричного шару колоњдноњ частинки. ¬ивчаючи коагул€ц≥ю, вводитьс€ пон€тт€ про критичний потенц≥ал, вище €кого система пор≥вн€но ст≥йка, а нижче Ц золь втрачаЇ стаб≥льн≥сть ≥ швидко коагулюЇ.
–озр≥зн€ють швидку коагул€ц≥ю, при €к≥й кожне з≥ткненн€ призводить до зчепленн€ частинок ≥ швидк≥сть не залежить в≥д концентрац≥њ електрол≥ту, ≥ пов≥льну коагул€ц≥ю, швидк≥сть €коњ залежить в≥д концентрац≥њ коагулюючого електрол≥ту.
«алежн≥сть швидкост≥ коагул€ц≥њ в≥д концентрац≥њ коагулюючого електрол≥ту ≥люструЇ граф≥к:

ƒ≥л€нка 0ј в≥дпов≥даЇ ст≥йкост≥ колоњду; тут швидк≥сть коагул€ц≥њ майже дор≥внюЇ нулю. ћ≥ж точками ј ≥ Ѕ розташована д≥л€нка пов≥льноњ коагул€ц≥њ, в €к≥й швидк≥сть процесу поступово зростаЇ ≥з зб≥льшенн€м концентрац≥њ електрол≥ту до де€кого граничного значенн€. “очка ј в≥дпов≥даЇ порогу коагул€ц≥њ. ƒзета-потенц≥ал у ц≥й точц≥ маЇ критичне значенн€. “очка Ѕ характеризуЇ ту концентрац≥ю, п≥сл€ €коњ подальше п≥двищенн€ концентрац≥њ електрол≥ту вже не впливаЇ на швидк≥сть коагул€ц≥њ, так €к дзета-потенц≥ал вже стаЇ р≥вним нулю. ѕраворуч в≥д точки Ѕ знаходитьс€ д≥л€нка швидкоњ коагул€ц≥њ, де швидк≥сть коагул€ц≥њ не залежить в≥д концентрац≥њ коагулюючого електрол≥ту.
ѕроцеси переходу речовин у колоњдний стан ≥ руйнуванн€ колоњд≥в мають м≥сце €к в €к≥сному, так ≥ в к≥льк≥сному анал≥з≥, ≥ ц≥ €вища необх≥дно враховувати у процес≥ виконанн€ анал≥з≥в. олоњдоутворенн€ може в≥дбуватись в ус≥х випадках при проведенн≥ реакц≥й окисненн€-в≥дновленн€, обм≥ну з утворенн€м малорозчинних сполук, при г≥дрол≥з≥ солей, при застосуванн≥ ≥ндикатор≥в, розчинених в орган≥чних розчинниках, коли њх додають до водних розчин≥в, при збер≥ганн≥ розчин≥в ≥ ≥н.
“ак, при осадженн≥ йон≥в Ag+, Pb2+, Ca2+, Sr2+, Al3+ ≥ ≥нших осади малорозчинних сполук цих елемент≥в можуть не утворюватись внасл≥док колоњдоутворенн€. ѕри збер≥ганн≥ розчину т≥осульфату в≥н мутн≥Ї ≥ опалесц≥юЇ через утворенн€ колоњду —ульфуру, €кий виникаЇ внасл≥док реакц≥њ:
Na2S2O3 + CO2 + H2O → NaHSO3 + NaHCO3 + S.
олоњдоутворенн€ може мати м≥сце в аргентометр≥њ, комплексонометр≥њ. ќсадженн€ кат≥он≥в у вигл€д≥ малорозчинних сульф≥д≥в майже завжди супроводжуЇтьс€ утворенн€м колоњдних систем, що ускладнюЇ анал≥з. «вТ€зуванн€ кат≥он≥в Al3+, Zn2+, Co2+, Ni2+, Cr3+ у комплекси також може супроводжуватись утворенн€м колоњд≥в.
“ому знанн€ про механ≥зм утворенн€ та руйнуванн€ колоњдних систем в анал≥тичн≥й практиц≥ набувають вир≥шального значенн€.






