Количественное определение полисахаридов ГФ-Х1, вып.2 предлагает для листьев подорожника большого и слоевищ ламинарии. Метод определения
- гравиметрический (весовой), основанный на осаждении полисахаридного водного извлечения 95% спиртом. Стадии анализа:
1) экстракция полисахаридов водой;
2) осаждение полисахаридов из водного извлечения 95% спиртом;
3) высушивание осадка и доведение его до постоянной массы.
В слоевишах ламинарии, кроме того, определяют содержание йода после сжигания навески бромйодометрическим методом.
Там же определяют содержание песка (SiO2).
В сырье алтея, липы, льна, мать-и-мачехи, подорожника блошного количественного определения биологически активных веществ и экстрактивных веществ не проводят.
2. Оценка качества сырья, содержащего жиры. Методы анализа.
Существующая в фармации нормативная документация предусматривает качественные реакции на жиры при проведении микроскопического анализа
плодов и семян - ГФ-Х1, вып. 1, стр.279:
готовят поперечный срез плодов и семян в растворе Судана III и подогревают; капли жирного масла окрашиваются в оранжево-розовый цвет.
Этой реакцией, в частности, подтверждают наличие жирного масла в эндосперме семян льна.
Количественное определение жира в лекарственном растительном сырье:
Определение содержания жира в растительном сырье проводят в жиромасличной промышленности, в сельском хозяйстве, в пищевой промышленности.
Метод определения - гравиметрический. Метод основан на растворимости жиров в органических растворителях. Наиболее часто используют метод Сокслета и метод Рушковского.
По методу Сокслета определяют массу жирного масла после отгона органического растворителя.
По методу Рушковского о масссе жирного масла судят по убыли массы навески сырья после обработки органическим растворителем. Определение ведется в аппарате Сокслета. Определение длительное (от 16 часов до 3-х суток), недостаточно точное, т.к. извлекаются не только жиры, но и пигменты, каротиноиды, смолистые вещества.
3. Эфирные масла
Метод количественного определения содержания эфирного масла в растительном сырье основан на:
- физических свойствах эфирного масла - летучести и практической нерастворимости в воде;
- на отсутствии химического взаимодействия эфирного масла и воды;
- на законе Дальтона о парциальных давлениях.
Согласно закону, смесь жидкостей закипает тогда, когда сумма их парциальных давлений достигает атмосферного давления.
Следовательно, давление паров смеси жидкостей (вода + эфирное масло) достигнет атмосферного давления еще до кипения воды.
В соответствии с ГФ-Х1, вып. 1, стр.290 (раздел «Общие методы анализа») определение проводят одним из 4 методов в зависимости от количества в сырье эфирного масла, его состава, плотности и термолабильности.
Метод 1 и 2 применяют, если эфирное масло имеет плотность меньше 1 и не растворяется в воде.
Метод 3 и 4 применяют для сырья, содержащего эфирное масло, которое претерпевает изменения, образует эмульсию, легко загустевает и имеет плотность близкую к единице.
Метод 1 (метод Гинзберга) - применяют для сырья, где много эфирного (масло термостабильное), в его составе преобладают моно- и бициклические монотерпены. Приемник для сбора эфирного масла помещается в экстрактивной колбе.
Этим методом определяют содержание эфирного масла в сырье можжевельника, мяты, шалфея, эвкалипта, тмина.
Метод 2 (метод Клавенджера) - используют, когда сырье содержит эфирного масла менее 0.2-0.3 %.
Этот метод дает меньшую ошибку опыта. Приемник вынесен за пределы экстракционной колбы, что позволяет определить в сырье содержание термолабильного эфирного масла. Этим методом определяют содержание эфирного масла в сырье ромашки, тмина, мяты, шалфея, эвкалипта.
Метод 3 (метод Клавенджера). Приемник см. 2-й метод. В приемник прибавляют органический растворитель для разрушения эмульсии или растворения загустевшего или тяжелого масла. Определяют эфирное масло в сырье аниса, аира, тысячелистника.
Метод 4 впервые включен в ГФ Х1 и отличается от 3-его метода возможностью контролировать температуру конденсации. Во время гидродистилляции температура в отстойнике не должна превышать 25°С.
В ГФ-Х1, вып.2, стр.227 на побеги багульника болотного даны два показателя содержания эфирного масла в сырье:
- если сырье предназначено для получения экстемпоральных лекарственных форм, то эфирного масла должно быть не менее 0.1%;
если сырье предназначено для получения ледина, то эфирного масла должно быть не менее 0.7%.
В таком эфирном масле дополнительно определяют содержание ледола методом газо-жидкостной хроматографией. Ледола должно быть не менее 17%.
Сырье, содержащее эфирное масло, которое при перегонке претерпевает изменения, образует эмульсию, легко загустевает или имеет плотность, близкую к единице, анализируют методами 3 или 4.
4. Качественные реакции на антраценпроизводные
Из сырья антраценпроизводные извлекают водой или спиртом различной концентрации.
Для получения свободных агликонов, гликозиды в растительном сырье подвергают гидролизу, свободные агликоны извлекают этиловым эфиром и хлороформом.
Для обнаружения антраценпроизводных в сырье используют качественные реакции, основанные на химических свойствах и хроматографическое исследование.
Реакция образования фенолятов со щелочью:
а) по характерной оранжевой окраске корней и коры или
на сухом сырье - при нанесении нескольких капель 10%-ного раствора натрия гидроксида на сырье появляется вишнево-красное пятно.
Положительный результат наблюдается, если антраценпроизводные присутствуют в окисленной форме. Рекомендована ГФ-Х1 для подтверждения подлинности Cortex Frangulae;
б) с водным извлечением (1:10) - при добавлении к водному извлечению из сырья нескольких капель 10%-ного раствора щелочи образуется вишнево-красное окрашивание - производные антрахинона,
желтое окрашивание - производные антранола и антрона;
фиолетовое окрашивание – ализарин.
Окраска при взаимодействии со щелочью появляется только у окисленных форм антраценопроизводных,
а восстановленные формы четкой реакции с NaOH не дают, и для их обнаружения необходимо осуществить предварительное окисление; например, свежесобранная кора крушины дает эту реакцию с NaOH только после предварительной обработки ее пероксидом водорода.
в) реакция Борнтрегера. Позволяет обнаружить эмодины в присутствии других антраценпроизводных.
Проба основана на способности антрагликозидов подвергаться щелочному гидролизу с образованием свободных агликонов.
Одновременно производится окисление восстановленных форм.
После подкисления гидролизата агликоны извлекают эфиром.
Эфирный слой окрашивается в желтый цвет.
При встряхивании эфирного слоя с аммиаком эмодины, имеющие гидроксильные группы в бета-положении, переходят в водный слой, окрашивая его в вишнево-красный цвет.
Хризофанол остается в органическом слое, окрашивая его в желтый цвет.
Предложена в ГФ-Х1 для подтверждения подлинности Cortex Frangulae, Folia Sennae, Fructus Rhamni catharticae, Radices Rhei, Rhizomata et radices Rubiae.
2. Реакция микросублимации (микровозгонки).
Основана на способности АП возгоняться при 200 °С с последующей конденсацией на холодной поверхности без изменения основной структуры.
И может быть проведена в двух вариантах:
в пробирке и на предметном стекле.
При нанесении на сублимат раствора натрия гидроксида образуется вишнево- красное окрашивание.
Дана в ГФ-Х1 для подтверждения подлинности Согtех Frangulae.
3.Реакция образования лаков.
Основана на способности антраценпроизводных образовывать со спиртовым раствором магния ацетата комплексы, окрашенные в вишнево-красный цвет.
4.Для качественного обнаружения производных антрацена часто используется бумажная и тонкослойная хроматография.
О присутствующих веществах судят по характеру их флуоресценции в УФ-свете до и после обработки хроматограмм соответствующими реагентами (парами аммиака, растворами едких щелочей).
Количественное определение.
Все методы количественного определения антраценпроизводных в сырье основаны на отделении свободных агликонов после кислотного гидролиза. Агликоны экстрагируют в органический растворитель и определяют различными методами.
1. Фотоэлектроколориметрический метод.
Основан способности окрашенных фенолятов поглощать свет при длине волны 530-540 нм.
Предложен в 1957 г. Аутергоффом (Германия), модифицирован А.С. Романовой и А.И. Баньковским (НПО «ВИЛАР», 1965).
Аутергофф предложил гидролиз и экстракцию агликонов объединить в одну стадию кипячением навески сырья с ледяной уксусной кислотой и с последующей экстракцией диэтиловым эфиром.
Стадии определения суммы производных антрацена:
1- гидролиз антраценпроизводных и экстракция агликонов из сырья;
2- получение окрашенных солей
Эфирное извлечение обрабатывают в делительной воронке отдельными порциями щелочно-аммиачного раствора (5% раствор NаОН, содержащий 2% раствора аммиака).
Антраценпроизводные в виде окрашенных фенолятов переходят в водную фазу (обрабатывают до тех пор, пока последняя порция щелочно-аммиачного раствора не будет оставаться бесцветной).
3- окисление восстановленных форм антраценпроизводных
Для перевода всех форм антраценпроизводных в окисленные, часть щелочно-аммиачного раствора фенолятов нагревают на водяной бане в течение 15 мин. Восстановленные формы окисляются кислородом воздуха и вступают в реакцию со щелочно-аммиачным раствором, окраска становится интенсивнее (сырье крушины и ревеня). В сырье марены красильной окисление восстановленных форм проводят пергидролем.
4 - измерение оптической плотности окрашенных растворов с пофотоэлектроколориметра (ФЭК) при длине волны 530-540 нм (зеленый фильтр).
Содержание антраценпроизводных в сырье (%) рассчитывают по калибровочному графику, построенному по кобальта хлориду (СоС12 в пересчете на истизин (хризацин).
Фотоэлектроколориметрический метод рекомендован ГФ-Х1 для определения содержания (%) антраценпроизводных в сырье крушины, ревеня, марены красильной.
В корневищах и корнях марены красильной по ФС регламентируется определение связанных производных антрацена.
Количественное содержание связанных производных антрацена определяют вычитанием количества свободных производных антрацена (агликонов} из суммы производных антрацена.
При определении свободных производных антрац ена отсутствует стадия гидролиза антрагликозидов. Агликоны извлекают из сырья эфиром, получают окрашенные феноляты, окисляют восстановленные формы пергидролем, определяют оптическую плотность окрашенных фенолятов по калибровочному графику, построенному по кобальта хлориду, рассчитывают содержание свободных производных антрацена в сырье марены красильной.
2. Спектрофотометрический метод.
Этим методом определяют содержание антраценпроизводных в листьях сенны.
Основные стадии метода:
- экстракцию сеннозидов проводят водой при нагревании;
водное извлечение очищают от смолистых веществ;
окисление восстановленных форм проводят с помощью FeCl3;
гидролиз гликозидов антрахинонов проводят 50%-ным раствором серной кислоты;
оптическую плотность окрашенных растворов измеряют с помощью спектрофотометра при длине волны 523 нм;
- содержание суммы производных антрацена в пересчете на хризофанол вычисляют по калибровочному графику, построенному по кобальта хлориду.
5. Качественный анализ дубильных веществ.
Для получения суммы дубильных веществ растительное сырье экстрагируют горячей водой в соотношении 1:30 или 1:10.
Качественные реакции на дубильные вещества можно подразделить
на 2 группы:
Общие реакции осаждения – для обнаружения дубильных веществ
Групповые – для установления принадлежности дубильных веществ к определенной группе
Для обнаружения дубильных веществ в растительном сырье используют следующие реакции:
Специфической реакцией на дубильные вещества является реакция осаждения желатином. Используют 1 %-й раствор желатина на 10 %-ном растворе хлорида натрия. Появляется хлопьевидный осадок, растворимый в избытке желатина. Отрицательная реакция с желатином свидетельствует об отсутствии дубильных веществ.
Реакция с солями алкалоидов. Образуется аморфный осадок за счет образования водородных связей с гидроксильными группами дубильных веществ и атомами азота алкалоида.
Эти реакции дают одинаковый результат независимо от группы дубильных веществ.
Реакции, позволяющие определить группу дубильных веществ.
1 .Реакция Стиасни – с 40 % раствором формальдегида и конц. HCl -
Конденсированные дубильные вещества образуют осадок кирпично-красного цвета
2. Бромная вода (5 г брома в 1 л воды) - к 2-3 мл испытуемого раствора прибавляют по каплям бромную воду до появления в растворе запаха брома; в случае присутствия конденсированных дубил ьных веществ образуется оранжевый или желтый осадок.
3. Окрашивание с солями трехвалентного железа, железоаммонийными квасцами –
черно-синее (дубильные вещества гидролизуемой группы, которые являются производными пирогаллола)
или черно-зеленое ( дубильные вещества конденсированной группы, которые являются производными пирокатехина).
4. Катехины дают красное окрашивание с ванилином
(в присутствии конц. HCl или 70 %-ной H2SO4 развивается яркая красная окраска).
Катехины образуют при этой реакции окрашенный продукт следующего строения:
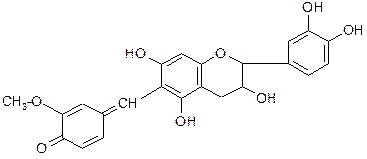
Реакцией отличающей пирогалловые танниды от пирокатехиновых является реакция нитрозометилуретаном.
При кипячении растворов дубильных веществ с нитрозометилуретаном танниды пирокатехинового ряда осаждаются полностью,
а присутствие пирогалловых таннидов можно обнаружить в фильтрате путем прибавления железоаммиачных квасцов и натрия ацетата – фильтрат окрашивается в фиолетовый цвет.
Свободная эллаговая кислота дает красно-фиолетовую окраску при добавлении нескольких кристаллов нитрита натрия и трех-четырех капель уксусной кислоты.
7. Для обнаружения связанной эллаговой кислоты (или гаксаоксидифеновой) уксусную кислоту заменяют 0,1 н. серной или соляной кислотой (кармино-красная окраска, переходящая в синюю).
8. Дубильные вещества с белками создают непроницаемую для воды пленку (дубление). Вызывая частичное свертывание белков, они образуют на слизистых оболочках и раневых поверхностях защитную пленку.
9. При соприкосновении с воздухом (например, резке свежих корневищ) дубильные вещества легко окисляются, превращаясь во флобафены или красени, которые обусловливают темно-бурую окраску многих кор и других органов, настоев.
Флобафены нерастворимы в холодной воде, растворяются в горячей воде, окрашивая отвары и настой в бурый цвет.
10. С 10 %-ным раствором среднего ацетата свинца (одновременно добавляют 10 %-ный раствор уксусной кислоты):
образуется белый осадок, нерастворимый в уксусной кислоте – дубильные вещества гидролизуемой группы
(осадок отфильтровывают и в фильтрате определяют содержание конденсированных дубильных веществ, с 1 %-ным раствором железоаммонийных квасцов – черно-зеленое окрашивание);
белый осадок, растворимый в уксусной кислоте – дубильные вещества конденсированной группы.
11. Для идентификации отдельных соединений используют хроматографический анализ, рассматривая в УФ-свете. Обработку хроматограмм производят раствором железа хлорида или ванилиновым реактивом
Структуру устанавливают с помощью ИК-спектров, ПМР-спектров.
Реакция с 1 %-ным спиртовым раствором железоаммониевых квасцов является фармакопейной, проводится с отваром из сырья – кора дуба, корневище змеевика, соплодия ольхи, плоды черники;
А также непосредственно в сухом сырье – кора дуба, кора калины, корневища бадана.
Количественное определение.
Гравиметрические или весовые методы – основаны на количественном осаждении дубильных веществ желатином, ионами тяжелых металлов или адсорбцией кожным (гольевым) порошком.
Официальным в дубильно-экстрактовой промышленности является весовой единый метод (ВЕМ):
В водных вытяжках из растительного материала вначале определяют общее количество растворимых веществ (сухой остаток) путем высушивания определенного объема вытяжки до постоянной массы;
затем из вытяжки удаляют дубильные вещества, обрабатывая ее обезжиренным кожным порошком; после отделения осадка в фильтрате вновь устанавливают количество сухого остатка.
Разность в массе сухого остатка до и после обработки вытяжки кожным порошком показывает количество подлинных таннидов.
Титриметрические методы.
К ним относятся:
Желатиновый метод - Метод Якимова и Курницкой – основан на способности дубильных веществ образовывать нерастворимые комплексы с белками. Водные извлечения из сырья титруют 1 % раствором желатина, в точке эквивалентности комплексы желатино-таннаты растворяются в избытке реактива.
Титр устанавливают по чистому таннину. Точку валентности определяют путем отбора наименьшего объема титрованного раствора, вызывающего полное осаждение дубильных веществ.
Метод наиболее точный, т.к. позволяет определить количество истинных дубильных веществ.
Недостатки: длительность определения и трудность установления точки эквивалености.
2 ) Перманганатометрический метод (метод Левенталя в модификации Курсанова). Это фармакопейный метод, основан на легкой окисляемости перманганатом калия в кислой среде в присутствии индикатора и катализатора индигосульфокислоты, которая в точке эквивалентности раствора меняется от синего до золотисто-желтого.
Особенности определения, позволяющие оттитровать только макромолекулы дубильных веществ: титрование проводится в сильно разбавленных растворах (извлечение разбавляеттся в 20 раз) при комнатной температуре в кислой среде, перманганат добавляется медленно, по каплям, при интенсивном перемешивании.
Метод экономичный, быстрый, прост в исполнении, но недостаточно точен, так как перманганат калия окисляет частично и низкомолекулярные фенольные соединения.
3 ) Для количественного определения таннина в листьях сумаха и скумпии используется метод осаждения дубильных веществ сульфатом цинка с последующим комплексонометрическим титрованием трилоном Б в присутствии ксиленолового оранжевого.
3. Физико-химические методы.
1) Фотоэлектроколориметрические - основаны на способности ДВ образовывать окрашенные соединения с солями трехвалентного железа, фосфорно-вольфрамовой кислотой, реактивом Фолина-Дениса и др.
2) Хроматоспектрофотометрические и нефелометрические методы используют в научных исследованиях.
6. Методы анализа сырья, содержащего сапонины.
Наличие сапонинов в лекарственном растительном сырье можно установить при помощи качественных реакций, которые проводят непосредственно с сырьем или с извлечением из него.
Качественные реакции на сапонины основаны на их физических, химических и биологических свойствах. Для проведения качественных реакций готовят водный настой 1:10 при нагревании на водяной бане. После охлаждения настой фильтруют.
Реакции, основанные на физических свойствах.
Для проведения реакции на пенообразованиеберут две пробирки, в одну добавляют 5 мл 0,1 моль/л HCl, в другую добавляют 5 мл 0,1 моль/л NaOH и сильно встряхивают. Если образуется стойкая пена в обеих пробирках или в пробирке с кислотой – это говорит о кислых тритерпеновых сапонинах.
Стероидные сапонины дают дают обильную, стойкую пену в щелочной среде.
Химические методы.
Относятся реакции осаждения сапонинов и цветные реакции.
1.Из водных растворов сапонины осаждаются гидроксидами бария и магния, солями меди, ацетатом свинца.
Причем тритерпеновые – осаждаются средним ацетатом свинца, а стероидные – основным.
2. Из спиртовых извлечений (или растворов) стероидные сапонины и тритерпеновые сапонины выпадают в осадок при добавлении 1% спиртового раствора холестерина в виде холестеридов.
3. Стероидные сапонины, так же как и сердечные гликозиды, дают реакцию Либермана-Бухарда с уксусным ангидридом и кислотой концентрированной серной – образуется быстро переходящая окраска от розовой до зеленой и синей.
4. Реакция Санье - стероидные сапонины от тритерпеновых можно отличить по реакции с 1% раствором сурьмы треххлористой, концентрированной серной кислотой, содержащей уксусный ангидрид, если образуется желтое окрашивание.
Учитывая, что многие из перечисленных химических реакций могут давать и другие соединения, проводят еще и биологические испытания.
На биологических свойствах сапонинов
основана реакция гемолиза с 2 % взвесью эритроцитов в изотоническом растворе. Кровь становится прозрачной, ярко-красной. Для проведения этой реакции из растительного сырья готовят настой на изотоническом растворе.
Государственная фармакопея XI издания (вып.2) рекомендует использовать качественные реакции для подтверждения подлинности для трех видов сырья.
1. Корневища с корнями синюхи голубой. С водным извлечением проводится реакция пенообразования, основанная на способности сапонинов снижать поверхностное натяжение жидкости (воды) и давать в отваре стойкую и обильную пену после встряхивания.
2. Корни аралии маньчжурской. Метанольное извлечение хроматографируют в тонком закрепленном слое силикагеля (на пластинках «Силуфол») в системе растворителей хлороформ-метанол-вода (61:32:7). В качестве свидетелей используют раствор «Сапарала». Хроматограмму проявляют 20% H2SO4 и нагревают в сушильном шкафу (1=105°С) в течение 10 мин. Появляются 3 пятна вишневого цвета на уровне пятен аралозидов в «сапарале».
3. Корни женьшеня.
а) Реакция с порошком корня женьшеня (на гликозиды). При нанесении конц. H2SO4 на порошок корня женьшеня через 1-2 минуты появляется кирпично-красное окрашивание, переходящее в красно-фиолетовое, а затем - в фиолетовое.
б) Наличие панаксозидов доказывают при помощи разделения извлечения из корня женьшеня в тонком слое силикагеля и последующим проявлением хроматограммы раствором фосфорно-вольфрамовой кислоты при нагревании. Панаксозиды проявляются в виде розовых пятен.
Единого метода количественного определения сапонинов в лекарственном растительном сырье нет.
Чаще всего используют физико-химические методы:
1.Потенциометрический метод. Метод основан на определении изменения электродвижущей силы (ЭДС) в результате титрования. Метод используется для определения суммы аралозидов в корнях аралии маньчжурской.
Этапы определения: - подготовительный; экстракция аралозидов метиловым спиртом и их кислотный гидролиз:

R1, R2 – сахара олеаноловая кислота
- очистка от сопутствующих веществ - осаждение олеаноловой кислоты в результате смены растворителя (разбавление спиртового извлечения водой и охлаждение);
- растворение олеаноловой кислоты в горячей смеси метилового и изобутилового спиртов (1:1,5);
- количественное определение - титрование раствором едкого натра (0,1 моль/л) в смеси метилового спирта и бензола:

Точку эквивалентности определяют потенциометрически.
2. Спектрофотометрический метод. Метод основан на способности сапонинов и их окрашенных комплексов поглощать монохроматический свет при определенной длине волны. Метод предложен для определения содержания сапонинов в следующих видах сырья:
а) корневища с корнями диоскореи ниппонской. Проводят кислотный гидролиз сапонинов с последующим проведением реакции свободного агликона (диосгенина) с реактивом (п-диметиламинобензальдегид). Образуется окрашенный комплекс;
б) корни солодки. Проводят осаждение глицирризиновой кислоты концентрированным раствором аммиака. Осадок растворяют и определяют оптическую плотность полученного раствора.
3. Гравиметрический метод - определение экстрактивных веществ. Метод основан на определении сухого остатка после высушивания суммы веществ, извлеченных из сырья соответствующим экстрагентом. Метод предложен для оценки качества сырья женьшеня, почечного чая, синюхи голубой, солодки.
В сырье астрагала шерстистоцветкового и заманихи высокой количественное содержание биологически активных веществ не определяют.
4. Ранее для количественной оценки сырья использовали определение гемолитического индекса и пенного числа.
Количественное определение сапонинов гемолитическим методом основано на предположении, что гемолитическое действие прямо пропорционально количеству вещества в растворе.
Гемолитический индекс – наименьшая концентрация извлечения из сырья, которая вызывает полный гемолиз эритроцитов. Для этого к настою сырья на изотоническом растворе добавляют 2% взвесь бараньих эритроцитов. В результате гемолиза кровь становится прозрачной, ярко-красной, лакированной (эритроциты перейдут в плазму). Расчет проводят на 1 г испытуемого вещества.
5. Пенное число – наименьшая концентрация извлечения из 1 г сырья, при встряхивании которого в течение 15 секунд образуется пена, устойчивая в течение 15 минут.
6. Определяли силу действия сапонинового сырья на рыбах, то есть рыбный индекс. Это наименьшая концентрация извлечения, при которой гибнут рыбы массой до 0,5 г, длиной 3-4 см в течение 1 часа.
7. Анализ сырья, содержащего СГ.
Качественные реакции на СГ проводят с очищенным спиртовым извлечением из растительного сырья.
Все реакции на СГ можно разделить на 3 группы:
- реакции на углеводную часть молекулы (2-дезоксисахара) (реакция Келлер-Килиани);
- на стероидную структуру (реакция Либермана-Бухарда);
- на лактонное ненасыщенное кольцо.
1. Реакции на стероидную структуру.
Основаны на способности стероидного ядра СГ подвергаться дегидратации под действием кислотных реагентов (уксусный ангидрид, конц. серная кислота, трихлоруксусная кислота) с образованием окрашенных комплексных соединений. Образующиеся в результате реакций окрашивания меняются во времени, поэтому необходимо наблюдать их в момент соприкосновения реактивов, а затем отмечать изменение окраски в течение 10-15 минут.
Для СГ обычно проводят реакции:
1. Реакция Либермана-Бурхарда. При взаимодействии СГ со смесью уксусного ангидрида и конц. серной кислотой появляется розовое окрашивание, переходящее в зеленое.
2. Реакция Розенгейма. При взаимодействии СГ с 90% водным раствором трихлоруксусной кислоты появляется розовое окрашивание, переходящее в лиловое и затем в синее.
3. Реакция с хлоридом сурьмы (III). СГ при взаимодействии с хлоридом сурьмы в среде уксусного ангидрида образуют лиловое окрашивание
2. Реакции на ненасыщенное лактонное кольцо.
Основаны на способности ненасыщенного лактонного кольца легко окисляться в щелочной среде с образованием окрашенных продуктов реакции. Для СГ обычно проводят реакции:
1. Реакция Балье. При взаимодействии с пикриновой кислотой в щелочной среде СГ образуют комплексы, окрашенные в оранжевый цвет.
2. Реакция Кедде. При взаимодействии с 3,5-динитробензойной кислотой СГ образуют комплексы, окрашенные в красный цвет,
3. Реакция Легаля. При взаимодействии с нитропруссидом натрия в щелочной среде СГ образуют комплексы, окрашенные в красный цвет.
4. Реакция Раймонда. При взаимодействии с мета-динитробензолом СГ образуют комплексы, окрашенные в красно-фиолетовый цвет.
3. Реакции на углеводную часть молекулы.
Основаны на способности моносахаридов углеводной цепи образовывать окрашенные комплексы с различными реактивами.
1. Моносахара, входящие в состав СГ, после предварительного гидролиза вступают во все цветные реакции, свойственные углеводам (Феллинга, серебряного зеркала).
Для дезоксисахаров используют реакцию Келлер-Килиани.
Дезоксисахара в присутствии сульфата железа (III), ледяной уксусной кислоты и конц. серной образуют комплексы, окрашенные в синий или сине-зеленый цвет. Необходимым условием для проведения этой реакции является отсутствие на конце углеводной цепи обычных сахаров (глюкозы).
Достоверное заключение о присутствии в лекарственном растительном сырье СГ можно сделать только при положительном результате всех трех групп качественных реакций на различные части молекулы.
В ГФ-Х1 на сырье наперстянок пурпурной и крупноцветковой, ландыша майского и горицвета весеннего качественных реакций не предусмотрено.
Кроме того, СГ образуют нерастворимые комплексы с растворами дубильных веществ, что используется при отравлениях СГ.
Количественное определение СГ проводят методом биологической стандартизации (ГФ-Х1, вып.2, с. 163-175).
Метод основан на способности СГ вызывать в токсических дозах остановку сердца животных в стадию систолы. В качестве подопытных животных используют лягушек, голубей или кошек. Чувствительность животных к сердечным гликозидам определяют в сравнении со стандартными индивидуальными веществами или экстрактами, которые вырабатывают в специальных научно-исследовательских институтах. Активность выражают в единицах действия (ЕД), которые, в зависимости от вида животных обозначают:
ЛЕД - «лягушачьи» ЕД, КЕД - «кошачьи» ЕД или ГЕД «голубиные» ЕД.
ЛЕД соответствует наименьшей дозе стандартного препарата, вызывающей остановку сердца стандартной лягушки (самец травяной лягушки массой 28-33 г). В нормативной документации на лекарственное сырье и препараты, содержащих СГ, обязательно указывается ВАЛОР (количество ЕД в 1 г сырья).
Недостатками метода биологической стандартизации являются его трудоемкость, высокая стоимость, большая ошибка опыта (до 25%).
Поэтому нормативная документация на некоторые виды сырья и препараты требует определять их количественное содержание физико-химическими методами (хроматофотоэлектроколориметрическим или хроматоспектрофотометрическим) методами. Они основаны на предварительном хроматографическом разделении СГ с последующим фотоэлектроколориметрическим или спектрофотометрическим определением.
8. Методы анализа сырья, содержащего простые фенольные соединения.
Качественный и количественный анализ сырья основан на физических и химических свойствах.
Качественный анализ.
Включает качественные реакции и хроматографические пробы.
Фенольные соединения в виде гликозидов извлекают из растительного сырья водой, затем извлечения очищают от сопутствующих веществ, осаждая их растворами ацетата свинца. С очищенным извлечением выполняют качественные реакции.
Простые фенолы и агликоны фенологликозидов дают
характерные для фенольных соединений реакции:
с железоаммонийными квасцами
с солями тяжелых металлов
с диазотированными ароматическими аминами.
Специфические реакции (ГФ Х1):
- на арбутин (сырье толокнянки и брусники) используют цветные качественные реакции:
с кристаллическим сульфатом закисного железа.
Реакция основана на получении комплекса, изменяющего окраску от сиреневого до темного с дальнейшим образованием темно-фиолетового осадка.
с 10 % -ным раствором натрия фосфорно-молибденовокислого в кислоте хлористоводородной.
Реакция основана на образовании комплексного соединения синего цвета.
на салидрозид (сырье родиолы розовой):
реакция азосочетания с диазотированным сульфацилом натрия с образованием азокрасителя вишнево-красного цвета.

салидрозид азокраситель
Хроматографическое исследование
Используется ТСХ для обнаружения простых фенольных соединений в сырье родиолы розовой (ГФ Х1, вып. 2, ст. 75, с. 364-366).
Проба основана на разделении веществ в тонком слое силикагеля (пластинка «Силуфол») метанольного извлечения из сырья в системе растворителей хлороформ-метанол-вода (26:14:3) с последующим проявлением хроматограммы диазотированным сульфацилом натрия. Пятно салидрозида с Rf = 0,42 окрашивается в красноватый цвет.
Количественное определение.
Для количественного определения простых фенологликозидов в лекарственном растительном сырье используют различные методы: гравиметрические, титриметрические и физико-химические.
1. Гравиметрическим методом определяют содержание флороглюцидов в корневищах папоротника мужского. Метод основан на извлечении флороглюцидов из сырья диэтиловым эфиром в аппарате Сокслета. Извлечение очищают, отгоняют эфир, полученный сухой остаток высушивают и доводят до постоянной массы. В пересчете на абсолютно сухое сырье содержание флороглюцидов не менее 1,8%.
2. Титриметрический йодометрический метод используется для определения содержания арбутина в сырье брусники и толокнянки. Метод основан на окислении агликона гидрохинона до хинона 0,1 М раствором йода в кислой среде и в присутствии натрия гидрокарбоната.
Выделяют стадии определения:
Извлечение арбутина из сырья водой
Очистка водного извлечения основным ацетатом свинца
Кислотный гидролиз арбутина. Гидролиз проводится концентрированной серной кислотой в присутствии цинковой пыли, чтобы выделившийся свободный водород предотвращал собственное окисление гидрохинона.
Титрование 0,1 М раствором йода. В качестве индикатора используют раствор крахмала.

3. Спектрофотометрический метод используется для определения содержания салидрозида в сырье родиолы розовой.
Метод основан на способности окрашенного азокрасителя поглощать монохроматический свет при длине волны 486 нм. Стадии определения:
Извлечение салидрозида водой
Очистка водного извлечения осаждением балластных веществ раствором ацетата свинца и натрия сульфата
Получение окрашенного азокрасителя по реакции салидрозида с диазотированным сульфацилом натрия
Определение оптической плотности окрашенного раствора с помощью спектрофотометра при длине волны 486 нм
удельного показателя поглощения ГСО салидрозида Е1%1см = 253.
Содержание салидрозида не менее 0,8 %.
9. Качественное определение.
Специфических реакций для всех групп флавоноидов не существует.
Часто используют следующие качественные реакции и хроматографическое исследование:
1. Характерной реакцией на флавоноиды - Цианидиновая проба или
проба Синода (проба Chinoda)(основана на восстановление их атомарным водородом в кислой среде в присутствии магния или цинка).
Флавоноиды при восстановлении магнием или цинком в присутствии концентрированной хлористоводородной кислоты образуют красное окрашивание, обусловливаемое образованием антоцианидинов:
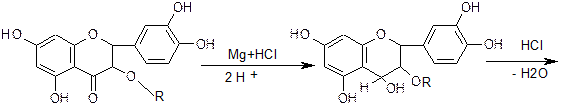
хроменол
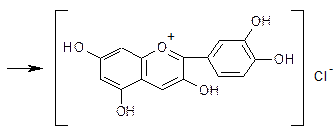
цианидин хлорид
Реакция очень чувствительна, основана на восстановлении карбонильной группы и образовании антоцианида.
Халконы и ауроны при помощи цианидиновой реакции не обнаруживаются, но при добавлении конц. HCl (без магния) образуют красное окрашивание за счет образования оксониевых солей.
Борно-лимонная реакция с реактивом Вильсона (по 0,5 г борной и лимонной кислот в метаноле).
Реакция отличия флавоноидов от фуранохромонов. Флавоноиды дают комплексы с борной кислотой желтой окраски с желто-зеленой флюоресценцией, которые не разрушаются лимонной кислотой (образование батохромного комплекса):

3. Реакция с треххлористой сурьмой.
5-оксифлавоны и 5-оксифлавонолы, взаимодействуя с треххлористой сурьмой, образуют комплексные соединения, окрашенные в желтый или красный цвет:

С 2-5 %-ным спиртовым раствором AlCl3 желто-зеленое окрашивание говорит о наличии флавоноидов. Образуются хелатные комплексы за счет водородных связей, возникающих между карбонильной и оксигруппой, желтого цвета с желто-зеленой флюоресценцией.
Эта реакция приведена в ГФ Х1 изд. для подтверждения подлинности сырья
зверобоя, горца перечного и птичьего. Аналогично образуются комплексы с солями циркония.
Реакция с солями железа (хлорид окисного железа), образуются комплексные соединения, окрашенные в черно-синий цвет, если флавоноиды триоксипроизводные и в зеленый, если диоксипроизводные.
Реакция с 1 %-ным раствором основного ацетата свинца.
Антоцианидины дают синий аморфный осадок. Флавоны, халконы и ауроны – осадки ярко-желтого цвета.
Реакция с 10 %-ным раствором щелочи с образованием фенолятов желтого цвета на флавоны и флавонолы. Антоцианидины образуют со щелочами соли от синего до оливково-зеленого цвета.
Реакция азосочетания с диазосоединениями. Образуется азокраситель оранжевого, красного или вишнево-красного цвета.
8. С 1 %-м раствором ванилина в конц. HCl образуют красно-малиновое окрашивание катехины (производные флороглюцина и резорцина).
4. С раствором аммиака, щелочи флавоны, флаваноны, флавонолы, флаванонолы дают желтое окрашивание, при нагревании переходящее в оранжевое или красное;
халконы и ауроны тотчас же дают красное или пурпурное окрашивание.
Чистые катехины окрашивания не дают, однако присутствие даже в небольшом количестве примесей (продуктов окисления) вызывает появление желтой окраски.
Антоцианы в присутствии аммиака или карбоната натрия дают синее или фиолетовое окрашивание.
5. С 1 %-м раствором ванилина в конц. HCl образуют красно-малиновое окрашивание катехины (производные флороглюцина и резорцина).
6. Флавоны, халконы, ауроны, содержащие свободные орто-гидроксильные группировки в кольце В, при обработке спиртовых растворов средним ук-
суснокислым свинцом образуют осадки, окрашенные в ярко-желтый и красный цвета.
Антоцианы образуют осадки, окрашенные как в красный, так и в синий цвета.
7. С 1-2 %-ным спиртовым раствором AlCl3 желто-зеленое окрашивание говорит о наличии флавоноидов.
С целью обнаружения флавоноидов в растительном материале широко
используется хроматография на бумаге и в тонком слое сорбента, колоночная хроматография.Используют различные системы растворителей:
БХ чаще всего БУВ (бутанол-уксусная кислота- вода) 4:1:5; 4:1:2;
ТСХ – хлороформ-метанол 8:3; 8:2.
Обнаружение компонентов на хроматограмме осуществляется просматриванием их в УФ свете.
Идентифицируют флавоноиды по характерному свечению на хроматограммах в УФ-свете и после проявления хромогенными реактивами.
Катехины и лейкоантоцианиды не флюоресцируют. Гликозиды флавонов и изофлавонов флюоресцируют голубым или синим светом, флавонолов – темно-коричневым или черным, агликоны флавонов – коричневым, флавонолов – желтым, халконы и ауроны имеют желтую или оранжевую флюоресценцию.
После просматривания в УФ свете хроматограммы можно обработать одним из реактивов:
1) 5 %-ным спиртовым раствором AlCl3 c последующим нагреванием при 105 0С в течение 3-5 минут; (ярко-желтая окраска пятна в видимом свете и яркую желто-зеленую флуоресценцию в УФ –свете);
2) с 5 %-ной SbCl3 в четыреххлористом углероде (реактив Мартини-Беттоло); Желтая или желто-оранжевая окраска указывает на наличие флавонов, флавонолов, флаванонов и изофлавонов;красная или красно-фиолетовая – халконов.
3) с 2 %-ным спиртовым раствором щелочи
4) при обработке пятна парами аммиака усиливается голубая флуоресценция (изофлавоноиды)
что позволяет получить зоны с более яркой флуоресценцией в УФ свете.
5) Реактив Вильсона (раствор борной и б\в лимонной кислоты в б\в метаноле)
6) Реакция азосочетания – на наличие 7-оксифлаванолов, 7-оксиизофлаванолов.
Хроматографические методы анализа.
С целью обнаружения флавоноидов в растительном материале широко
используется хроматография на бумаге и в тонком слое сорбента.
Обнаружение компонентов на хроматограмме осуществляется просматриванием их в УФ свете.
При этом флавоны, флавонол-3-гликозиды, флаваноны, халконы и их 7-гликозиды – в виде желтых или желто-зеленых пятен; флавонолы и их 7-гликозиды – в виде желтых или желто-зеленых пятен; ксантоны в виде оранжевых пятен.
Изофлавоны при этом не проявляются.
После просматривания в УФ свете хроматограммы можно обработать одним из реактивов:
1) 5 %-ным спиртовым раствором AlCl3 c последующим нагреванием при 105 0С в течение 3-5 минут; (ярко-желтая окраска пятна в видимом свете и яркую желто-зеленую флуоресценцию в УФ –свете);
2) с 5 %-ной SbCl3 в четыреххлористом углероде (реактив Мартини-Беттоло); Желтая или желто-оранжевая окраска указывает на наличие флавонов, флавонолов, флаванонов и изофлавонов;красная или красно-фиолетовая – халконов.
3) с 2 %-ным спиртовым раствором щелочи
4) при обработке пятна парами аммиака усиливается голубая флуоресценция (изофлавоноиды)
что позволяет получить зоны с более яркой флуоресценцией в УФ свете.
Реактив Вильсона (раствор борной и б\в лимонной кислоты в б\в метаноле)
5) Реакция азосочетания – на наличие 7-оксифлаванолов, 7-оксиизофлаванолов.
Количественное определение.
В последние годы все большее распространение получают различные:
1. физико-химические методы анализа, которые имеют ряд существенных преимуществ в сравнении, например, с гравиметрическими и титрометрическими методами, а именно, быстрота и точность определения, обнаружение даже незначительных количеств и, что особенно важно, возможность выделения отдельных флавоноидов из растительного сырья.
К таким методам относятся фотоэлектроколориметрия, спектрофотометрия, денситометрия с использованием хроматографии на бумаге и в тонком слое сорбента.
1. Сущность хроматоденситометрического метода заключается в выделении и разделении флавоноидов с непосредственной количественной денситометрической оценкой окрашенной зоны на хроматограмме.
Метод имеет преимущества в быстроте проведения анализа и точности определения, так как в данном случае исключается стадия элюирования.
2. фотоэлектроколориметрический метод, основанный на измерении оптической плотности окрашенных растворов, полученных в цветных реакциях флавоноидов с солями различных металлов (алюминия, циркония, титана, хрома, сурьмы), с лимонно-борным реактивом и на реакции восстановления цинком или магнием в кислой среде, в реакции азосочетания с солями диазония.
ГФ Х1 издания дает ФЭК-метод для определения содержания суммы флавоноидов в листьях вахты трехлистной. Предварительно сырье очищают от хлорофилла хлороформом, получают спиртовое извлечение флавоноидов, затем измеряют оптическую плотность окрашенного раствора с помощью фотоэлектроколориметра. Содержание суммы флавоноидов рассчитывают по калибровочному графику, построенному по стандартному образцу рутина.
Известна цветная реакция флавоноидов с азотнокислым и уксуснокислым уранилом, позволяющая количественно определять рутин в смеси с кверцитином.
В настоящее время широко используется метод спектрофотометричекий.
3. Спектрофотометрический метод (СФМ)
СФМ основан на способности флавоноидов или их окрашенных комплексов поглощать монохроматический свет при определенной длине волны.
Получают спиртовое извлечение и измеряют собственное поглощение в:
цветках бессмертника песчаного при длине волны 315 нм, рассчитывают содержание флавоноидов на изосалипурозид с использованием оптической плотности ГСО изосалипурозида;
корнях стальника при длине волны 260 нм; рассчитывают на ононина;
цветках пижмы измеряют оптическую плотность флавоноидов и фенолкарбоновых кислот в буферном растворе и пересчитывают на лютеолин с учетом оптической плотности ГСО лютеолина;
Получают спиртовое извлечение, затем проводят реакцию образования комплекса с 2 %-ным раствором алюминия хлорида и измеряют оптическую плотность в:
траве зверобоя в пересчете на рутин с учетом оптической плотности ГСО рутина;
траве горца перечного в пересчете на кверцетин с учетом удельного показателя поглощения комплекса кверцетина с алюминия хлоридом;
траве горца птичьего в пересчете на авикулярин с учетом удельного показателя поглощения комплекса авикулярина с алюминия хлоридом.
3) Получают извлечение антоцианов 1 %-ным раствором хлористоводородной кислоты из цветков василька синего, при этом образуются окрашенные оксониевые соли, у которых измеряют оптическую плотность и пересчитывают на 3,5 дигликозид цианидина (цианин) с учетом удельного показателя поглощения цианина в 1 %-ном растворе хлористоводородной кислоты.
Хроматоспектрофотометрический метод.
1. Предварительное разделение флавоноидов в тонком слое сорбента (цветки боярышника). Стадии определения:
- получение спиртового извлечения;
очистка извлечения;
хроматографическое разделение флавоноидов на пластинке «Силуфол» в системе растворителей хлороформ-метанол 8:2 вместе со свидетелем ГСО гиперозида;
- идентификация гиперозида и свидетеля на пластинках в УФ-свете;
- элюирование гиперозида и ГСО смесью диоксана и воды 1:1;
- измерение оптической плотности испытуемого раствора и ГСО при длине 565 им;
расчет содержания гиперозида.
Предварительное разделение на колонке с полиамидом (плоды боярышника)
Стадии определения:
- получают спиртовое извлечение;
отгоняют спирт и обрабатывают остаток 10%-ным раствором натрия хлорида;
полученный раствор наносят на колонку с полиамидом;
- элюируют флавоноиды с колонки 95%-ным этанолом, собирают окрашенный в желтый цвет элюат в мерную колбу на 25 мл;
- измеряют оптическую плотность элюата при длине волны 365 нм;
- параллельно измеряют оптическую плотность элюата ГСО гиперозида, полученного аналогично элюату флавоноидов;
- пересчитывают на гиперозид с учетом оптической плотности элюата ГСО
гиперозида.
3. В траве сушеницы топяной выделяют следующие стадии количественного определения:
- получают спиртовое извлечение;
отгоняют спирт и остаток обрабатывают 10%-ным раствором натрия хлорида;
полученный раствор переносят на колонку с полиамидом;
- элюируют флавоноиды с колонки 95%-ным этанолом и собирают окрашенный в темно-желтый цвет элюат в мерную колбу на 50 мл;
- измеряют оптическую плотность элюата при длине волны 338 нм;
- параллельно определяют оптическую плотность раствора стандартного вещества сравнения (СОВС) калия бихромата;
- пересчитывают на гнафалозид А с учетом оптической плотности СОВС и
коэффициента пересчета калия бихромата на гнафалозид А и поправочного
коэффициента на неполное элюирование гнафалозида А с полиамидного сорбента.
4. Количественное содержание ксантонов в траве золототысячника:
- получают извлечение подкисленным 60%-ным этанолом;
2 мл извлечения наносят на колонку с полиамидным сорбентом;
- элюируют ксантоны 95%-м этанолом и собирают окрашенный в желтый цвет элюат в мерную колбу на 50 мл;
- получают окрашенный комплекс с алюминия хлоридом;
- измеряют оптическую плотность окрашенного комплекса;
- параллельно измеряют оптическую плотность окрашенного комплекса ГСО алпизарина с алюминия хлоридом;
- пересчитывают на алпизарин с учетом оптической плотности комплекса ГСО алпизарина с алюминия хлоридом.
Количественное определение.
В последние годы все большее распространение получают различные:
1. физико-химические методы анализа, которые имеют ряд существенных преимуществ в сравнении, например, с гравиметрическими и титрометрическими методами, а именно, быстрота и точность определения, обнаружение даже незначительных количеств и, что особенно важно, возможность выделения отдельных флавоноидов из растительного сырья.
К таким методам относятся фотоэлектроколориметрия, спектрофотометрия, денситометрия с использованием хроматографии на бумаге и в тонком слое сорбента.
Сущность хроматоденситометрического метода заключается в выделении и разделении флавоноидов с непосредственной количественной денситометрической оценкой окрашенной зоны на хроматограмме.
Метод имеет преимущества в быстроте проведения анализа и точности определения, так как в данном случае исключается стадия элюирования.
Используется фотоколориметрический метод, основанный на измерении оптической плотности окрашенных растворов, полученных в цветных реакциях флавоноидов с солями различных металлов (алюминия, циркония, титана, хрома, сурьмы), с лимонно-борным реактивом и на реакции восстановления цинком или магнием в кислой среде.
Известна цветная реакция флавоноидов с азотнокислым и уксуснокислым уранилом, позволяющая количественно определять рутин в смеси с кверцитином.
В настоящее время широко используется метод спектрофотометричекий.
10. Методы анализа кумаринов
Для обнаружения кумаринов в растительном сырье проводят качественные реакции и хроматографическое исследование, используя лактонные свойства кумаринов:
- вступать в реакцию разрыва лактонного кольца (лактонная проба);
- давать окрашенные растворы с диазосоединениями;
- флуоресцировать в УФ-свете.
Качественный анализ
1. Лактонная проба (предложена Г.А.Кузнецовой). Параллельно проводят контрольный опыт.
Методика: 1 мл извлечения, содержащего кумарины, наливают в две пробирки.
В одну добавляют 0,5 мл 10%-ного раствора натрия гидроксида.
Обе пробирки нагревают на водяной бане, затем в обе прибавляют 4 мл дистиллированной воды и хорошо перемешивают.
Если в пробирке, куда добавляли щелочь, раствор остался желтым и прозрачным, значит, реакция положительная, так как образуется желтая растворимая в воде соль кумаровой кислоты.
В контрольной пробирке при добавлении воды раствор мутнеет, кумарины не растворяются в воде и выпадают в осадок.
При подкислении щелочного раствора лактонное кольцо замыкается и кумарины выпадают в осадок.


2. Реакция образования азокрасителя. Реакция проводится с продуктами, полученными после реакции разрыва лактонного кольца.
Методика: В пробирку добавляют 1 мл свежеприготовленного диазореактива. Чаще всего, в качестве диазореактива используют диазосульфаниловую кислоту. Образуется азокраситель от желтого до вишнево-красного цвета.
Для идентификации кумаринов используют методы бумажной и тонкослойной хроматографии. При этом используют системы растворителей:
- н-бутанол-уксусная кислота-вода БУВ (4:1:5)
- н-гексан-бензол-метанол (5:4:1);
- петролейный эфир-бензол-метанол (5:4:1);
Идентифицируют кумарины по характерной флюоресценции в УФ свете или проявляют хромогенными реактивами.
В качестве проявляющих реактивов служат 1%-ный спиртовый раствор алюминия хлорида, 10%-ный раствор щелочи или пары аммиака.
Широкие возможности для обнаружения в растениях и сырье кумаринов, не только их суммы, но и отдельных соединений, открылись после внедрения хроматографического анализа. При этом указанные реактивы используют и для обработки хроматограмм.
4. Хроматографические методы удобны для выделения индивидуальных кумаринов.
Количественное определение.
Для количественного определения кумаринов в лекарственном РС используют гравиметрические, титриметрические и физико- химические методы анализа.
По существующей нормативной документации для количественного определения кумаринов в лекарственном растительного сырье используют физико-химические методы анализа.
1. Полярографический метод. Определение кумаринов в плодах пастернака.
Основан на восстановлении кумаринов на ртутно-капельном электроде в альфа-пироновом кольце по месту двойной связи в положении 3,4. Присоединяют галоген - йод, в качестве реактива используют тетраэтиламмоний йодид. Содержание комариное в пересчете на ксантотоксин не менее 1%.
Спектрофотометрический метод. Основан на способности кумаринов поглощать монохроматический свет при определенной длине волны в зависимости от концентрации исследуемого раствора. Используют
для определения содержания простых кумаринов в траве донника лекарственного (не менее 0.4%) и пиранокумаринов в корневищах и корнях вздутоплодника сибирского (не менее 3 %). Получают хлороформное извлечение из сырья и измеряют у него оптическую плотность с помощью спектрофотометра.
3. Хроматоспектрофотометрический метод. Применяют для определения содержания фуранокумаринов в плодах амми большой, псоралеи костянковой, листьях инжира.
Стадии определения:
1. Получение хлороформного извлечения из сырья.
2. Разделение суммы кумаринов методом хроматографии на бумаге в системе растворителей, указанной в нормативной документации.
3. Идентификация кумаринов в УФ-свете по характерному свечению.
4. Элюирование веществ с бумаги. Каждое вещество отдельно элюируют 95 %-ным этанолом.
5. Измерение оптической плотности растворов с помощью спектрофотометра при длине волны, указанной в нормативной документации.
6. Расчет содержание каждого соединения с учетом удельного показателя поглощения.
Плоды амми большой: бергаптена и изопимпинеллина не менее 0,6 %.
Плоды псоралеи костянковой: псоралена и изопсоралена не менее 0,9 %.
Листья инжира: псоралена и бергаптена не менее 0,7%, отдельно псоралена менее 0,42 %.
4. Гравиметрический (весовой) метод.
Основан на избирательной растворимости отдельных кумаринов в различных растворителях и способности лактонного кольца кумарина к раскрытию и обратному замыканию в зависимости от рН среды.
Используется редкотолько для определения суммы кумаринов.
5. Фотоэпектроколориметрический метод.
Основан на измерении оптической плотности окрашенного раствора, полученного по реакции азосочетания с солями диазония при определенной длине волны.
Содержание суммы кумаринов рассчитывают по калибровочному графику, построенному по известному веществу.
Алкалоиды - Различают
общие качественные реакции, с помощью которых доказывается присутствие алкалоидов в сырье или в извлечении из сырья, и
частные качественные реакции, с помощью которых доказывают или индивидуальный алкалоид или определенную группу алкалоидов.
Общие реакции –
это либо реакции осаждения, либо реакции окрашивания.
Реакции осаждения основаны на способности алкалоидов к комплексообразованию. Образующиеся комплексы нерастворимы или мало растворимы в воде.
Общеалкалоидные осадочные реактивы можно разделить на несколько групп:
1 группа. Йод и его растворы.
Образуют с алкалоидами перйодиды, плохо растворимые в воде:
1) пары йода используют для открытия алкалоидов на хроматограммах;
2) раствор йода в KJ (реактив Вагнера, реактив Бушарда).
С алкалоидами образуют бурые, трудно растворимые в воде осадки.
2 группа. Комплексные йодиды металлов:
Реактив Драгендорфа - калия тетрайодовисмутат (KBiJ4) - образует оранжевые или красно-бурые нерастворимые осадки.
Реакцию с реактивом Драгендорфа, согласно действующей НД, используют для обнаружения (проявления) алкалоидов крестовника плосколи стного на хроматограмме.
2) Реактив Майера - тетрайодомеркурат калия (K2HgJ4) - образует осадки белого или желтоватого цвета.
Реакцию с реактивом Майера широко используют для проверки полноты экстракции алкалоидов при их количественном определении в сырье красавки обыкновенной, белены черной, дурмана обыкновенного, анабазиса безлистного.
3 группа. Реакгивы комплексных неорганических кислот (высокомолекулярные органические вещества кислого характера):
1) Реактив Бертрана - раствор кремневольфрамовой кислоты
(SiO2. 12 WO3 . 4 H2O) - образует белый аморфный осадок. Реакцию с реактивом Бер трана используют:
- для подтверждения наличия алкалоидов в извлечении из листа барбариса и травы пассифлоры (качественные реакции);
для проверки полноты экстракции алкалоидов при их количественном определении в траве плауна-баранца и чистотела, листьях и корнях барбариса;
2) реактив Шейблера - раствор фосфорно-вольфрамовой кислоты (НзРО4.12 WО3. 2Н2О) - образует белые аморфные осадки;
3) реактив Зоненштейна - раствор фосфорно-молибденовой кислоты (НзРО4 • 12МоОз 2Н2О) - образует желтоватые аморфные осадки.
Все эти реактивы высокочувствительны и часто используются в исследовательских работах.
4 группа. Органические вещества кислотного характера:
1) раствор пикриновой кислоты - дает осадки желтого цвета.
Реакцию используют для осаждения алкалоида скополамина при его гравиметрическом определении в семенах дурмана индейского;
2) раствор танина - образует беловатые или бурые осадки.
Танин используют в качестве противоядия при отравлении алкалоидами. Танин блокирует поступление и всасывание алкалоидов.
Реакции окрашивания (частные реакции)
основаны на окислении, конденсации, дегидратации алкалоидов концентрированными кислотами и другими окислителями.
Используют:
конц. H2SO4 - качественная реакция на корень барбариса (берберин) получается оранжево-красное окрашивание,
и на наличие алкалоидов в очищенном извлечении (сухой остаток) из корневищ с корнями чемерицы – образуется бурое окрашивание;
2) конц.HNO3 - качественная реакция на корень барбариса (берберин) - красно-бурое окрашивание;
3) раствор H2O2 - качественная реакция на корень барбариса (берберин) - фиолетовое окрашивание;
4) раствор K2Cr2O7 и конц.H2SO4 - качественная реакция на стрихнин - красно-фиолетовое окрашивание;
5) раствор K2Cr2O7 и конц.НNO3 - качественная реакция на бруцин - оранжево-красное окрашивание.
Две последние реакции на наличие алкалоидов в очищенном извлечении из семян чилибухи.
6) реакция на алкалоиды спорыньи - алкалоиды переводят в соли винной кислоты и добавляют реактив Ван-Урка (конц.H2SO4 + FeCl3 + п-диметиламинобензальдегид) – образуется фиолетовое окрашивание.
Эту реакцию используют для подтверждения подлинности сырья, а также в методе количественного определения алкалоидов.
В анализе могут быть использованы:
- реактив Эрдмана - смесь конц.HNОз и конц.Н2SO4;
- реактив Марки - раствор формалина в конц. H2SO4;
- реактив Фреде - раствор молибдата натрия в конц. H2SO4.
Окраска в зависимости от алкалоидов различна.
Для некоторых алкалоидов существуют групповые качественные реакции, такие как: «реакция Витали-Морена» (тропановые алкалоиды),
«мурексидная проба» (на пуриновые алкалоиды),
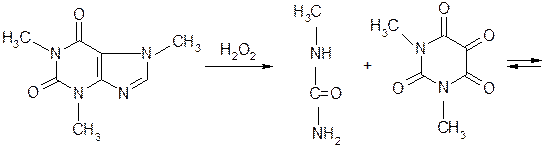
метил- 1,3-диметилаллоксан
мочевина



1,3-диметилалуровая тетраметилаллоксантин
кислота


аммонийная соль тетраметилпурпуровой кислоты
Эта реакция основана на разрушении молекулы пурина при нагревании с окислителем (перекисью водорода, бромной водой, азотной кислотой). Происходит образование смеси производных аллоксана и его изомера диалуровой кислоты. Взаимодействуя между собой, они образую метилированные производные аллоксантина, которые под действием избытка раствора аммиака приобретают пурпурно-красное окрашивание. Окраска обусловлена появлением аммонийной соли метилированного производного пурпуровой кислоты.
Таким образом, общей специфической качественной реакции на алкалоиды не существует.
Если проводят поиск алкалоидсодержащих растений, то всегда выполняют 5-10 реакций с общеалкалоидными реактивами, т.к. чувствительность реакций различна. Обычно эти реакции выполняют капельным способом на стеклянных пластинках.
Для выделения или разделения суммы алкалоидов пользуются методом хроматографии на бумаге.
Для обнаружения алкалоидов достаточно нанести на полоску фильтровальной бумаги каплю испытуемого раствора и "проявить" соответствующим реактивом.
Количественное определение алкалоидов
Единой методики количественного определения содержания алкалоидов в растительном сырье не существует, т.к.






