1. Электролиттің болуы.
2. Оң және теріс электроттардың болуы.
3. Оған тұтынушылық қосылуы.
Оң электротты анод делінеді, теріс электротты катод делінеді.

Оң иондар катодқа қарай тәртіпті жылжиды. Ал теріс иондар анодқа қарай тәртіпті қозғалып токты тасымалдайды. Сонда электрлиттердегі электр тогына оң және теріс иондар тасымалдайды.
Молекулалардың рекомбинациясы деп диссацацияға кері болған құбылысқа айтылып ажыралған иондардың қайта қосылуына айтылады.
Ток өту кезінде иондар тәртіпті түрде қозғалып өзіне сай электрондарға арта береді. Яғни минустар анодқа плюстер катодқа отырады.
Электролиттегі электр тогы үшін Ом заңы орындалады. Бірақ анық ішкі кедергісі температура артқан сайын келеді. Ал металдарда артады. Себебі: металдарда молекулалардың қозғалысы жылулықтан артып электрондардың өтуіне кедергі жасайды. Яғни ток күші кемейеді. Ал электрметті температуралық коэффициенті 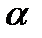 - минус таңбасымен жүреді. Сол үшін аккумуляторларымызды қызып кетуден сақтауымыз керек, қызып кеткенде ток күші артады.
- минус таңбасымен жүреді. Сол үшін аккумуляторларымызды қызып кетуден сақтауымыз керек, қызып кеткенде ток күші артады.
Электролиз заңдары – электролизден электролиттерде ток өткен уақытта ондағы электроттар да заттардың ажыралуына айтылады. Бұл электрлерді Фарадей тапқан.
Ал газдарды иондаушы құрылмаға ионизатор дейді.
Ионизатордағы кернеуге жүзеге келетін электр тогының тығыздығы  заңына бағынады. Токтардың өзгеруі газдың тегіне байланысты.
заңына бағынады. Токтардың өзгеруі газдың тегіне байланысты. 
С-2 электрондар арасындағы электр сиымдылығы дейді.
Ток өткенде имиялық түрленуге ұшырайтын заттарды электролиттер немесе екінші текті өткізгіштер деп аталады.Бұлардың қатарынатұздардың, сілтілердің және қышқылдардың судағы ерітінділері, сондай-ақ қатты күйінде иондық кристалл болып келетін тұздардыңбалқыламалары жатады. Электолит молекулаларының еріткіш молекулаларының әсерінен иондарға ыдырауын электролиттік диссоциация деп атайды. Элекролиттерде ток тасушылар ролін оң және теріс иондар атқарады. Электролиттердегі ток тығыздығы мынаған тең болады:
j = (n+ e+ u0+ +n- e- u0-)E
мұндағы n+ және n- –бірлік көлемдегі оң және теріс иондардың концентрациясы; u0+ және u0- – оң және теріс иондардың қозғалғыштығы. Электролиттердегі ток тығыздығы өріс кернеулігіне тура пропорционал. Бұл электролиттер үшін Ом заңының дұрыс екнін білдіреді. Электролиз заңдарын тәжірибие жүзінде 1836 жылы Фарадей тағайындаған. Фарадейдің бірінші заңы былай дейді: электролиз кезінде электродта бөлініп шығатын зат мөлшері электролит арқылы өткен зарядқа пропорционал болады:
m =Kq =K ∫ id
мұнда m – бөлініп шыққан зат массасы, K – зат табиғатына байланысты коэффициент,бұл электрохимиялық эквивалент деп аталады. Фарадей екінші заңы заттың электрохимиялық эквиваленті К -ні оның химиялық эквиваленті А/z- пен(А -мольдік масса, z- берілген зат валенттілігі)байланыстырады. Бұлзаң былай айтылады: барлық заттардың электрохимиялық эквивалеті олардың химиялық эквивалентіне пропорционал. Пропорционалдықкоэффициент 1/F түрінде жазылады. F – шамасы Фарадей саны деп аталады. Фарадей екінші заңы былай өрнектеледі:

К – берілген заттың массасында қанша заряд бар екендігін білдіреді.
=10  .
.
Фарадейдің II- заңы заттың электрохимиялық эквиваленті сол заттың маляр массасына тура Фарадей санымен немесе электон зарядының Авагадро тұрақтысына көбейтіндісімен заттың валенттілігіне кері пропорционал болады.






