Чистая вода является очень слабым электролитом. Процесс диссоциации воды может быть выражен уравнением: HOH ⇆ H+ + OH–. Вследствие диссоциации воды в любом водном растворе содержатся и ионы H+, и ионы OH–. Концентрации этих ионов можно рассчитать с помощью уравнения ионного произведения воды
C(H+)×C(OH–) = Kw,
где Kw – константа ионного произведения воды; при 25°C Kw = 10–14.
Растворы, в которых концентрации ионов H+ и OH– одинаковы, называются нейтральными растворами. В нейтральном растворе C(H+) = C(OH–) = 10–7 моль/л.
В кислом растворе C(H+) > C(OH–) и, как следует из уравнения ионного произведения воды, C(H+) > 10–7 моль/л, а C(OH–) < 10–7 моль/л.
В щелочном растворе C(OH–) > C(H+); при этом в C(OH–) > 10–7 моль/л, а C(H+) < 10–7 моль/л.
pH – величина, с помощью которой характеризуют кислотность или щёлочность водных растворов; эта величина называется водородным показателем и рассчитывается по формуле:
pH = –lg C(H+)
В кислом растворе pH<7; в нейтральном растворе pH=7; в щелочном растворе pH>7.
По аналогии с понятием «водородный показатель» (pH) вводится понятие «гидроксильный» показатель (pOH):
pOH = –lg C(OH–)
Водородный и гидроксильный показатели связаны соотношением
pH + pOH = 14
Гидроксильный показатель используется для расчёта pH в щелочных растворах.
Пример 7.1 Рассчитать pH 0,005 М раствора серной кислоты.
Серная кислота – сильный электролит, диссоциирующий в разбавленных растворах необратимо и полностью по схеме: H2SO4 ® 2 H+ + SO42–. Из уравнения процесса диссоциации видно, что C(H+) = 2·C(H2SO4) = 2 × 0,005 моль/л = 0,01 моль/л.
pH = –lg C(H+) = –lg 0,01 = 2.
Пример 7.2 Рассчитать pH 0,1 М раствора гидроксида натрия.
Гидроксид натрия – сильный электролит, диссоциирующий необратимо и полностью по схеме: NaOH ® Na++OH–. Из уравнения процесса диссоциации видно, что C(OH–) = C(NaOH) = 0,1 моль/л.
pOH = –lg C(H+) = –lg 0,1 = 1; pH = 14 – pOH = 14 – 1 = 13.
Диссоциация слабого электролита – это равновесный процесс. Константа равновесия, записанная для процесса диссоциации слабого электролита, называется константой диссоциации. Например, для процесса диссоциации уксусной кислоты
CH3COOH ⇆ CH3COO– + H+.
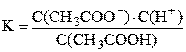
Каждая стадия диссоциации многоосновной кислоты характеризуется своей константой диссоциации. Константа диссоциации – справочная величина; см. [1; 2].
Расчёт концентраций ионов (и pH) в растворах слабых электролитов сводится к решению задачи на химическое равновесие для того случая, когда известна константа равновесия и необходимо найти равновесные концентрации веществ, участвующих в реакции (см. пример 6.2 – задача 2 типа).
Пример 7.3 Рассчитать pH и степень диссоциации электролита в растворе NH4OH с массовой долей 0,35%. Плотность раствора – 1 г/мл.
В 0,35% растворе NH4OH молярная концентрация гидроксида аммония равна 0,1 моль/л (пример перевода процентной концентрации в молярную – см. пример 5.1). Эту величину часто обозначают C0. C0 – это общая концентрация электролита в растворе (концентрация электролита до диссоциации).
NH4OH принято считать слабым электролитом, обратимо диссоциирующим в водном растворе: NH4OH ⇆ NH4+ + OH– (см. также примечание 2 на стр. 5). Константа диссоциации К = 1,8·10–5 (справочная величина). Поскольку слабый электролит диссоциирует неполностью, сделаем предположение, что продиссоциировало x моль/л NH4OH, тогда равновесная концентрация ионов аммония и гидроксид-ионов также будут равняться x моль/л: C(NH4+) = C(OH-) = x моль/л. Равновесная концентрация непродиссоциировавшего NH4OH равна: С(NH4OH) = (C0–x) = (0,1–x) моль/л.
Подставляем выраженные через x равновесные концентрации всех частиц в уравнение константы диссоциации:
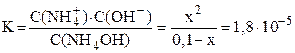 .
.
Очень слабые электролиты диссоциируют незначительно (x ® 0) и иксом в знаменателе как слагаемым можно пренебречь:
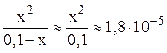 .
.
Обычно в задачах общей химии иксом в знаменателе пренебрегают в том случае, если  (в этом случае х – концентрация продиссоциировавшего электролита – в 10 и менее раз отличается от C0 – общей концентрации электролита в растворе).
(в этом случае х – концентрация продиссоциировавшего электролита – в 10 и менее раз отличается от C0 – общей концентрации электролита в растворе).
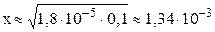 моль/л
моль/л
С(OH–) = x = 1,34∙10-3 моль/л; pOH = –lg C(OH–) = –lg 1,34∙10–3 = 2,87.
pH = 14 – pOH = 14 – 2,87 = 11,13.
Степень диссоциации электролита можно рассчитать как отношение концентрации продиссоциировавшего электролита (x) к общей концентрации электролита (C0):
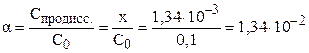 (1,34%).
(1,34%).
Пример 7.4 Рассчитать pH 30% раствора фосфорной кислоты (плотность раствора 1,18 г/мл. Чему равна степень диссоциации электролита в этом растворе?
Сначала следует перевести процентную концентрацию в молярную (см. пример 5.1). В данном случае C0(H3PO4) = 3,6 моль/л.
Расчёт концентрации ионов водорода в растворах многоосновных слабых кислот, проводится только по первой стадии диссоциации. Строго говоря, общая концентрация ионов водорода в растворе слабой многоосновной кислоты равна сумме концентраций ионов H+, образовавшихся на каждой стадии диссоциации. Например, для фосфорной кислоты C(H+)общая = C(H+)по 1 стадии + C(H+)по 2 стадии + C(H+)по 3 стадии. Однако, диссоциация слабых электролитов протекает преимущественно по первой стадии, а по второй и последующим стадиям – в незначительной степени, поэтому
C(H+)по 2 стадии ≈ 0, C(H+)по 3 стадии ≈ 0 и C(H+)общая ≈ C(H+)по 1 стадии.
Пусть фосфорной кислоты продиссоциировало по первой стадии x моль/л, тогда из уравнения диссоциации H3PO4 ⇆ H+ + H2PO4– следует, что равновесные концентрации ионов H+ и H2PO4– также будут равны x моль/л, а равновесная концентрация непродиссоциировавшей H3PO4 будет равна (3,6–x) моль/л. Подставляем выраженные через x концентрации ионов H+ и H2PO4– и молекул H3PO4 в выражение константы диссоциации по первой стадии (K1 = 7,5·10–3 – справочная величина):
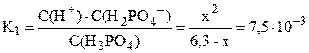
K1/C0 = 7,5·10–3 / 3,6 = 2,1·10–3 < 10–2; следовательно, иксом как слагаемым в знаменателе можно пренебречь (см. также пример 7.3) и упростить полученное выражение.
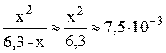 ;
;
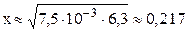 моль/л;
моль/л;
С(H+) = x = 0,217 моль/л; pH = –lg C(H+) = –lg 0,217 = 0,66.
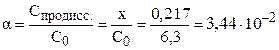 (3,44%)
(3,44%)






