n(H3PO4) = m(H3PO4): M(H3PO4) = 60 г: 98 г/моль = 0,612 моль;
Vраствора = mраствора: ρраствора = 100 г: 1,43 г/см3 = 69,93 см3 = 0,0699 л;
С(H3PO4) = n(H3PO4): Vраствора = 0,612 моль: 0,0699 л = 8,755 моль/л.
Пример 5.2 Имеется 0,5 М раствор H2SO4. Чему равна массовая доля серной кислоты в этом растворе? Плотность раствора принять равной 1 г/мл.
По определению молярной концентрации
в 1 л раствора содержится 0,5 моль H2SO4
(запись «0,5 М раствор» означает, что С(H2SO4) = 0,5 моль/л).
mраствора = Vраствора × ρраствора = 1000 мл × 1 г/мл = 1000 г;
m(H2SO4) = n(H2SO4) × M(H2SO4) = 0,5 моль × 98 г/моль = 49 г;
ω(H2SO4) = m(H2SO4): mраствора = 49 г: 1000 г = 0,049 (4,9%).
Пример 5.3 Какие объёмы воды и 96% раствора H2SO4 плотностью 1,84 г/мл необходимо взять для приготовления 2 л 60% раствора H2SO4 плотностью 1,5 г/мл.
При решении задач на приготовление разбавленного раствора из концентрированного следует учитывать, что исходный раствор (концентрированный), вода и полученный раствор (разбавленный) имеют различные плотности. В этом случае следует иметь в виду, что Vисходного раствора + Vводы ≠ Vполученного раствора,
потому что в ходе смешивания концентрированного раствора и воды происходит изменение (увеличение или уменьшение) объёма всей системы.
Решение подобных задач нужно начинать с выяснения параметров разбавленного раствора (т.е. того раствора, который нужно приготовить): его массы, массы растворённого вещества, если необходимо, то и количества растворённого вещества.
Масса раствора, который необходимо приготовить, равна:
M60% р-ра = V60% р-ра ∙ ρ60% р-ра = 2000 мл × 1,5 г/мл = 3000 г.
m(H2SO4)в 60% р-ре = m60% р-ра · w(H2SO4)в 60% р-ре = 3000 г · 0,6 = 1800 г.
Масса чистой серной кислоты в приготовленном растворе должна быть равна массе серной кислоты в той порции 96%-го раствора, которую необходимо взять для приготовления разбавленного раствора. Таким образом,
m(H2SO4)в 60% р-ре= m(H2SO4)в 96% р-ре = 1800 г.
m96% р-ра = m (H2SO4)в 96% р-ре: w(H2SO4)в 96% р-ре = 1800 г: 0,96 = 1875 г.
m (H2O) = m40% р-ра – m96% р-ра = 3000 г – 1875 г = 1125 г.
V96% р-ра = m96% р-ра: ρ96% р-ра = 1875 г: 1,84 г/мл = 1019 мл» 1,02 л.
Vводы = mводы: ρводы = 1125г: 1 г/мл = 1125 мл = 1,125 л.
Пример 5.4 Смешали 100 мл 0,1 M раствора CuCl2 и 150 мл 0,2 М раствора Cu(NO3)2 Рассчитать молярную концентрацию ионов Cu2+, Cl– и NO3– в полученном растворе.
При решении подобной задачи на смешивание разбавленных растворов, важно понимать что разбавленные растворы имеют приблизительно одинаковую плотность, примерно равную плотности воды. При их смешивании общий объём системы практически не изменяется: V1 разбавленного раствора + V2 разбавленного раствора +…» Vполученного раствора.
В первом растворе:
n(CuCl2) = C(CuCl2) · Vраствора CuCl2 = 0,1 моль/л × 0,1 л = 0,01 моль;
CuCl2 – сильный электролит: CuCl2 ® Cu2+ + 2Cl–;
Поэтому n(Cu2+) = n(CuCl2) = 0,01 моль; n(Cl–) = 2 × 0,01 = 0,02 моль.
Во втором растворе:
n(Cu(NO3)2) = C(Cu(NO3)2)×Vраствора Cu(NO3)2 = 0,2 моль/л × 0,15 л = 0,03 моль;
Cu(NO3)2 – сильный электролит: CuCl2 ® Cu2+ + 2NO3–;
Поэтому n(Cu2+) = n(Cu(NO3)2) = 0,03 моль; n(NO3–) = 2×0,03 = 0,06 моль.
После смешивания растворов:
n(Cu2+)общ. = 0,01 моль + 0,03 моль = 0,04 моль;
Vобщ.» Vраствора CuCl2 + Vраствора Cu(NO3)2 = 0,1 л + 0,15 л = 0,25 л;
C(Cu2+) = n(Cu2+): Vобщ. = 0,04 моль: 0,25 л = 0,16 моль/л;
C(Cl–) = n(Cl–): Vобщ. = 0,02 моль: 0,25 л = 0,08 моль/л;
C(NO3–) = n(NO3–): Vобщ. = 0,06 моль: 0,25 л = 0,24 моль/л.
Пример 5.5 В колбу внесли 684 мг сульфата алюминия и 1 мл 9,8% раствора серной кислоты плотностью 1,1 г/мл. Образовавшуюся смесь растворили в воде; объём раствора довели водой до 500 мл. Рассчитать молярные концентрации ионов H+, Al3+ SO42– в полученном растворе.
Рассчитаем количества растворяемых веществ:
n(Al2(SO4)3)=m(Al2(SO4)3): M(Al2(SO4)3)=0,684 г: 342 г моль=0,002 моль;
Al2(SO4)3 – сильный электролит: Al2(SO4)3 ® 2Al3+ + 3SO42–;
Поэтому n(Al3+)=2×0,002 моль=0,004 моль; n(SO42–)=3×0,002 моль=0,006 моль.
m раствора H2SO4 = V раствора H2SO4 × ρ раствора H2SO4 = 1 мл × 1,1 г/мл = 1,1 г;
m(H2SO4) = m раствора H2SO4 × w(H2SO4) = 1,1 г · 0,098 = 0,1078 г.
n(H2SO4) = m(H2SO4): M(H2SO4) = 0,1078 г: 98 г/моль = 0,0011 моль;
H2SO4 – сильный электролит: H2SO4 ® 2H+ + SO42–.
Поэтому n(SO42–) = n(H2SO4) = 0,0011 моль; n(H+) = 2 × 0,0011 = 0,0022 моль.
По условию задачи объём полученного раствора равен 500 мл (0,5 л).
n(SO42–)общ. = 0,006 моль + 0,0011 моль = 0,0071 моль.
С(Al3+) = n(Al3+): Vраствора = 0,004 моль: 0,5 л = 0,008 моль/л;
С(H+) = n(H+): Vраствора = 0,0022 моль: 0,5 л = 0,0044 моль/л;
С(SO42–) = n(SO42–)общ.: Vраствора = 0,0071 моль: 0,5 л = 0,0142 моль/л.
Пример 5.6 Какую массу железного купороса (FeSO4·7H2O) и какой объём воды необходимо взять для приготовления 3 л 10% раствора сульфата железа (II). Плотность раствора принять равной 1,1 г/мл.
Масса раствора, который необходимо приготовить, равна:
mраствора = Vраствора ∙ ρраствора = 3000 мл ∙ 1,1 г/мл = 3300 г.
Масса чистого сульфата железа (II) в этом растворе равна:
m(FeSO4) = mраствора × w(FeSO4) = 3300 г × 0,1 = 330 г.
Такая же масса безводного FeSO4 должна содержаться в том количестве кристаллогидрата, которое необходимо взять для приготовления раствора. Из сопоставления молярных масс М(FeSO4·7H2O) = 278 г/моль и М(FeSO4) = 152 г/моль,
получаем пропорцию:
в 278 г FeSO4·7H2O содержится 152 г FeSO4;
в х г FeSO4·7H2O содержится 330 г FeSO4;
x = (278·330): 152 = 603,6 г.
mводы = mраствора – mжелезного купороса = 3300 г – 603,6 г = 2696,4 г.
Т.к. плотность воды равна 1 г/мл, то объём воды, который необходимо взять для приготовления раствора равен: Vводы = mводы: ρводы = 2696,4 г: 1 г/мл = 2696,4 мл.
Пример 5.7 Какую массу глауберовой соли (Na2SO4·10H2O) нужно растворить в 500 мл 10% раствора сульфата натрия (плотность раствора 1,1 г/мл), чтобы получить 15%-ый раствор Na2SO4?
Пусть требуется x граммов глауберовой соли Na2SO4·10H2O. Тогда масса образующегося раствора равна:
m15% раствора = mисходного (10%) раствора + mглауберовой соли = 550 + x (г);
mисходного (10%) раствора = V10% раствора × ρ10% раствора = 500 мл × 1,1 г/мл = 550 г;
m(Na2SO4)в исходном (10%) растворе = m10% растворa · w(Na2SO4) = 550 г · 0,1 = 55 г.
Выразим через икс массу чистого Na2SO4, содержащегося в х граммах Na2SO4·10H2O.
М(Na2SO4·10H2O) = 322 г/моль; М(Na2SO4) = 142 г/моль; следовательно:
в 322 г Na2SO4·10H2O содержится 142 г безводного Na2SO4;
в х г Na2SO4·10H2O содержится m г безводного Na2SO4.
m(Na2SO4) = 142·x: 322 = 0,441×x.
Общая масса сульфата натрия в полученном растворе будет равна:
m(Na2SO4)в 15% растворе = 55 + 0,441×x (г).
В полученном растворе: 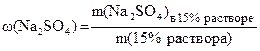 = 0,15
= 0,15
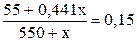 , откуда x = 94,5 г.
, откуда x = 94,5 г.
Далее (таблица 6) приводится перечень задач для самостоятельного решения.






