Одним из важнейших химических понятий, на котором основываются стехиометрические расчёты, является химическое количество вещества. Количество некоторого вещества X обозначается n(X). Единицей измерения количества вещества является моль.
Моль – это количество вещества, в котором содержится 6,02·1023 молекул, атомов, ионов или других структурных единиц, из которых состоит вещество.
Масса одного моля некоторого вещества Х называется молярной массой M(X) этого вещества. Зная массу m(X) некоторого вещества X и его молярную массу, можно рассчитать количество этого вещества по формуле:
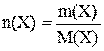 .
.
Число 6,02·1023 называется числом Авогадро (Na); его размерность моль–1.
Умножая число Авогадро Na на количество вещества n(X), можно рассчитать число структурных единиц, например, молекул N(X) некоторого вещества X:
N(X) = Na · n(X).
По аналогии с понятием молярной массы ввели понятие молярного объёма: молярный объём Vm(X) некоторого вещества X – это объём одного моля этого вещества. Зная объём вещества V(X) и его молярный объём, можно рассчитать химическое количество вещества:
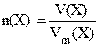 .
.
В химии особенно часто приходится иметь дело с молярным объёмом газов. Согласно закону Авогадро в равных объёмах любых газов, взятых при одной и той же температуре и равном давлении, содержится одно и тоже число молекул. При равных условиях 1 моль любого газа занимает один и тот же объём. При нормальных условиях (н.у.) – температура 0°С и давление 1 атмосфера (101325 Па) – этот объём равен 22,4 л. Таким образом, при н.у. Vm(газа) = 22,4 л/моль. Следует особо подчеркнуть, что величина молярного объёма 22,4 л/моль применяется только для газов.
Знание молярных масс веществ и числа Авогадро позволяет выразить массу молекулы любого вещества в граммах. Ниже приводится пример расчёта массы молекулы водорода.
1 моль газообразного водорода содержит 6,02·1023 молекул H2 и имеет массу 2 г (т.к. M(H2) = 2 г/моль). Следовательно,
6,02·1023 молекул H2 имеют массу 2 г;
1 молекула H2 имеет массу x г; x = 3,32·10–24 г.
Понятие «моль» широко используется для проведения расчётов по уравнениям химических реакций, поскольку стехиометрические коэффициенты в уравнении реакции показывают, в каких молярных соотношениях вещества реагируют друг с другом и образуются в результате реакции.
Например, уравнение реакции 4 NH3 + 3 O2 → 2 N2 + 6 H2O содержит следующую информацию: 4 моль аммиака реагируют без избытка и недостатка с 3 моль кислорода, при этом образуется 2 моль азота и 6 моль воды.
Пример 4.1 Рассчитайте массу осадка, образующегося при взаимодействии растворов, содержащих 70,2 г дигидрофосфата кальция и 68 г гидроксида кальция. Какое вещество останется в избытке? Чему равна его масса?
3 Ca(H2PO4)2 + 12 KOH ® Ca3(PO4)2¯ + 4 K3PO4 + 12 H2O
Из уравнения реакции видно, что 3 моль Ca(H2PO4)2 реагирует с 12 моль KOH. Рассчитаем количества реагирующих веществ, которые даны по условию задачи:
n(Ca(H2PO4)2) = m(Ca(H2PO4)2) / M(Ca(H2PO4)2) = 70,2 г: 234 г/моль = 0,3 моль;
n(KOH) = m(KOH) / M(KOH) = 68 г: 56 г/моль = 1,215 моль.
на 3 моль Ca(H2PO4)2 требуется 12 моль KOH
на 0,3 моль Ca(H2PO4)2 требуется х моль KOH
х = 1,2 моль – столько KOH потребуется, для того чтобы реакция прошла без избытка и недостатка. А по условию задачи имеется 1,215 моль KOH. Следовательно, KOH – в избытке; количество оставшегося после реакции KOH:
n(KOH) = 1,215 моль – 1,2 моль = 0,015 моль;
его масса m(KOH) = n(KOH) × M(KOH) = 0,015 моль × 56 г/моль = 0,84 г.
Расчёт образующегося продукта реакции (осадок Ca3(PO4)2) следует вести по веществу, которое находится в недостатке (в данном случае – Ca(H2PO4)2), так как это вещество прореагирует полностью. Из уравнения реакции видно, что число моль образующегося Ca3(PO4)2 в 3 раза меньше числа моль прореагировавшего Ca(H2PO4)2:
n(Ca3(PO4)2) = 0,3 моль: 3 = 0,1 моль.
Следовательно, m(Ca3(PO4)2) = n(Ca3(PO4)2)×M(Ca3(PO4)2) = 0,1 моль×310 г/моль = 31 г.






