Цель работы: изучить кислотно-основные и хелатообразующие свойства a-гидроксикислот и a-аминокислот.
Реактивы: салициловая кислота, ацетилсалициловая кислота, винная кислота, 5 %-ный раствор гидроксида калия, 10 %-ный раствор гидроксида натрия, 5 %-ный раствор сульфата меди; насыщенный раствор гидрокарбоната натрия; 5 %-ный раствор фенола; 1 %-ный раствор хлорида железа (III); молочная кислота; концентрированная серная кислота; глицин.
Опыт 3.1. Получение и свойства солей винной кислоты.
3.1.1. В пробирку помещают 0,5 мл 15 %-ного раствора винной кислоты и 0,5 мл 5 %-ного раствора гидроксида калия, интенсивно встряхивают и наблюдают постепенное выделение белого кристаллического осадка гидротартрата калия.
Уравнения реакций:
 |
3.1.2. К полученному осадку добавляют по каплям 10 %-ный раствор гидроксида натрия до полного его растворения. Образующийся раствор двойной калий-натриевой соли винной кислоты (сегнетовой соли) используют далее в опыте 3.1.3.
3.1.3. В пробирку помещают несколько капель 5 %-ного раствора сульфата меди, добавляют раствор гидроксида натрия до выпадения голубого осадка. К образовавшемуся осадку гидроксида меди (II) добавляют раствор сегнетовой соли, полученной в оп. 3.1.2. Отмечают изменение окраски раствора.
Уравнения реакций:
CuSO4 + 2NaOH ® Cu(OH)2↓+ Na2SO4
 |
Опыт 3.2. Свойства салициловой кислоты.
3.2.1. На предметное стекло помещают несколько кристаллов салициловой кислоты и добавляют одну каплю насыщенного раствора гидрокарбоната натрия. Наблюдают выделение газа.
Уравнение реакции:
С6Н5СООН + NaНCO3 ® С6Н5СООNa + CO2 + H2O
3.2.2. В сухую пробирку помещают 0,5 г салициловой кислоты и осторожно нагревают нижнюю часть пробирки. Происходит декарбоксилирование салициловой кислоты с образованием фенола, который обнаруживают по характерному запаху.
Уравнение реакции:
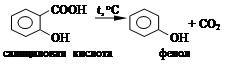
3.2.3. В две пробирки помещают по 0,5 г салициловой и ацетилсалициловой кислот, добавляют по 1 мл воды и к полученному раствору добавляют 1 - 2 капли бромной воды. Отмечают наблюдаемые изменения в каждой пробирке.
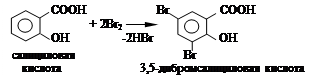 Уравнение реакции:
Уравнение реакции:
Опыт 3.3. Гидролиз ацетилсалициловой кислоты.
В две пробирки помещают по нескольку кристалликов ацетилсалициловой и салициловой кислоты, добавляют в каждую пробирку по 0,5 мл воды и 1 - 2 капли раствора хлорида железа (III), отмечают окраску раствора в каждой пробирке. Раствор нагревают до кипения, отмечают изменение окраски.
Опыт 3.4. Разложение молочной кислоты.
В пробирку наливают 1 мл молочной кислоты и 1 мл концентрированной серной кислоты. Нагревают смесь до кипения. Жидкость при этом темнеет и пенится с выделением газа.
Уравнение реакции:
СН3 – СН(ОН) – СООН  СН3 – СНО + HCООН
СН3 – СНО + HCООН
Опыт 3.5. Реакция аминокислот с хлоридом железа (III).
К 1 мл 5 %-ного раствора глицина добавляют несколько капель 5 %-ного раствора хлорида железа (III). Раствор слегка нагревают до изменения окраски.
Уравнение реакции:
 |
Опыт 3.6. Качественная реакция a-гидроксикислот с хлоридом железа (III).
В пробирку помещают 0,5 мл 5 %-ного раствора фенола и добавляют 1 - 2 капли 1 %-ного раствора хлорида железа (III). Раствор приобретает фиолетовую окраску. При добавлении к нему 1 - 2 капель молочной кислоты происходит изменение окраски раствора до зеленовато – желтой: кислота вытесняет фенол из комплексного фенолята с образованием лактата железа.
Уравнения реакций:
 |
Контрольные вопросы
1. Наличие какого фрагмента в молекуле винной кислоты доказывает реакция образования фелинговой жидкости?
2. Наличие какой функциональной группы в салициловой кислоте доказывает реакция декарбоксилирования?
3. Напишите схему гидролиза ацетилсалициловой кислоты. Какое применение в медицинской практике находит ацетилсалициловая кислота и продукт её гидролиза?
4. Образует ли салициловая кислота окрашенный комплекс с катионом железа? А бензойная кислота? Ответ поясните.
5. В чём отличие реакций разложения от реакций отщепления (элиминирования)? Как выглядел бы продукт взаимодействия молочной и серной кислот, если бы реакция проходила в других условиях и серная кислота выступала бы в роли водоотнимающего средства?
Лабораторная работа № 4. Окислительно - восстановительные свойства веществ.
Цель работы: изучить окислительно - восстановительные свойства органических соединений.
Реактивы: 10 %-ные растворы серной кислоты и гидроксида натрия, хромовая смесь, 5 %-ный раствор сульфата меди (II), 5 %-ный раствор перманганата калия, этанол, формальдегид; насыщенный раствор щавелевой кислоты; ацетон.
Опыт 4.1. Окисление спиртов.
В пробирку наливают 2 - 3 мл хромовой смеси и добавляют по каплям при встряхивании 0,5 мл этилового спирта. Наблюдают изменение цвета и температуры реакционной массы. Одновременно ощущается запах уксусного альдегида, напоминающий запах зеленого яблока (нюхать осторожно!).
Уравнение реакции
3С2Н5ОН + K2Cr2O7 + 4H2SO4 ® 3СН3CHO + K2SO4 + Cr2(SO4)3 + 7H2O
Опыт 4.2. Окисление альдегидов.
В две пробирки наливают по 10 капель 10 %-ного раствора гидроксида натрия, добавляют 5 капель раствора сульфата меди. К образовавшемуся голубому осадку гидроксида меди (II) добавляют: в первую пробирку – 10 капель раствора формальдегида, во вторую – 10 капель ацетона. Пробирки осторожно нагревают до кипения. Отмечают наблюдаемые изменения.
Уравнения реакций:
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
HCНО + 2Cu(OH)2↓  HCООН + 2CuOH↓ + H2O
HCООН + 2CuOH↓ + H2O
голубой желтый
2СuOH  Cu2O↓ + H2O,
Cu2O↓ + H2O,
красный
Сu(OH)2  CuO↓ + H2O СН3 – СО – СН3 + 2Cu(OH)2↓
CuO↓ + H2O СН3 – СО – СН3 + 2Cu(OH)2↓ 
черный
Опыт 4.3. Окисление щавелевой кислоты.
В пробирку наливают 2 - 3 мл 5 %-ного раствора перманганата калия, 1 мл 10 %-ного раствора серной кислоты и 1 мл насыщенного раствора щавелевой кислоты. Пробирку закрывают пробкой с изогнутой газоотводной трубкой, конец которой опускают в пробирку с 3 - 4 мл известковой воды. Реакционную смесь осторожно нагревают. Наблюдают за результатами реакции окисления щавелевой кислоты.
Уравнения реакций:
 |
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Контрольные вопросы
1. Сравните лёгкость окисления первичных, вторичных и третичных спиртов.
2. Какие карбонильные соединения окисляются в более мягких условиях: альдегиды или кетоны?
3. Можно ли отнести карбоновые кислоты к веществам, устойчивым к окислению? Какие карбоновые кислоты относительно легко вступают в реакции с окислителями?
4. В животных организмах одноосновные карбоновые кислоты окисляются, причем атом кислорода направляется всегда в одно и то же положение. В какое именно? В какую кислоту превращается масляная кислота в организме больных диабетом?
5. Соединения какого типа выступают в живых организмах в качестве ингибиторов окислительных процессов?
Лабораторная работа № 5. Свойства биологически активных гетероциклических соединений.
Цель работы: изучить основные и нуклеофильные свойства азотсодержащих гетероциклов.
Реактивы: пиридин, хинолин, мочевая кислота, концентрированная соляная кислота, 2 %-ный раствор хлорида железа (III), 2 %-ный раствор сульфата меди (II), насыщенный раствор пикриновой кислоты, йодметан, йодэтан.
Опыт 5.1. Свойства пиридина.
5.1.1. В пробирке смешивают 1 мл пиридина с 4 - 5 мл воды. Отмечают растворимость пиридина в воде и его специфический запах. Каплю полученного раствора наносят на красную лакмусовую бумагу, отмечают изменение окраски индикатора.
5.1.2. К капле пиридина осторожно прибавляют концентрированную соляную кислоту, наблюдают выпадение белого осадка и разогревание. К полученному осадку приливают воду.
Уравнения реакций:
 |
5.1.3. К 1 мл 2 %-ного раствора хлорида железа (III) добавляют 1 - 2 капли раствора пиридина, приготовленного в оп. 4.1.1. Наблюдают образование бурого осадка.
Уравнение реакции:
 |
5.1.4. К 1 мл 2 %-ного раствора сульфата меди (II) приливают 2 капли раствора пиридина, наблюдают выпадение голубого осадка гидроксида меди (II), который растворяется в избытке пиридина, образуя комплексную соль ярко-синего цвета.
Уравнение реакции:
 |
5.1.5. В две пробирки вносят по несколько капель пиридина. В одну добавляют равный объём йодметана, в другую – йодэтана. Пробирки слабо нагревают в водяной бане, реакционная масса в них мутнеет и расслаивается, выделяется жёлтое масло, которое затвердевает.
Уравнения реакций:
 |
Опыт 5.2. Свойства хинолина.
5.2.1. К 5 - 6 мл воды прибавляют при встряхивании 1 мг хинолина. Отмечают запах хинолина и его ограниченную растворимость в воде. После отстаивания сливают верхний водный слой в другую пробирку для последующих опытов. К нерастворившемуся хинолину по каплям при встряхивании приливают концентрированную соляную кислоту до полного растворения хинолина. При прибавлении раствора гидроксида натрия выделяются капли хинолина. Напишите уравнения реакций.
5.2.2. К нескольким каплям хинолина в пробирке осторожно при встряхивании добавляют равный объём йодистого метила. Пробирку слегка нагревают на водяной бане, наблюдают помутнение и выделение быстро затвердевающего масла. Полученную соль (йодид N-метилхинолиния) растворяют в небольшом объёме воды, добавляют раствор фенолфталеина и немного оксида серебра, встряхивают. Наблюдают выпадение осадка, раствор становится сильнощелочным из-за образования четвертичного аммониевого основания. Напишите уравнения реакций.
Опыт 5.3. Свойства мочевой кислоты.
5.3.1. К нескольким кристаллам (10 - 20 мг) мочевой кислоты в пробирке добавляют 2 - 3 мл воды и оценивают её растворимость при комнатной температуре. Затем пробирку нагревают и отмечают, изменяется ли растворимость кислоты. Пробирку охлаждают, приливают 10 %-ный раствор гидроксида натрия до полного растворения мочевой кислоты. Образуется урат натрия.
 Уравнение реакции:
Уравнение реакции:
Полученный щелочной раствор делят на две части. К первой части приливают разбавленную соляную кислоту, наблюдают образование малорастворимой соли – кислого урата натрия; продолжают подкисление – выпадает в осадок мочевая кислота. Вторую часть используют в оп. 5.3.2.
Уравнения реакций:
 |
5.3.2.Ко второй части щелочного раствора мочевой кислоты (оп. 5.3.1) добавляют равный объем реактива Фелинга, нагревают смесь. Выпадает осадок оксида меди (I).
Уравнение реакции:

На стеклянную пластинку (с подложенной белой бумагой) наносят каплю раствора карбоната натрия, смешивают её с каплей раствора нитрата серебра и вносят в получившуюся смесь несколько кристаллов мочевой кислоты; отмечают выпадение осадка и изменение его окраски. Карбонат натрия переводит мочевую кислоту в раствор, а выпавший вначале карбонат серебра восстанавливается до чёрного металлического серебра. Напишите уравнения этих реакций.
При действии сильных окислителей (например, азотной кислоты) мочевая кислота образует смесь продуктов окисления и гидратации. При действии на эту смесь аммиака образуется пурпуровокислый аммоний – мурексид розово-красного цвета.
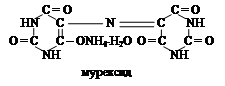 |
Мурексидная реакция используется не только для обнаружения мочевой кислоты, но и других производных пурина.
Контрольные вопросы
1. Приведите структурную формулу пиридина и пиррола и объясните ароматический характер данных соединений.
2. В какой из проведённых вами реакции проявляются основные, а в какой – нуклеофильные свойства пиридина? Сравните основные свойства пиридина или пиррола.
3. Сравните строение хинолина и пиридина. Какое кольцо (бензольное или пиридиновое) в хинолине окисляется легче? А восстанавливается? Приведите уравнения реакций.
4. Дайте определение таутомерии. Напишите таутомерные формы мочевой кислоты.




